Klinik çalışma

Klinik çalışmalar veya klinik deneyler, yeni tedaviler (yeni aşılar, ilaçlar, diyet seçenekleri, besin takviyeleri ve tıbbi cihazlar gibi) ve daha fazla çalışma ve karşılaştırma gerektiren bilinen müdahaleler dahil olmak üzere biyomedikal veya davranışsal müdahaleler hakkında belirli soruları yanıtlamak için tasarlanmış insan katılımcılar üzerinde ileriye dönük biyomedikal veya davranışsal araştırma çalışmalarıdır.[1][2] Klinik çalışmalar dozaj, güvenlik ve etkinlik hakkında veri üretir. Bunlar ancak tedavinin onaylanmasının istendiği ülkede sağlık otoritesi/etik komitesi onayı alındıktan sonra yürütülür. Bu makamlar çalışmanın risk/yarar oranını incelemekten sorumludur; onayları tedavinin 'güvenli' veya etkili olduğu anlamına gelmez, sadece çalışmanın yapılabileceği anlamına gelir.
Ürün türüne ve geliştirme aşamasına bağlı olarak, araştırmacılar başlangıçta gönüllüleri veya hastaları küçük pilot çalışmalara kaydeder ve daha sonra aşamalı olarak daha büyük ölçekli karşılaştırmalı çalışmalar yürütürler. Klinik çalışmalar boyut ve maliyet açısından farklılık gösterebilir ve tek bir ülkede veya birden fazla ülkede tek bir araştırma merkezini veya birden fazla merkezi içerebilir. Klinik çalışma tasarımı, sonuçların bilimsel geçerliliğini ve tekrarlanabilirliğini sağlamayı amaçlar.
Klinik çalışmaların maliyetleri onaylanan ilaç başına milyarlarca dolar arasında değişebilir[3] ve tamamlanması 11-14 yıl sürer.[4] Destekleyici bir kamu kuruluşu veya bir ilaç, biyoteknoloji veya tıbbi cihaz şirketi olabilir. İzleme ve laboratuar çalışmaları gibi deneme için gerekli bazı işlevler, sözleşmeli araştırma kuruluşu veya merkezi bir laboratuar gibi dış kaynaklı bir ortak tarafından yönetilebilir. İnsan klinik deneylerinde başlatılan tüm ilaçların yalnızca yüzde 10'u onaylanmış ilaç haline gelir.[5]
Genel bakış
[değiştir | kaynağı değiştir]İlaç çalışmaları
[değiştir | kaynağı değiştir]Bazı klinik çalışmalar, önceden herhangi bir tıbbi durumu olmayan sağlıklı denekleri kapsar. Diğer klinik çalışmalar, deneysel bir tedaviyi denemek isteyen belirli sağlık sorunları olan kişilerle ilgilidir. Pilot deneyler, takip edecek klinik çalışmanın tasarımı için fikir edinmek amacıyla yürütülür.
Tıbbi tedavileri test etmenin iki amacı vardır: yeterince iyi çalışıp çalışmadıklarını öğrenmek, buna "etkinlik" veya "etkililik" denir; ve yeterince güvenli olup olmadıklarını öğrenmek, buna "güvenlik" denir.[1] Her ikisi de mutlak bir kriter değildir; hem güvenlik hem de etkinlik, tedavinin nasıl kullanılacağı, başka hangi tedavilerin mevcut olduğu ve hastalığın veya durumun ciddiyetine göre değerlendirilir.[6][7]:8 Örneğin, kanseri tedavi etmek için kullanılan birçok ilacın, reçetesiz satılan bir ağrı kesici ilaç için kabul edilemeyecek ciddi yan etkileri vardır, ancak kanser ilaçları bir doktor gözetiminde ve yaşamı tehdit eden bir durum için kullanıldığından onaylanmıştır.[8]
ABD'de yaşlılar nüfusun %14'ünü oluştururken, ilaçların üçte birinden fazlasını tüketmektedirler.[9] daha büyük sağlık sorunları ve ilaç kullanımları veri yorumlamasını zorlaştırdığı ve genç insanlardan farklı fizyolojik kapasiteye sahip oldukları için genellikle çalışmaların dışında bırakılır. Çocuklar ve ilgisiz tıbbi rahatsızlıkları olan kişiler de sıklıkla kapsam dışı bırakılmaktadır.[10] Hamile kadınlar fetüse yönelik potansiyel riskler nedeniyle sıklıkla çalışma dışı bırakılmaktadır.
Destekleyici, yeni ilaçla hangi alternatif veya mevcut tedavilerin karşılaştırılacağı ve ne tür hastaların fayda görebileceği de dahil olmak üzere, uzman klinik araştırmacılardan oluşan bir panel ile koordinasyon içinde çalışmayı tasarlar. Destekleyici bir lokasyonda yeterli sayıda denek bulamazsa, diğer lokasyonlardaki araştırmacılar çalışmaya katılmak üzere işe alınır.
Deneme sırasında, araştırmacılar önceden belirlenmiş özelliklere sahip denekleri işe alır, tedaviyi/tedavileri uygular ve tanımlanmış bir süre boyunca deneklerin sağlığı hakkında veri toplar. Veriler arasında yaşamsal belirtiler, çalışma ilacının kandaki veya dokulardaki konsantrasyonu, semptomlardaki değişiklikler ve çalışma ilacının hedeflediği durumda iyileşme veya kötüleşme olup olmadığı gibi ölçümler yer alır. Araştırmacılar verileri çalışma sponsoruna gönderir ve sponsor da istatistiksel testler kullanarak birleştirilmiş verileri analiz eder.
Klinik çalışma hedeflerine örnek olarak bir ilacın veya cihazın güvenliğinin ve göreceli etkinliğinin değerlendirilmesi verilebilir:
- Belirli bir hasta türü üzerinde
- Değişen dozajlarda
- Yeni bir endikasyon için
- Bir durumun tedavisinde, o duruma yönelik standart tedaviye kıyasla iyileştirilmiş etkinliğin değerlendirilmesi
- Çalışma ilacı veya cihazının, söz konusu durum için halihazırda onaylanmış/yaygın olarak kullanılan iki veya daha fazla müdahaleye göre değerlendirilmesi
Çoğu klinik çalışma yeni müdahalenin bir alternatifini test ederken, bazıları üç veya dörde kadar genişler ve bir plasebo içerebilir.
Küçük, tek lokasyonlu denemeler dışında, tasarım ve hedefler klinik çalışma protokolü adı verilen bir belgede belirtilir. Protokol, çalışmanın "kullanım kılavuzu"dur ve tüm araştırmacıların araştırmayı benzer denekler üzerinde aynı şekilde gerçekleştirmesini ve verilerin tüm denekler arasında karşılaştırılabilir olmasını sağlar.
Bir çalışma, hipotezleri test etmek ve sonuçları titizlikle izlemek ve değerlendirmek için tasarlandığından, bilimsel yöntemin, özellikle de deneysel adımın bir uygulaması olarak görülebilir.
En yaygın klinik çalışmalar yeni farmasötik ürünleri, tıbbi cihazları, biyolojik maddeleri, tanı testlerini, psikolojik tedavileri veya diğer müdahaleleri değerlendirir.[11] Ulusal bir düzenleyici otorite yeniliğin pazarlanmasını onaylamadan önce klinik deneyler gerekebilir.[12]
Cihaz denemeleri
[değiştir | kaynağı değiştir]İlaçlara benzer şekilde, Amerika Birleşik Devletleri'ndeki tıbbi cihaz üreticilerinin de pazarlama öncesi onay için klinik deneyler yürütmeleri gerekmektedir.[13] Cihaz denemeleri yeni bir cihazı yerleşik bir tedaviyle karşılaştırabilir veya benzer cihazları birbirleriyle karşılaştırabilir. Vasküler cerrahi alanında ilkine örnek olarak, abdominal aort anevrizmasının tedavisi için eski açık aort onarım tekniğini daha yeni endovasküler anevrizma onarım cihazıyla karşılaştıran Açık ve Endovasküler Onarım (OVER denemesi) verilebilir.[14] İkincisine bir örnek, yetişkin kadınlarda idrar kaçırma tedavisinde kullanılan mekanik cihazlarla ilgili klinik çalışmalardır.[15]
Prosedür denemeleri
[değiştir | kaynağı değiştir]İlaçlara benzer şekilde, tıbbi veya cerrahi prosedürler de klinik çalışmalara tabi tutulabilir,[16] örneğin subfertilite için fibroid tedavisinde farklı cerrahi yaklaşımların karşılaştırılması gibi.[17] Ancak, cerrahi ortamda klinik çalışmalar etik olmadığında veya lojistik olarak mümkün olmadığında, vaka kontrollü çalışmalar bunun yerini alacaktır.[18]
Tarihçe
[değiştir | kaynağı değiştir]Gelişim
[değiştir | kaynağı değiştir]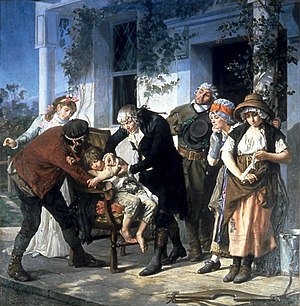
Erken dönem tıbbi deneyler sıklıkla yapılmasına rağmen, müdahalenin etkinliğinin gösterilmesi için doğru bir karşılaştırma sağlayacak bir kontrol grubunun kullanılması genellikle eksikti. Örneğin, çiçek hastalığını önlemek için inokülasyonun (o zamanlar variolasyon olarak adlandırılıyordu) başlatılması için kampanya yürüten Mary Wortley Montagu, ölüm cezasına çarptırılmış yedi mahkûmun hayatları karşılığında variolasyona tabi tutulmasını ayarladı. Hayatta kalmalarına ve çiçek hastalığına yakalanmamalarına rağmen, bu sonucun inokülasyondan mı yoksa başka bir faktörden mi kaynaklandığını değerlendirecek bir kontrol grubu yoktu. Edward Jenner tarafından çiçek aşısı üzerinde yapılan benzer deneyler de kavramsal olarak aynı derecede kusurluydu.[19]
İlk uygun klinik çalışma İskoç doktor James Lind tarafından gerçekleştirilmiştir.[20] Günümüzde C vitamini eksikliğinden kaynaklandığı bilinen iskorbüt hastalığı, uzun mesafeli okyanus yolculuklarında mürettebatın refahı üzerinde genellikle korkunç etkiler yaratırdı. 1740'ta Anson'ın deniz turunun felaketle sonuçlanması Avrupa'da büyük yankı uyandırdı; 1900 kişiden 1400'ü ölmüştü ve bunların çoğunun iskorbüt hastalığına yakalandığı iddia ediliyordu.[21] İngiliz Doğu Hindistan Şirketinin İngiliz askeri cerrahı John Woodall, 17. yüzyıldan itibaren turunçgillerin (iskorbüt önleyici etkisi vardır) tüketilmesini tavsiye etmiş, ancak bunların kullanımı yaygınlaşmamıştır.[22]
Lind 1747 yılında ilk sistematik klinik çalışmayı gerçekleştirmiştir.[23] Denizde iki ay geçirdikten sonra - gemidekiler zaten iskorbüt hastalığına yakalanmışken - asidik nitelikte bir besin takviyesini deneye dahil etti. On iki iskorbüt hastası denizciyi ikişer kişilik altı gruba ayırdı. Hepsine aynı diyet uygulanmış ancak ek olarak birinci gruba günde bir litre elma şarabı, ikinci gruba yirmi beş damla vitriol iksiri (sülfürik asit), üçüncü gruba altı kaşık sirke, dördüncü gruba yarım litre deniz suyu, beşinci gruba iki portakal ve bir limon, son gruba ise baharatlı bir macun ve arpa suyu verilmiştir. Beşinci grubun tedavisi altı gün sonra meyveleri bitince durdurulmuştur, ancak o zamana kadar bir denizci göreve hazır hale gelmiş, diğeri ise neredeyse iyileşmiştir. Bunun dışında sadece birinci grup tedavinin bir miktar etkisini gösterdi.[24] Lind'in araştırmasının onuruna her yıl 20 Mayıs Klinik Denemeler Günü olarak kutlanmaktadır.[25]
1750'den sonra disiplin modern şeklini almaya başladı.[26][27] İngiliz doktor John Haygarth, Perkin'in traktörleri adlı etkisiz ilaç üzerine yaptığı ünlü çalışmasında plasebo etkisinin doğru tanımlanması için bir kontrol grubunun önemini ortaya koymuştur. Bu yöndeki diğer çalışmalar 1860'larda seçkin doktor William Gull tarafından yürütülmüştür.[19]
Londra'daki Guy's Hospital'da çalışan Frederick Akbar Mahomed (ö. 1884), klinik deneyler sürecine önemli katkılarda bulunmuş ve "ikincil hipertansiyonlu kronik nefriti bugün esansiyel hipertansiyon olarak adlandırdığımız durumdan ayırmıştır. Ayrıca Britanya Tabipler Birliği için Toplu Araştırma Kaydını kurdu; bu organizasyon hastane ortamı dışında çalışan hekimlerden veri topladı ve modern işbirliğine dayalı klinik çalışmaların öncüsü oldu."[28]
Modern çalışmalar
[değiştir | kaynağı değiştir]
Sir Ronald A. Fisher, tarım alanında Rothamsted deney istasyonunda çalışırken, 1920'lerde deneylerin uygun şekilde tasarlanması için doğru bir metodoloji olarak Deneysel Tasarım İlkelerini geliştirmiştir. Başlıca fikirleri arasında rastgeleleştirmenin önemi - bireylerin deney için farklı gruplara rastgele atanması;[29] tekrarlama - belirsizliği azaltmak için ölçümlerin tekrarlanması ve varyasyon kaynaklarını belirlemek için deneylerin tekrarlanması;[30] bloklama - deneysel birimlerin birbirine benzer birimlerden oluşan gruplar halinde düzenlenmesi ve böylece alakasız varyasyon kaynaklarının azaltılması; faktöriyel deneylerin kullanılması - birkaç bağımsız faktörün etkilerini ve olası etkileşimlerini değerlendirmede etkilidir.[19]
İngiliz Tıbbi Araştırma Konseyi 1930'lu yıllardan itibaren klinik denemelerin önemini resmen kabul etmiştir. Konsey, deneysel gerekçelerle hastalıkların tedavisinde değer taşıması muhtemel görünen yeni ürünler üzerinde uygun şekilde kontrol edilen klinik deneylerin düzenlenmesine yardımcı olmak ve tavsiyelerde bulunmak üzere Terapötik Denemeler Komitesi'ni kurmuştur.[19]
İlk randomize tedavi denemesi MRC Tüberküloz Araştırma Biriminde Sir Geoffrey Marshall (1887-1982) tarafından gerçekleştirilmiştir. 1946-1947 yılları arasında gerçekleştirilen deney, streptomisin kimyasalının akciğer tüberkülozunu iyileştirmedeki etkinliğini test etmeyi amaçlıyordu. Deneme hem çift kör hem de plasebo kontrollüydü.[31]
Klinik deneylerin metodolojisi, streptomisin deneylerinde yer almış olan Sir Austin Bradford Hill tarafından daha da geliştirilmiştir. Hill, 1920'lerden itibaren istatistiği tıbba uyguladı ve diğerlerinin yanı sıra ünlü matematikçi Karl Pearson'ın derslerine katıldı. Richard Doll ile birlikte sigara ve akciğer kanseri arasındaki korelasyon üzerine yürüttüğü dönüm noktası niteliğindeki çalışmasıyla ünlendi. İkili, 1950 yılında akciğer kanseri hastalarını eşleştirilmiş kontrol grubu ile karşılaştıran bir vaka kontrol çalışması yürütmüş ve ayrıca sigara ve sağlık konusunda 30.000'den fazla doktorun sigara içme alışkanlıklarını ve sağlık durumlarını birkaç yıl boyunca incelemeyi içeren uzun vadeli bir prospektif çalışma başlatmıştır. Royal Society'ye seçilme belgesinde kendisi için "... yeni terapötik ve profilaktik ajanların değerlendirilmesinde şu anda ulusal ve uluslararası düzeyde kullanılan hassas deneysel yöntemlerin tıpta geliştirilmesinde lider" ifadesi kullanılmıştır.
Uluslararası klinik çalışmalar günü 20 Mayıs'ta kutlanmaktadır.[32]
Klinik çalışmaların başlıklandırılmasında kullanılan kısaltmalar genellikle yapmacıktır ve alay konusu olmuştur.[33]
Türler
[değiştir | kaynağı değiştir]Klinik çalışmalar, araştırmacılar tarafından oluşturulan araştırma hedefine göre sınıflandırılır.[11]
- Gözlemsel bir çalışmada, araştırmacılar denekleri gözlemler ve sonuçlarını ölçer. Araştırmacılar çalışmayı aktif olarak yönetmezler.[34]
- Girişimsel bir çalışmada, araştırmacılar araştırma deneklerine deneysel bir ilaç, cerrahi prosedür, tıbbi cihaz kullanımı, teşhis veya başka bir müdahale vererek tedavi edilen denekleri tedavi görmeyen veya standart tedavi görenlerle karşılaştırırlar. Daha sonra araştırmacılar deneklerin sağlığının nasıl değiştiğini değerlendirirler.[34]
Çalışmalar amaçlarına göre sınıflandırılır. Çalışma sponsoruna insan araştırmaları için onay verildikten sonra, ABD Gıda ve İlaç İdaresi (FDA) çalışmaların sonuçlarını türlerine göre düzenler ve izler:[11]
- Korunma çalışmaları, hastalığı hiç geçirmemiş kişilerde hastalığı önlemenin veya bir hastalığın geri dönmesini engellemenin yollarını arar. Bu yaklaşımlar ilaçlar, vitaminler veya diğer mikro besinler, aşılar veya yaşam tarzı değişikliklerini içerebilir.
- Tarama çalışmaları, belirli hastalıkları veya sağlık koşullarını tanımlamanın yollarını test eder.
- Teşhis çalışmaları, belirli bir hastalığı veya durumu teşhis etmek için daha iyi testler veya prosedürler bulmak amacıyla yürütülür.
- Tedavi çalışmaları deneysel ilaçları, yeni ilaç kombinasyonlarını veya cerrahi ya da radyasyon tedavisine yeni yaklaşımları test eder.
- Yaşam kalitesi çalışmaları (destekleyici bakım denemeleri) kronik bir hastalığı olan kişilerin konforunun ve bakım kalitesinin nasıl iyileştirileceğini değerlendirir.
- Genetik çalışmalar, bir kişinin bir hastalığa yakalanma olasılığını artıran veya azaltan genetik bozuklukların tahmin doğruluğunu değerlendirmek için yürütülür.
- Epidemiyolojik çalışmalar, çok sayıda insanda hastalıkların genel nedenlerini, modellerini veya kontrolünü belirleme amacına sahiptir.
- Merhametli kullanım çalışmaları veya genişletilmiş erişim çalışmaları, başka gerçekçi seçenekleri olmayan az sayıda hastaya kısmen test edilmiş, onaylanmamış terapötikler sağlar. Genellikle bu, etkili bir tedavinin onaylanmadığı bir hastalığı veya tüm standart tedavileri başarısız olmuş ve sağlığı randomize klinik çalışmalara katılmaya uygun olmayacak kadar tehlikede olan bir hastayı içerir.[35] Genellikle, bu tür istisnalar için hem FDA hem de ilaç şirketi tarafından vaka bazında onay verilmelidir.
- Sabit çalışmalar, mevcut verileri yalnızca araştırmanın tasarımı sırasında dikkate alır, araştırma başladıktan sonra değişiklik yapmaz ve çalışma tamamlanana kadar sonuçları değerlendirmez.
- Uyarlanabilir klinik çalışmalar, araştırmayı tasarlamak için mevcut verileri kullanır ve daha sonra araştırma ilerledikçe değişiklik yapmak için ara sonuçları kullanır. Değişiklikler arasında dozaj, örneklem büyüklüğü, denenen ilaç, hasta seçim kriterleri ve "kokteyl" karışımı yer alır.[36] Uyarlanabilir çalışmalar, denemenin ilerleyişini değerlendirmek için genellikle Bayes deneysel tasarımını kullanır. Bazı durumlarda denemeler, daha fazla bilgi elde edildikçe düzenli olarak tedavilerin ve hasta gruplarının eklendiği ve çıkarıldığı devam eden bir süreç haline gelmiştir.[37] Amaç, terapötik etkisi olan ilaçları daha hızlı bir şekilde belirlemek ve ilacın uygun olduğu hasta popülasyonlarını sıfırlamaktır.[38][39]
Klinik araştırmalar tipik olarak dört aşamada yürütülür ve her aşamada farklı sayıda denek kullanılır ve belirli bir etkiyi belirlemeye odaklanmak için farklı bir amaca sahiptir.[11]
Fazlar
[değiştir | kaynağı değiştir]Yeni ilaçları içeren klinik çalışmalar genellikle beş faza ayrılır. İlaç onay sürecinin her aşaması ayrı bir klinik çalışma olarak değerlendirilir. İlaç geliştirme süreci normalde I-IV fazları boyunca uzun yıllar boyunca, sıklıkla on yıl veya daha uzun bir süreyi kapsayacak şekilde ilerleyecektir. İlaç I, II ve III fazlarından başarıyla geçerse genellikle ulusal düzenleyici otorite tarafından genel popülasyonda kullanım için onaylanacaktır.[11] Faz IV denemeleri, yeni onaylanan ilaç, tanı veya cihaz piyasaya sürüldükten sonra gerçekleştirilir ve riskler, faydalar veya en iyi kullanımlar hakkında değerlendirme sağlar.[11]
| Faz | Amaç | Notlar |
|---|---|---|
| Faz 0 | İnsanlarda farmakodinamik ve farmakokinetik | Faz 0 denemeleri isteğe bağlı ilk insan denemeleridir. Çalışma ilacının veya tedavisinin tek subterapötik dozları, ajanın farmakodinamiği (ilacın vücuda ne yaptığı) ve farmakokinetiği (vücudun ilaçlara ne yaptığı) hakkında ön veri toplamak için az sayıda deneğe (tipik olarak 10 ila 15) verilir.[40] Bir test ilacı için deneme, bunların beklendiği gibi göründüğünü doğrulamak için ilacın emilimini, dağılımını, metabolizasyonunu ve klirensini (atılımını) ve ilacın vücuttaki etkileşimlerini belgeler. |
| Faz I | Güvenlik taraması | Genellikle birinci şahıs denemeleridir. Güvenliği değerlendirmek, güvenli dozaj aralıklarını belirlemek ve yan etkileri tanımlamak için küçük bir grup insan (tipik olarak 20-80) üzerinde yapılan testlerdir.[11] |
| Faz II | Genellikle bir plasebo kontrol grubuna karşı bir "tedavi grubunda" ilacın ön etkinliğinin belirlenmesi | Faz II-a özellikle dozaj gereksinimlerini (ne kadar ilaç verilmesi gerektiği) değerlendirmek için tasarlanırken,[11][41] Faz II-b çalışması etkinliği belirlemek için tasarlanmıştır ve ilacın reçete edilen doz(lar)da ne kadar iyi çalıştığını inceleyerek terapötik bir doz aralığı oluşturur.[41] |
| Faz III | Güvenlik ve etkinliğin nihai onayı | İlacın etkinliğini doğrulamak, etkililiğini değerlendirmek, yan etkilerini izlemek, yaygın olarak kullanılan tedavilerle karşılaştırmak ve güvenli bir şekilde kullanılmasını sağlayacak bilgileri toplamak için büyük insan gruplarıyla (tipik olarak 1.000-3.000) yapılan testlerdir.[11] |
| Faz IV | Satış sırasında güvenlik çalışmaları | Pazarlama sonrası çalışmalar riskleri, faydaları ve optimal kullanımı tanımlar. Bu nedenle, ilacın aktif tıbbi kullanım ömrü boyunca devam eder.[11] |
Çalışma tasarımı
[değiştir | kaynağı değiştir]Kanıta dayalı uygulamada temel bir ayrım, gözlemsel çalışmalar ile randomize kontrollü çalışmalar arasındadır.[42] Epidemiyolojide kohort çalışması ve vaka kontrol çalışması gibi gözlemsel çalışma türleri, randomize kontrollü çalışmaya göre daha az ikna edici kanıtlar sağlar.[42] Gözlemsel çalışmalarda, araştırmacılar katılımcılara verilen tedaviler ile sağlık durumları arasındaki ilişkileri geriye dönük olarak değerlendirir ve bu da tasarım ve yorumlamada önemli hatalara yol açabilir.[43]
Randomize kontrollü bir çalışma, çalışma tedavisinin insan sağlığı üzerinde bir etkiye neden olduğuna dair ikna edici kanıtlar sağlayabilir.[42]
Bazı Faz II ve çoğu Faz III ilaç çalışmaları randomize, çift kör ve plasebo kontrollü olarak tasarlanır.
- Randomize: Her bir çalışma deneği; çalışma tedavisi veya plasebo almak üzere rastgele atanmıştır.
- Kör: Çalışmaya katılan denekler hangi çalışma tedavisini aldıklarını bilmezler. Çalışma çift kör ise araştırmacılar da bir deneğin hangi tedaviyi aldığını bilmezler. Bunun amacı, araştırmacıların iki gruba farklı muamele etmesini önlemektir. "Çift kukla" tasarımı olarak adlandırılan bir çift kör çalışma biçimi, önyargıya karşı ek bir sigorta sağlar. Bu tür bir çalışmada, tüm hastalara dönüşümlü olarak hem plasebo hem de aktif dozlar verilir.
- Plasebo kontrollü: Plasebo (sahte tedavi) kullanımı, araştırmacıların çalışma tedavisinin etkisini plasebo etkisinden izole etmelerini sağlar.
Az sayıda denek içeren klinik çalışmalar, tek bir araştırmacı veya küçük bir araştırmacı grubu tarafından "desteklenebilir" ve basit soruları test etmek veya daha kapsamlı bir randomize kontrollü çalışma için araştırmayı genişletmek üzere fizibilite yapmak üzere tasarlanmıştır.[44]
Klinik çalışmalar akademik kurumlar, ilaç şirketleri, devlet kurumları ve hatta özel gruplar tarafından "desteklenebilir" (finanse edilebilir ve organize edilebilir). Çalışmalar; yeni ilaçlar, biyoteknoloji, tanı testleri veya tıbbi cihazlar için, pazar onayını belirleyecek olan düzenleyici incelemeye sunulmadan önce güvenlik ve etkinliklerini belirlemek amacıyla yürütülür.
Aktif kontrol çalışmaları
[değiştir | kaynağı değiştir]Birçok durumda, bir hastalıktan muzdarip bir kişiye plasebo vermek etik olmayabilir.[45] Bunu ele almak için "aktif karşılaştırıcı" ("aktif kontrol" olarak da bilinir) denemeler yapmak yaygın bir uygulama haline gelmiştir. Aktif kontrol grubu olan denemelerde, deneklere ya deneysel tedavi ya da daha önce onaylanmış ve etkinliği bilinen bir tedavi verilir.
Ana protokol
[değiştir | kaynağı değiştir]Bu tür çalışmalarda birden fazla deneysel tedavi tek bir denemede test edilir. Genetik testler, araştırmacıların hastaları genetik profillerine göre gruplandırmalarını, bu profile dayalı ilaçları bu gruba vermelerini ve sonuçları karşılaştırmalarını sağlar. Her biri farklı bir ilaç getiren birden fazla şirket katılabilir. Bu tür ilk yaklaşım, hastadan hastaya değişen genetik bozukluklar içeren skuamöz hücre kanserini hedeflemektedir. Amgen, AstraZeneca ve Pfizer ilk kez bir geç aşama denemesinde birlikte çalışmaktadır. Genomik profilleri deneme ilaçlarından herhangi biriyle eşleşmeyen hastalar, bağışıklık sistemini kansere saldırması için uyarmak üzere tasarlanmış bir ilaç almaktadırlar.[46]
Klinik çalışma protokolü
[değiştir | kaynağı değiştir]Klinik çalışma protokolü, araştırmayı tanımlamak ve yönetmek için kullanılan bir belgedir. Uzmanlardan oluşan bir panel tarafından hazırlanır. Tüm çalışma araştırmacılarının protokole sıkı sıkıya uyması beklenir.
Protokol, planlanan araştırmanın bilimsel gerekçesini, hedef(ler)ini, tasarımını, metodolojisini, istatistiksel değerlendirmelerini ve organizasyonunu açıklar. Araştırmanın ayrıntıları, araştırmacı broşürü gibi protokolde atıfta bulunulan belgelerde sağlanır.
Protokol, araştırma deneklerinin güvenliğini ve sağlığını güvence altına almak ve araştırmacılar tarafından araştırmanın yürütülmesi için kesin bir şablon sağlamak için kesin bir çalışma planı içerir. Bu, verilerin tüm araştırmacılar/siteler arasında birleştirilmesini sağlar. Protokol ayrıca çalışma yöneticilerini de (genellikle sözleşmeli bir araştırma kuruluşu) bilgilendirir.
Amerika Birleşik Devletleri, Avrupa Birliği veya Japonya'daki ilaç, biyoteknoloji veya tıbbi cihaz şirketleri tarafından desteklenen klinik araştırma protokollerinin formatı ve içeriği, Beşeri İlaçların Tescili için Teknik Gerekliliklerin Uyumlaştırılması Uluslararası Konferansı (ICH) tarafından yayınlanan[47] İyi Klinik Uygulama kılavuzuna uyacak şekilde standartlaştırılmıştır.[48] Kanada ve Avustralya'daki düzenleyici makamlar da ICH kılavuzlarını takip etmektedir. Trials gibi dergiler araştırmacıları protokollerini yayınlamaya teşvik etmektedir.
Tasarım özellikleri
[değiştir | kaynağı değiştir]Aydınlatılmış ona
[değiştir | kaynağı değiştir]
Klinik araştırmalar, çalışmaya katılan kişilere "aydınlatılmış onamlarını" temsil eden bir belge imzalatır.[49] Belgede çalışmanın amacı, süresi, gerekli prosedürler, riskler, potansiyel faydalar, kilit kişiler ve kurumsal gereklilikler gibi ayrıntılar yer alır.[50] Katılımcı daha sonra belgeyi imzalayıp imzalamayacağına karar verir. Katılımcı herhangi bir ceza olmaksızın istediği zaman geri çekilebileceğinden, belge bir sözleşme değildir.
Aydınlatılmış onam, bir katılımcının katılıp katılmamaya karar vermeden önce temel gerçekler hakkında bilgilendirildiği yasal bir süreçtir.[49] Araştırmacılar çalışmanın ayrıntılarını deneğin anlayabileceği şekilde açıklar. Bilgiler deneğin anadilinde sunulur. Genel olarak çocuklar kendi başlarına aydınlatılmış onam veremezler, ancak yaşlarına ve diğer faktörlere bağlı olarak bilgilendirilmiş onay vermeleri gerekebilir.
İstatistiksel güç
[değiştir | kaynağı değiştir]Herhangi bir klinik çalışmada, örneklem büyüklüğü olarak da adlandırılan denek sayısı, müdahalenin etkilerini güvenilir bir şekilde tespit etme ve ölçme yeteneği üzerinde büyük bir etkiye sahiptir. Bu yetenek "güç" olarak tanımlanır ve çalışmanın maliyetine değip değmeyeceğini anlamak için bir çalışma başlatılmadan önce hesaplanmalıdır.[51] Genel olarak, daha büyük bir örneklem büyüklüğü istatistiksel gücü ve aynı zamanda maliyeti artırır.
İstatistiksel güç, bir denemenin tedavi ve kontrol grupları arasında belirli bir büyüklükteki (veya daha büyük) bir farkı tespit etme yeteneğini tahmin eder. Örneğin, her grupta 100 hasta bulunan plaseboya karşı lipit düşürücü bir ilaç denemesi, 10 mg/dL veya daha fazla doz alan plasebo ve deneme grupları arasındaki farkı tespit etmek için 0,90'lık bir güce sahip olabilir, ancak 6 mg/dL'lik bir farkı tespit etmek için yalnızca 0,70'lik bir güce sahip olabilir.
Plasebo grupları
[değiştir | kaynağı değiştir]Sadece bir tedavi uygulamanın spesifik olmayan etkileri olabilir. Bunlar, sadece plasebo alan hastaların dahil edilmesiyle kontrol edilir. Denekler, hangi gruba ait oldukları bildirilmeden rastgele atanır. Birçok çalışma çift kördür, böylece araştırmacılar bir deneğin hangi gruba atandığını bilmezler.
Bir deneğin plasebo grubuna atanması, mevcut en iyi tedaviyi alma hakkını ihlal ediyorsa etik bir sorun teşkil edebilir. Helsinki Bildirgesi bu konuda kılavuz ilkeler sunmaktadır.
Süre
[değiştir | kaynağı değiştir]
Klinik çalışmalar, yeni bir tedavi geliştirmek için yapılan araştırmaların sadece küçük bir kısmıdır. Örneğin potansiyel ilaçların klinik çalışmalara girmeden önce keşfedilmesi, saflaştırılması, karakterize edilmesi ve laboratuvarlarda (hücre ve hayvan çalışmalarında) test edilmesi gerekir. Toplamda, sadece bir tanesi klinik bir deneyde test edilme noktasına ulaşmadan önce yaklaşık 1000 potansiyel ilaç test edilmektedir.[52] Örneğin, yeni bir kanser ilacı klinik çalışmalara girmeden önce ortalama altı yıllık bir araştırma sürecinden geçmektedir. Ancak yeni kanser ilaçlarının kullanıma sunulmasındaki en büyük engel, klinik çalışmaların tamamlanması için geçen süredir. Ortalama olarak, bir kanser ilacının klinik çalışmalara girmesinden halka satış için düzenleyici kurumlardan onay almasına kadar yaklaşık sekiz yıl geçmektedir.[53] Diğer hastalıklara yönelik ilaçlar da benzer zaman çizelgelerine sahiptir.
Bazı nedenlerden dolayı bir klinik çalışma birkaç yıl sürebilir:
- Kanser gibi kronik hastalıklarda, bir kanser tedavisinin hasta üzerinde bir etkisi olup olmadığını görmek yıllar olmasa da aylar alır.
- Güçlü bir etkiye sahip olması beklenmeyen ilaçlar için (yani 'herhangi' bir etkiyi gözlemlemek için çok sayıda hastanın kullanılması gerekir), ilacın etkinliğini test etmek için yeterli sayıda hastayı kullanmak (yani istatistiksel güç elde etmek) birkaç yıl sürebilir.
- Her klinik çalışmaya yalnızca hedef hastalık durumuna sahip belirli kişiler katılabilir. Bu belirli hastaları tedavi eden araştırmacılar denemeye katılmalıdır. Daha sonra arzu edilen hastaları belirlemeli ve onlardan veya ailelerinden çalışmaya katılmak için izin almalıdırlar.
Bir klinik çalışma, tedavinin uzun vadeli etkisini belirlemeyi amaçlayan ve "uzatma aşaması" olarak adlandırılan, çalışmaya katılan kişiler için aylar ila yıllar arasında değişen uzatılmış bir çalışma sonrası takip dönemi de içerebilir.[54]
Çalışmaların tamamlanmasının önündeki en büyük engel, katılacak insan sayısının azlığıdır. Bütün ilaç ve birçok cihaz denemeleri nüfusun bir alt kümesini hedefler, yani herkes katılamaz. Bazı ilaç denemeleri, hastaların alışılmadık hastalık özellikleri kombinasyonlarına sahip olmasını gerektirmektedir. Uygun hastaları bulmak ve onaylarını almak, özellikle de doğrudan bir fayda elde edemeyecekleri durumlarda (ödeme yapılmadığı, çalışma ilacının işe yaradığı henüz kanıtlanmadığı veya hastaya plasebo verilebileceği için) oldukça zordur. Kanser hastaları söz konusu olduğunda, kanserli yetişkinlerin %5'inden daha azı ilaç denemelerine katılacaktır. Amerika İlaç Araştırma ve Üreticileri Birliği'ne (PhRMA) göre, 2005 yılında yaklaşık 400 kanser ilacı klinik deneylerde test edilmekteydi. Bunların hepsi faydalı olmayacaktır, ancak faydalı olanların da onaylanması gecikebilir çünkü katılımcı sayısı çok düşüktür.[55]
Mevsimsel etkilerin (hava kaynaklı alerjiler, mevsimsel duygusal bozukluk, grip ve cilt hastalıkları gibi) potansiyelini içeren klinik çalışmalar için, çalışma, ilacın test edilebileceği yılın sınırlı bir bölümünde (polen alerjileri için ilkbahar gibi) yapılabilir.[56][57]
Yeni bir ilaç içermeyen klinik çalışmalar genellikle çok daha kısa sürelidir. (Hemşirelerin Sağlık Çalışması gibi epidemiyolojik çalışmalar istisnadır).
Yönetim
[değiştir | kaynağı değiştir]Yerel bir araştırmacı tarafından tasarlanan klinik çalışmalar ve (ABD'de) federal olarak finanse edilen klinik çalışmalar, neredeyse her zaman çalışmayı tasarlayan ve hibe için başvuran araştırmacı tarafından yönetilir. Küçük ölçekli cihaz çalışmaları sponsor şirket tarafından yönetilebilir. Yeni ilaçların klinik araştırmaları genellikle sponsor şirket tarafından kiralanan bir sözleşmeli araştırma kuruluşu (SAK) tarafından yönetilir. Sponsor, ilaç ve tıbbi gözetimi sağlar. Bir klinik araştırmanın tüm idari işlerini yürütmek üzere bir SAK ile sözleşme yapılır.
Faz II-IV için SAK, katılımcı araştırmacıları işe alır, onları eğitir, onlara malzeme sağlar, çalışma yönetimini ve veri toplamayı koordine eder, toplantılar düzenler, sahaları klinik protokole uygunluk açısından izler ve destekleyicinin her sahadan veri almasını sağlar. Hızlı IRB/IEC onayı ve daha hızlı saha başlatma ve hasta alımı sağlamak için SAK ile koordinasyon sağlamak üzere uzman saha yönetimi kuruluşları da işe alınabilir. Yeni ilaçların Faz I klinik araştırmaları genellikle, deneklerin tam zamanlı personel tarafından gözlemlenebildiği, özel farmakologların bulunduğu uzman bir klinik araştırma kliniğinde yürütülür. Bu klinikler genellikle bu çalışmalarda uzmanlaşmış bir SAK tarafından yönetilir.
Katılımcı bir sahada, bir veya daha fazla araştırma asistanı (genellikle hemşireler) klinik araştırmanın yürütülmesinde işin çoğunu yapar. Araştırma asistanının görevi aşağıdakilerden bazılarını veya tümünü içerebilir:
- yerel kurumsal inceleme kuruluna (IRB) çalışmanın yürütülmesi için izin almak üzere gerekli belgeleri sağlamak
- çalışmanın başlatılmasına yardımcı olmak
- uygun hastaları belirlemek, onlardan veya ailelerinden onay almak
- çalışma tedavilerini uygulamak
- verileri toplamak ve istatistiksel olarak analiz etmek
- takip sırasında veri dosyalarını korumak ve güncellemek
- IRB'nin yanı sıra destekleyici ve SAK ile iletişim kurmak.
Kalite
[değiştir | kaynağı değiştir]Bir klinik çalışma bağlamında kalite, tipik olarak, hem araştırmanın yürütülmesi sırasında hem de araştırma sonuçlarının kullanımında karar vermeyi etkileyebilecek hataların olmamasını ifade eder.[58]
Pazarlama
[değiştir | kaynağı değiştir]Etkileşimsel Adalet Modeli, klinik araştırma kaydı konusunda doktorla konuşmaya istekli olmanın etkilerini test etmek için kullanılabilir.[59] Sonuçlar, hastanın doktoruyla konuşmaya daha istekli olması durumunda potansiyel klinik araştırma adaylarının klinik araştırmalara kaydolma olasılığının daha düşük olduğunu ortaya koymuştur. Bu bulgunun arkasındaki neden, hastaların mevcut bakımlarından memnun olmaları olabilir. Algılanan adalet ile klinik araştırmaya kayıt arasındaki negatif ilişkinin bir diğer nedeni de bakım sağlayıcıdan bağımsızlığın olmamasıdır. Sonuçlar, doktorlarıyla konuşmaya istekli olmama ile klinik araştırmaya kaydolma arasında pozitif bir ilişki olduğunu ortaya koymuştur. Mevcut bakım sağlayıcılarıyla klinik araştırmalar hakkında konuşmaya istekli olmama, hastaların doktordan bağımsız olmasından kaynaklanıyor olabilir. Klinik araştırmalar hakkında konuşma olasılığı daha düşük olan hastalar, alternatif tedaviler hakkında daha iyi bir fikir edinmek için diğer bilgi kaynaklarını kullanmaya daha isteklidir. Klinik araştırma kayıtları, halkı klinik araştırma kayıtları hakkında bilgilendirmek için web sitelerini ve televizyon reklamlarını kullanmak üzere motive edilmelidir.
Bilgi teknolojisi
[değiştir | kaynağı değiştir]Son on yılda klinik çalışmaların planlanması ve yürütülmesinde bilgi teknolojisi kullanımının yaygınlaştığı görülmektedir. Klinik çalışma yönetim sistemleri genellikle araştırma sponsorları veya SAK'lar tarafından, özellikle araştırma sahalarıyla ilgili olarak, bir klinik araştırmanın operasyonel yönlerinin planlanmasına ve yönetilmesine yardımcı olmak için kullanılır. Belirli bir alanda uzmanlığa sahip araştırmacıları ve araştırma sahalarını belirlemeye yönelik gelişmiş analitik, devam eden araştırmalarla ilgili kamusal ve özel bilgileri kullanır.[60]
Web tabanlı elektronik veri yakalama (EVY) ve klinik veri yönetim sistemleri, klinik araştırmaların çoğunda sahalardan vaka raporu verilerini toplamak, kalitesini yönetmek ve analize hazırlamak için kullanılmaktadır.[61] İnteraktif sesli yanıt sistemleri, hastaların kayıtlarını telefon kullanarak kaydetmek ve hastaları belirli bir tedavi koluna tahsis etmek için siteler tarafından kullanılmaktadır (telefonlar giderek artan bir şekilde bazen EVY sisteminin bir parçası olan web tabanlı (IWRS) araçlarla değiştirilmektedir).
Geçmişte hasta tarafından bildirilen sonuçlar genellikle kağıt tabanlı iken, ölçümler giderek artan bir şekilde web portalları veya elde taşınan ePRO (veya eDiary) cihazları kullanılarak, bazen de kablosuz olarak toplanmaktadır.[62] Toplanan verileri analiz etmek ve ruhsat başvurusuna hazırlamak için istatistiksel yazılımlar kullanılmaktadır. Bu uygulamaların çoğuna erişim, web tabanlı klinik çalışma portallarında giderek daha fazla toplanmaktadır. 2011 yılında FDA, uzaktan hasta izleme olarak da bilinen telemonitoring yöntemini kullanarak hastaların evlerinde biyometrik veriler toplayan ve bunları elektronik olarak deneme veri tabanına aktaran bir Faz I denemesini onaylamıştır. Bu teknoloji çok daha fazla veri noktası sağlar ve hastalar için çok daha uygundur, çünkü deneme alanlarına daha az ziyarette bulunurlar.
Analiz
[değiştir | kaynağı değiştir]Bir klinik çalışma, iki veya daha fazla müdahale arasındaki nicel farklılıkları ortaya çıkarabilecek veriler üretir; bu farklılıkların doğru olup olmadığını, şanstan kaynaklanıp kaynaklanmadığını veya tedavisizlikle (plasebo) aynı olup olmadığını belirlemek için istatistiksel analizler kullanılır.[63][64] Bir klinik çalışmadan elde edilen veriler, araştırma süresi boyunca aylardan yıllara kadar uzanan bir zaman diliminde kademeli olarak birikir.[49] Buna göre, çalışmanın erken dönemlerinde işe alınan katılımcılara ait sonuçlar, denekler hala çalışmada tedavi gruplarına atanırken analiz için hazır hale gelir. Erken analiz, ortaya çıkan kanıtların çalışmanın durdurulup durdurulmayacağı veya katılımcıların çalışmanın daha başarılı bölümüne yeniden atanıp atanmayacağı konusundaki kararlara yardımcı olmasını sağlayabilir.[63] Araştırmacılar ayrıca veri analizi tedavi etkisi olmadığını gösterdiğinde bir çalışmayı durdurmak isteyebilirler.[64]
Etik konular
[değiştir | kaynağı değiştir]Klinik çalışmalar uygun düzenleyici makamlar tarafından yakından denetlenir. Hastalar üzerinde tıbbi veya terapötik bir müdahale içeren tüm çalışmalar, araştırmanın yürütülmesine izin verilmeden önce denetleyici bir etik kurul tarafından onaylanmalıdır. Yerel etik kurul, girişimsel olmayan çalışmaları (gözlemsel çalışmalar veya önceden toplanmış verileri kullananlar) nasıl denetleyeceği konusunda takdir yetkisine sahiptir. ABD'de bu organ kurumsal inceleme kurulu (KİK) olarak adlandırılır; AB'de ise etik kurullar olarak adlandırılır. Çoğu KİK yerel araştırmacının hastanesinde veya kurumunda bulunur, ancak bazı sponsorlar daha küçük kurumlarda çalışan araştırmacılar için merkezi (bağımsız/kar amaçlı) bir KİK'in kullanılmasına izin verir.
Etik olması için, araştırmacılar katılımcı insan deneklerin tam ve aydınlatılmış onamını almalıdır. (KİK'in ana işlevlerinden biri potansiyel hastaların klinik çalışma hakkında yeterince bilgilendirilmesini sağlamaktır). Hastanın kendisi rıza gösteremeyecek durumdaysa araştırmacılar hastanın yasal olarak yetkilendirilmiş temsilcisinden rıza isteyebilir. Buna ek olarak, klinik çalışma katılımcıları, kendilerine karşı herhangi bir olumsuz işlem yapılmaksızın istedikleri zaman klinik çalışmadan çekilebilecekleri konusunda bilgilendirilmelidir.[65] Kaliforniya'da eyalet, yasal olarak yetkilendirilmiş temsilci olarak hizmet verebilecek kişilere öncelik tanımıştır.[66]
ABD'nin bazı bölgelerinde, yerel KİK'in araştırmacıları ve çalışanlarını klinik araştırma yapmadan önce sertifikalandırması gerekmektedir. Federal hasta gizliliği (HIPAA) yasasını ve iyi klinik uygulamaları anlamaları gerekir. Uluslararası Uyum Konferansı İyi Klinik Uygulama Kılavuzları, klinik çalışmaların yürütülmesi için uluslararası düzeyde kullanılan bir dizi standarttır. Kılavuz ilkeler "deneklerin haklarının, güvenliğinin ve refahının korunmasını" sağlamayı amaçlamaktadır.
Katılımcı insan deneklerin aydınlatılmış onamı kavramı birçok ülkede mevcuttur, ancak kesin tanımı hala değişebilmektedir.
Aydınlatılmış onam açıkça etik davranış için 'gerekli' bir koşuldur ancak etik davranışı 'garanti' etmez. Merhametli kullanım denemelerinde bu durum özellikle zor bir sorun haline gelir. Nihai amaç, hasta topluluğuna veya gelecekteki hastalara mümkün olan en iyi ve en sorumlu şekilde hizmet etmektir. Ancak, bu hedefi iyi tanımlanmış, nicelleştirilmiş bir amaç fonksiyonuna dönüştürmek zor olabilir. Ancak bazı durumlarda, örneğin ardışık tedavilerin ne zaman durdurulacağına ilişkin sorularda (bkz. Oran algoritması) bu yapılabilir ve bu durumda sayısallaştırılmış yöntemler önemli bir rol oynayabilir.
Çocuklar (pediatri) üzerinde klinik çalışmalar yürütülürken ve acil veya salgın durumlarda ek etik kaygılar mevcuttur.[67][68]
Birden fazla paydaşın haklarını etik olarak dengelemek zor olabilir. Örneğin, ilaç denemeleri başarısız olduğunda, sponsorların mevcut ve potansiyel yatırımcılara derhal bilgi verme yükümlülüğü olabilir; bu da hem araştırma personelinin hem de kayıtlı katılımcıların bir denemenin sona erdiğini ilk olarak kamuya açık iş haberleri yoluyla duyabileceği anlamına gelir.[69]
Çıkar çatışmaları ve olumsuz çalışmalar
[değiştir | kaynağı değiştir]İlaç şirketi destekli araştırmalardan elde edilen olumsuz verilerin yayınlanmadığı belirli vakalara yanıt olarak, Amerika İlaç Araştırmaları ve Üreticileri, şirketleri tüm bulguları rapor etmeye ve araştırmacıların ilaç şirketlerine mali katılımını sınırlamaya çağıran yeni kılavuzlar yayınladı.[70] ABD Kongresi, Faz II ve Faz III klinik araştırmaların sponsor tarafından Ulusal Sağlık Enstitüleri tarafından derlenen ClinicalTrials.gov web sitesine kaydedilmesini gerektiren bir yasa tasarısını imzaladı.[71]
Doğrudan ilaç şirketleri tarafından istihdam edilmeyen ilaç araştırmacıları genellikle üreticilerden hibe almaya çalışırlar ve üreticiler genellikle üniversite ağları ve hastaneleri içinde çalışmalar yürütmek için akademik araştırmacılara başvururlar, örneğin translasyonel kanser araştırmaları için. Benzer şekilde, kadrolu akademik pozisyonlar, devlet hibeleri ve prestij için rekabet, akademik bilim insanları arasında çıkar çatışmaları yaratmaktadır.[72] Bir çalışmaya göre, suistimalle ilgili nedenlerle geri çekilen makalelerin yaklaşık %75'inin endüstriden mali destek aldığı beyan edilmemiştir.[73] Tohumlama denemeleri özellikle tartışmalıdır.[74]
Amerika Birleşik Devletleri'nde, ilaç onay sürecinin bir parçası olarak FDA'ya sunulan tüm klinik araştırmalar, seçilen klinik araştırma sahalarında birincil veri toplama denetimleri de dahil olmak üzere,[75] Gıda ve İlaç İdaresi bünyesindeki klinik uzmanlar tarafından bağımsız olarak değerlendirilir.[76]
2001 yılında, 12 büyük derginin editörleri, sponsorların klinik çalışmalar üzerinde uyguladıkları kontrol hakkında, özellikle de sponsorların çalışmaları yayınlamadan önce gözden geçirmelerine ve yayınlamamalarına olanak tanıyan sözleşmelerin kullanımını hedef alan, her dergide yayınlanan ortak bir başyazı yayınladılar. Bu etkiye karşı koymak için editoryal kısıtlamaları güçlendirdiler. Başyazıda, sözleşmeli araştırma kuruluşlarının 2000 yılı itibarıyla ABD'deki ilaç şirketlerinden gelen hibelerin %60'ını aldığı belirtilmiştir. Araştırmacıların çalışma tasarımına katkıda bulunmaları, ham verilere erişmeleri ve sonuçları yorumlamaları kısıtlanabilir.[77]
Paydaşlar tarafından endüstri destekli tıbbi araştırmaların standartlarının iyileştirilmesine yönelik tedbirlerin açıkça tavsiye edilmesine rağmen,[78] 2013 yılında Tohen, endüstri destekli klinik çalışmalardan elde edilen sonuçların güvenilirliği konusunda bir boşluğun devam ettiği konusunda uyarıda bulunmuş ve halkın güveninin daha fazla aşınmasını önlemek için akademi ile endüstriyel işbirliklerinde etik standartlara sıkı sıkıya bağlı kalınması çağrısında bulunmuştur.[79] Bu bağlamda dikkat çekilen konular arasında potansiyel gözlem yanlılığı, idame çalışmaları için gözlem süresinin uzunluğu, hasta popülasyonlarının seçimi, plasebo yanıtını etkileyen faktörler ve finansman kaynakları yer almaktadır.[80][81][82]
Halk sağlığı krizi sırasında
[değiştir | kaynağı değiştir]Salgın hastalıklar ve pandemiler sırasında aşıların klinik denemelerinin yapılması etik kaygılara tabidir. Ebola gibi yüksek ölüm oranlarına sahip hastalıklarda, bireylerin plasebo veya kontrol grubuna atanması bir ölüm cezası olarak görülebilir. Ulusal Tıp Akademisi, salgın hastalıklar sırasında klinik araştırmalarla ilgili etik kaygılara yanıt olarak, yedi etik ve bilimsel hususu tanımlayan bir rapor hazırlamıştır. Bu hususlar şunlardır:[83]
- Bilimsel değer
- Sosyal değer
- Kişilere saygı
- Toplumsal katılım
- Katılımcı refahı ve çıkarları için endişe
- Riskler karşısında faydaya yönelik bir denge
- Deneme sırasında saklı tutulan test edilmiş tedavilere deneme sonrası erişim
Hamile kadınlar ve çocuklar
[değiştir | kaynağı değiştir]Hamile kadınlar ve çocuklar genellikle hassas popülasyonlar olarak klinik çalışmaların dışında tutulmaktadır, ancak bu popülasyonların dışlanmasını destekleyen veriler sağlam değildir. Klinik çalışmaların dışında bırakılmaları nedeniyle, bu popülasyonlara yönelik tedavilerin güvenliği ve etkinliği hakkında bilgi genellikle eksiktir. HIV/AIDS salgınının ilk zamanlarında bir bilim adamı, bu grupların potansiyel olarak hayat kurtarıcı tedavilerin dışında bırakılmasıyla "ölümüne korunduklarını" belirtmiştir. Aşılar, Salgın Hastalıklar ve Yeni Teknolojiler için Araştırma Etiği (PREVENT) gibi projeler, hamile kadınların aşı denemelerine etik olarak dahil edilmesini savunmuştur. Çocukların karar verme özerkliğinden yoksun olmaları nedeniyle, çocukların klinik çalışmalara dahil edilmesi ek ahlaki hususlar içermektedir. Geçmişteki denemeler, hastanede yatan çocukları veya yetimleri kullandıkları için eleştirilmiş; bu etik kaygılar gelecekteki araştırmaları etkili bir şekilde durdurmuştur. Etkili pediatrik bakımı sürdürme çabaları kapsamında, birçok Avrupa ülkesi ve ABD, ilaç şirketlerini pediatrik çalışmalar yapmaya ikna etmeye veya zorlamaya yönelik politikalara sahiptir. Uluslararası kılavuzlar, zararı sınırlandırarak, çeşitli riskleri göz önünde bulundurarak ve pediatrik bakımın karmaşıklığını dikkate alarak etik pediatrik çalışmalar yapılmasını önermektedir.[83]
Güvenlik
[değiştir | kaynağı değiştir]Bir klinik çalışmadaki gönüllülerin güvenliğine ilişkin sorumluluk destekleyici, yerel saha araştırmacıları (destekleyiciden farklıysa), çalışmayı denetleyen çeşitli KİK'ler ve (bazı durumlarda, çalışma pazarlanabilir bir ilaç veya cihaz içeriyorsa) ilacın veya cihazın satılacağı ülkenin düzenleyici kurumu arasında paylaşılır.
Araştırma katılımcılarının güvenliğini sağlamak için sıklıkla sistematik bir eş zamanlı güvenlik incelemesi kullanılır. Yürütülen ve devam eden inceleme, araştırmanın riskiyle orantılı olacak şekilde tasarlanmıştır. Tipik olarak bu rol bir Veri ve Güvenlik Komitesi, dışarıdan atanan bir Tıbbi Güvenlik Gözlemcisi,[83] Bağımsız Güvenlik Görevlisi veya küçük ya da düşük riskli çalışmalar için baş araştırmacı tarafından yerine getirilir.[84]
Güvenlik nedenleriyle, birçok klinik ilaç araştırması, doğurganlık çağındaki kadınları, hamile kadınları veya çalışma sırasında hamile kalan kadınları hariç tutacak şekilde tasarlanmıştır.[85] Bazı durumlarda, bu kadınların erkek partnerleri de çalışma dışında bırakılır veya doğum kontrol önlemleri almaları istenir.
Sponsor
[değiştir | kaynağı değiştir]Klinik çalışma boyunca sponsor, yerel saha araştırmacılarını test edilecek ilaç, cihaz veya diğer tıbbi tedavilerin gerçek geçmiş güvenlik kayıtları ve çalışma tedavisinin/tedavilerinin halihazırda onaylanmış tedavilerle olası etkileşimleri hakkında doğru bir şekilde bilgilendirmekten sorumludur. Bu, yerel araştırmacıların çalışmaya katılıp katılmama konusunda bilinçli bir karar vermelerini sağlar. Sponsor aynı zamanda çalışma ilerledikçe çeşitli sahalardan gelen çalışma sonuçlarını izlemekten de sorumludur. Daha büyük klinik çalışmalarda sponsor bir veri izleme kurulunun (VİK, ABD'de veri güvenliği izleme kurulu olarak bilinir) hizmetlerini kullanacaktır. Klinisyenler ve istatistikçilerden oluşan bu bağımsız grup, sponsorun o ana kadar elde ettiği körlenmemiş verileri gözden geçirmek için periyodik olarak toplanır. VİK, incelemelerine dayanarak, örneğin çalışma tedavisinin standart tedaviden daha fazla ölüme neden olması veya beklenmedik ve çalışmayla ilgili ciddi advers olaylara neden olması durumunda çalışmanın sonlandırılmasını tavsiye etme yetkisine sahiptir. Sponsor, çalışmadaki tüm saha araştırmacılarından advers olay raporlarını toplamaktan ve bu advers olayların çalışma tedavisiyle ilgili olup olmadığına dair destekleyicinin kararını tüm araştırmacılara bildirmekten sorumludur.
Sponsor ve yerel saha araştırmacıları, potansiyel gönüllüleri çalışmaya katılmanın gerçek riskleri ve potansiyel faydaları hakkında doğru bir şekilde bilgilendiren ve aynı zamanda materyali mümkün olduğunca kısa ve sıradan bir dille sunan, sahaya özgü bir aydınlatılmış onam yazmaktan birlikte sorumludur. FDA yönetmelikleri klinik araştırmalara katılmanın gönüllülük esasına dayandığını ve gönüllülerin istedikleri zaman katılmama veya katılımı sonlandırma hakkına sahip olduğunu belirtmektedir.[86]
Yerel saha araştırmacıları
[değiştir | kaynağı değiştir]Primum non nocere ("önce zarar verme") etik ilkesi araştırmaya rehberlik eder ve bir araştırmacı çalışma tedavisinin çalışmadaki deneklere zarar verebileceğine inanırsa araştırmacı istediği zaman katılımı durdurabilir. Öte yandan, araştırmacıların genellikle denekleri çalışmaya dahil etmekte mali çıkarları vardır ve katılımlarını sağlamak ve sürdürmek için etik dışı davranabilirler.
Yerel araştırmacılar, çalışmanın çalışma protokolüne uygun olarak yürütülmesinden ve çalışma süresince çalışma personelinin denetlenmesinden sorumludur. Yerel araştırmacı veya onun çalışma personeli aynı zamanda çalışmadaki potansiyel deneklerin çalışmaya katılmanın risklerini ve potansiyel faydalarını anlamalarını sağlamaktan da sorumludur. Başka bir deyişle, denekler (veya yasal olarak yetkili temsilcileri) gerçekten aydınlatılmış onam vermelidir.
Yerel araştırmacılar, destekleyici tarafından gönderilen tüm advers olay raporlarını gözden geçirmekle sorumludur. Bu advers olay raporları, advers olayın çalışma tedavileriyle ilişkisine dair hem araştırmacının (advers olayın meydana geldiği yerdeki) hem de destekleyicinin görüşlerini içerir. Yerel araştırmacılar ayrıca bu raporlar hakkında bağımsız bir değerlendirme yapmaktan ve yerel KİK'i tüm ciddi ve çalışma tedavisiyle ilgili advers olaylar hakkında derhal bilgilendirmekten sorumludur.
Destekleyici yerel bir araştırmacı olduğunda, resmi advers olay raporları olmayabilir, ancak tüm lokasyonlardaki çalışma personeli beklenmedik herhangi bir durum hakkında koordinatör araştırmacıyı bilgilendirmekle sorumludur. Yerel araştırmacı, çalışmayla ilgili tüm iletişimlerde yerel KİK'e karşı dürüst olmaktan sorumludur.
Kurumsal inceleme kurulları (KİK'ler)
[değiştir | kaynağı değiştir]En gayriresmi araştırmalar hariç tüm araştırmaların başlayabilmesi için bir kurumsal inceleme kurulu (KİK) veya bağımsız etik komitesi (BEK) onayı gereklidir. Ticari klinik araştırmalarda, destekleyici araştırmayı yürütmek üzere sahaları işe almadan önce çalışma protokolü bir KİK tarafından onaylanmaz. Ancak, çalışma protokolü ve prosedürleri genel KİK başvuru gerekliliklerine uyacak şekilde uyarlanmıştır. Bu durumda ve bağımsız bir sponsorun olmadığı durumlarda, her yerel saha araştırmacısı çalışma protokolünü, onam(lar)ı, veri toplama formlarını ve destekleyici belgeleri yerel KİK'e sunar. Üniversiteler ve çoğu hastanenin kurum içi KİK'leri vardır. Diğer araştırmacılar (muayenehaneler gibi) bağımsız KİK'ler kullanmaktadır.
KİK, araştırmacının çalışmaya başlamasına izin vermeden önce çalışmayı hem tıbbi güvenlik hem de çalışmaya dahil olan hastaların korunması açısından inceler. Çalışma prosedürlerinde veya hastaya verilen açıklamalarda değişiklik yapılmasını isteyebilir. Araştırmacıdan her yıl istenen "sürekli inceleme" raporu, çalışmanın ilerleyişi ve çalışmayla ilgili yeni güvenlik bilgileri hakkında KİK'i günceller.
Düzenleyici kurumlar
[değiştir | kaynağı değiştir]ABD'de FDA, yerel saha araştırmacılarının dosyalarını, bir çalışmaya katılmayı bitirdikten sonra, çalışma prosedürlerini doğru bir şekilde takip edip etmediklerini görmek için denetleyebilir. Bu denetim rastgele olabileceği gibi (araştırmacının verilerde sahtecilik yaptığından şüphelenildiği için) nedene bağlı olarak da yapılabilir. Bir denetimden kaçınmak, araştırmacıların çalışma prosedürlerini takip etmeleri için bir teşviktir.
'Kapsanan klinik çalışma', FDA'ya bir pazarlama başvurusunun parçası olarak (örneğin, bir NDA veya 510(k)'nin parçası olarak) sunulan ve FDA'nın klinik araştırmacının çalışmanın sonucuyla ilgili mali çıkarlarının açıklanmasını isteyebileceği bir çalışmayı ifade eder. Örneğin, başvuru sahibi, araştırmacının destekleyicide hisse sahibi olup olmadığını veya araştırılan üründe mülkiyet hakkı olup olmadığını açıklamalıdır. FDA kapsam dahilindeki bir çalışmayı "... bir pazarlama başvurusunda veya yeniden sınıflandırma dilekçesinde sunulan ve başvuru sahibinin veya FDA'nın ürünün etkili olduğunu belirlemek için dayandığı (etkili bir ürünle eşdeğerliği gösteren çalışmalar dahil) insanlarda yapılan herhangi bir ilaç, biyolojik ürün veya cihaz çalışması veya tek bir araştırmacının güvenliliğin gösterilmesine önemli bir katkıda bulunduğu herhangi bir çalışma" olarak tanımlamaktadır.[87]
Alternatif olarak, birçok Amerikan ilaç şirketi bazı klinik çalışmaları yurtdışına taşımıştır. Denemeleri yurtdışında yürütmenin avantajları arasında daha düşük maliyetler (bazı ülkelerde) ve daha kısa zaman dilimlerinde daha büyük denemeler yürütme becerisi yer alırken, daha düşük kaliteli deneme yönetimi potansiyel bir dezavantajdır.[88] Farklı ülkelerin farklı düzenleyici gereklilikleri ve uygulama kabiliyetleri vardır. Tüm klinik çalışmaların tahmini %40'ı artık Asya, Doğu Avrupa ve Orta ve Güney Amerika'da gerçekleşmektedir. Gelişmekte olan ülkelerdeki klinik araştırmaları takip eden Hollanda merkezli sağlık örgütü WEMOS'tan Jacob Sijtsma, "Bu ülkelerde klinik çalışmalar için zorunlu bir kayıt sistemi yoktur ve birçoğu faaliyetlerinde Avrupa direktiflerini takip etmemektedir" diyor.[89]
1980'lerden itibaren, klinik çalışma protokollerinin uyumlaştırılmasının Avrupa Birliği ülkeleri arasında uygulanabilir olduğu gösterilmiştir. Aynı zamanda, Avrupa, Japonya ve Amerika Birleşik Devletleri arasındaki koordinasyon, 1990'dan sonra Beşeri İlaçlar için Teknik Gerekliliklerin Uyumlaştırılması Uluslararası Konseyi (ICH) olarak adlandırılan uluslararası uyumlaştırma konusunda ortak bir düzenleyici-endüstri girişimine yol açmıştır.[90] Günümüzde, çoğu klinik çalışma programı, "kaliteli, güvenli ve etkili ilaçların en verimli ve uygun maliyetli şekilde geliştirilmesini ve ruhsatlandırılmasını sağlamayı" amaçlayan ICH kılavuzlarını takip etmektedir. Bu faaliyetler, tüketici ve halk sağlığı yararına, insanlarda yapılan klinik çalışmaların gereksiz yere tekrarlanmasını önlemek ve güvenlik ve etkililikle ilgili ruhsatlandırma yükümlülüklerinden ödün vermeden hayvan deneylerinin kullanımını en aza indirmek için sürdürülmektedir."[91]
Klinik geliştirme sırasında güvenlik verilerinin toplanması
[değiştir | kaynağı değiştir]İlaç geliştirme sürecinde klinik denemeler arasında güvenlilik verilerinin toplanması önemlidir çünkü denemeler genellikle ilacın ne kadar iyi çalıştığını belirlemeye odaklanmak üzere tasarlanmıştır. İlaç geliştirilirken birden fazla deneme boyunca toplanan ve bir araya getirilen güvenlilik verileri, destekleyicinin, araştırmacıların ve düzenleyici kurumların deneysel ilaçların geliştirilirken toplam güvenlilik profilini izlemelerine olanak tanır. Toplu güvenlilik verilerini değerlendirmenin değeri: a) ilacın geliştirilmesi sırasında toplu güvenlilik değerlendirmesine dayalı kararlar ilacın geliştirilmesi boyunca alınabilir ve b) ilaç onaylandıktan sonra ilacın güvenliliğini değerlendirmek için destekleyici ve düzenleyicileri iyi bir şekilde hazırlar.[92][93][93][94][95]
Ekonomi
[değiştir | kaynağı değiştir]Klinik araştırma maliyetleri araştırma aşamasına, araştırma türüne ve üzerinde çalışılan hastalığa bağlı olarak değişmektedir. Amerika Birleşik Devletleri'nde 2004-2012 yılları arasında yürütülen klinik çalışmalarla ilgili bir çalışma, Faz I araştırmalarının ortalama maliyetinin hastalığın türüne bağlı olarak 1,4 milyon ila 6,6 milyon dolar arasında olduğunu ortaya koymuştur. Faz II denemeleri 7 milyon dolar ile 20 milyon dolar arasında, Faz III denemeleri ise 11 milyon dolar ile 53 milyon dolar arasında değişmektedir.[96]
Sponsor
[değiştir | kaynağı değiştir]Bir çalışmanın maliyeti, özellikle çalışmayı yürüten tesislerin sayısı, çalışmaya dahil olan hasta sayısı ve çalışma tedavisinin tıbbi kullanım için zaten onaylanmış olup olmadığı gibi birçok faktöre bağlıdır.
Bir ilaç şirketinin Faz III veya IV klinik araştırmasını yürütürken yaptığı masraflar, diğerlerinin yanı sıra şunları içerebilir:
- değerlendirilmekte olan ilaç(lar)ın veya cihaz(lar)ın üretimi
- çalışmanın tasarımcıları ve yöneticileri için personel maaşları
- sözleşmeli araştırma kuruluşuna, saha yönetim kuruluşuna (kullanılıyorsa) ve herhangi bir dış danışmana yapılan ödemeler
- yerel araştırmacılara ve çalışanlarına, denekleri işe alma ve sponsor için veri toplama konusunda harcadıkları zaman ve emek için yapılan ödemeler
- çalışma materyallerinin maliyeti ve bunların gönderilmesi için yapılan masraflar
- SAK tarafından çalışma öncesinde ve (bazı durumlarda) çalışma sırasında birçok kez yerinde izleme de dahil olmak üzere yerel araştırmacılarla iletişim
- bir veya daha fazla araştırmacı eğitim toplantısı
- eczane ücretleri, KİK ücretleri ve posta ücreti gibi yerel araştırmacılar tarafından yapılan masraflar
- çalışmaya kaydolan deneklere yapılan herhangi bir ödeme
- çalışma ilacının neden olduğu tıbbi bir durum geliştiren bir deneğin tedavi masrafları
Bu harcamalar birkaç yıl boyunca yapılmaktadır.
ABD'de sponsorlar, nadir hastalıkların tedavisi için geliştirilen ilaçlar üzerinde yürütülen klinik çalışmalar için yüzde 50 vergi indirimi alabilmektedir.[97] ABD Ulusal Sağlık Enstitüleri gibi ulusal sağlık kurumları, kurumun ilgi alanına giren araştırma sorularını yanıtlamaya çalışan klinik deneyler tasarlayan araştırmacılara hibeler sunmaktadır. Bu durumlarda, hibeyi yazan ve çalışmayı yöneten araştırmacı sponsor olarak hareket eder ve diğer sahalardan veri toplanmasını koordine eder. Bu diğer sitelere, hibe miktarına ve kendilerinden beklenen çabanın miktarına bağlı olarak çalışmaya katıldıkları için ödeme yapılabilir ya da yapılmayabilir. İnternet kaynaklarının kullanılması bazı durumlarda ekonomik yükü azaltabilir.[98]
Araştırmacılar
[değiştir | kaynağı değiştir]Araştırmacılara klinik çalışmalardaki çalışmaları için genellikle ödeme yapılır. Bu miktarlar küçük olabilir, sadece araştırma asistanlarının kısmi maaşını ve herhangi bir malzemenin maliyetini karşılayabilir (genellikle ulusal sağlık ajansı çalışmalarında durum böyledir) veya önemli olabilir ve araştırmacının klinik çalışmalar arasındaki zamanlarda araştırma personeline ödeme yapmasına olanak tanıyan "genel giderleri" içerebilir.[kaynak belirtilmeli]
Konular
[değiştir | kaynağı değiştir]Faz I ilaç denemelerine katılanlar, yer almaktan doğrudan bir sağlık yararı elde etmezler. Kendilerine genellikle ayırdıkları zaman için bir ücret ödenir, ödemeler düzenlenir ve herhangi bir riskle ilişkilendirilmez. Sağlıklı gönüllülerin motivasyonları maddi ödülle sınırlı değildir ve bilime katkıda bulunmak gibi diğer motivasyonları da içerebilir.[99] Daha sonraki aşamalardaki çalışmalarda, sağlık açısından fayda sağlama veya tıbbi bilgiye katkıda bulunma potansiyeli olan çalışmalara katılma motivasyonlarını sağlamak için deneklere ödeme yapılmayabilir. Seyahat gibi çalışmayla ilgili masraflar için veya deneme tedavisi sona erdikten sonra sağlıkları hakkında takip bilgileri sağlamada harcadıkları zamanın karşılığı olarak küçük ödemeler yapılabilir.
Katılımcı alımı ve katılım
[değiştir | kaynağı değiştir]Faz 0 ve Faz I ilaç denemelerinde sağlıklı gönüllüler aranır. Diğer klinik araştırmaların çoğunda belirli bir hastalığı veya tıbbi durumu olan hastalar aranmaktadır. Toplumda gözlemlenen çeşitlilik, etnik azınlık popülasyonlarının uygun şekilde dahil edilmesi yoluyla klinik araştırmalara yansıtılmalıdır.[100] Hasta alımı veya katılımcı alımı, klinik araştırmaları yürüten sitelerin faaliyetlerinde ve sorumluluklarında önemli bir rol oynar.[101]
Bir deneme için değerlendirilen tüm gönüllülerin tıbbi bir taramadan geçmesi gerekmektedir. Gereklilikler deneme ihtiyaçlarına göre değişir, ancak tipik olarak gönüllüler tıbbi bir laboratuvarda aşağıdakiler için taranır:[102]
- Kalbin elektriksel aktivitesinin ölçümü (EKG)
- Kan basıncı, kalp atış hızı ve vücut sıcaklığının ölçülmesi
- Kan örneği alma
- İdrar örneklemesi
- Ağırlık ve boy ölçümü
- Uyuşturucu bağımlılığı testi
- Hamilelik testi
Klinik çalışmalara katılanların orantısız bir şekilde beyaz olduğu gözlemlenmiştir.[103][104] Çoğu zaman, azınlıklar klinik çalışmalar hakkında bilgilendirilmemektedir.[105] Literatürün yakın zamanda yapılan sistematik bir incelemesinde, yetişkinlerde işitme kaybı yönetimiyle ilgili çok sayıda klinik çalışmada ırk/etnik köken ve cinsiyetin iyi temsil edilmediği ve hatta bazen katılımcı olarak izlenmediği bulunmuştur.[106] Bu durum, daha geniş popülasyonları yeterince temsil etmediği için beyaz olmayan hastalarla ilgili bulguların geçerliliğini azaltabilir.[107]
Çalışmaların konumlandırılması
[değiştir | kaynağı değiştir]Gerekli katılımcıların türüne bağlı olarak, klinik çalışmaların sponsorları veya onlar adına çalışan sözleşmeli araştırma kuruluşları, nitelikli personelin yanı sıra araştırmaya katılabilecek hastalara erişimi olan sahalar bulmaya çalışır. Bu sahalarla birlikte çalışarak, hasta veri tabanları, gazete ve radyo reklamları, el ilanları, hastaların gidebileceği yerlerdeki (doktor muayenehaneleri gibi) posterler ve araştırmacılar tarafından hastaların kişisel olarak işe alınması gibi çeşitli işe alım stratejileri kullanabilirler.
Belirli rahatsızlıkları veya hastalıkları olan gönüllüler, klinik çalışmaları bulmalarına yardımcı olacak ek çevrimiçi kaynaklara sahiptir. Örneğin Fox Trial Finder, dünyanın dört bir yanındaki Parkinson hastalığı çalışmalarını konum, yaş ve semptomlar gibi belirli bir dizi kritere sahip gönüllülere bağlamaktadır.[108] Gönüllülerin kendi durumlarıyla ilgili denemeleri bulmaları için hastalığa özgü başka hizmetler de mevcuttur.[109] Gönüllüler, ABD Ulusal Sağlık Enstitüleri ve Ulusal Tıp Kütüphanesi tarafından yürütülen bir kayıt defterini kullanarak denemeleri bulmak için doğrudan ClinicalTrials.gov'da arama yapabilirler. Ayrıca, klinisyenlerin genomik veriler gibi verilere dayanarak bireysel bir hasta için deneme seçenekleri bulmasına olanak tanıyan bir yazılım da bulunmaktadır.[110]
Araştırma
[değiştir | kaynağı değiştir]
Risk bilgisi arama ve işleme (RISP) modeli, klinik çalışmalara ilişkin tutumları ve karar alma süreçlerini etkileyen sosyal etkileri analiz etmektedir.[111] Bir klinik çalışmada sağlanan tedaviden daha fazla pay veya menfaat elde eden kişilerin klinik araştırmalar hakkında bilgi arama olasılığı daha yüksektir. Kanser hastaları, genel nüfusa kıyasla klinik araştırmalara yönelik daha iyimser tutumlar bildirmiştir. Klinik çalışmalara ilişkin daha iyimser bir bakış açısına sahip olmak, kayıt olma olasılığının da artmasına yol açmaktadır.[111]
Eşleştirme
[değiştir | kaynağı değiştir]Eşleştirme, bir hastanın klinik ve demografik bilgilerinin çeşitli araştırmaların uygunluk kriterleriyle sistematik olarak karşılaştırılmasını içerir. Yöntemler şunları içerir:
- Manuel: Sağlık hizmeti sağlayıcıları veya klinik çalışma koordinatörleri, potansiyel eşleşmeleri belirlemek için hasta kayıtlarını ve mevcut çalışma kriterlerini manuel olarak gözden geçirir.[112] Bu, klinik çalışma veritabanlarında manuel olarak arama yapmayı da içerebilir.[113]
- Elektronik sağlık kayıtları (ESK). Bazı sistemler, tıbbi verilerine dayanarak denemeler için uygun olabilecek hastaları otomatik olarak işaretlemek için ESK'lere entegre olur. Bu sistemler, hastaları denemelerle daha etkili bir şekilde eşleştirmek için makine öğrenimi, yapay zeka veya hassas tıp yöntemlerinden yararlanabilir.[114] Bu yöntemler, eksiklikler ve kayıt hataları gibi ESK kayıtlarının sınırlamalarının üstesinden gelme zorluğuyla karşı karşıyadır.
- Doğrudan hastaya yönelik hizmetler: Kaynaklar, çevrimiçi platformlar, yardım hatları ve kişiselleştirilmiş destek yoluyla hastaları klinik çalışmaları bulma konusunda desteklemek için uzmanlaşmıştır.[112][113][115]
Merkezi olmayan çalışmalar
[değiştir | kaynağı değiştir]Çalışmalar genellikle büyük tıp merkezlerinde yürütülse de bazı katılımcılar seyahat için gereken mesafe ve masraflar nedeniyle dışlanmakta, bu da özellikle kırsal ve yetersiz hizmet alan topluluklardaki katılımcılar için zorluk, dezavantaj ve eşitsizliğe yol açmaktadır. 21. yüzyılda, telesağlık ve giyilebilir teknolojilerin geliştirdiği bir özellik olarak, bir katılımcının evinde bilgi toplamak için çaba sarf edilmektedir.[116]
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b "NIH Clinical Research Trials and You: The Basics". US National Institutes of Health. 3 Ekim 2022. 22 Nisan 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Kasım 2022.
- ^ "Clinical Trials" (PDF). Bill and Melinda Gates Foundation. 12 Ocak 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 1 Ocak 2014.
- ^ Dimasi, Joseph A; Grabowski, Henry G; Hansen, Ronald W (2016). "Innovation in the pharmaceutical industry: New estimates of R&D costs". Journal of Health Economics. 47: 20-33. doi:10.1016/j.jhealeco.2016.01.012. hdl:10161/12742. PMID 26928437.
- ^ U.S. FOOD AND DRUG ADMINISTRATION, http://www.fda.org 1 Mart 2018 tarihinde Wayback Machine sitesinde arşivlendi. (last visited May 15, 2014)
- ^ Emanuel, Ezekiel J. (9 Eylül 2015). "The Solution to Drug Prices". The New York Times. 5 Aralık 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Şubat 2017.
Of the drugs started in clinical trials on humans, only 10 percent secure F.D.A. approval. ...
- ^ FDA Page last updated 25 April 2014 FDA's Drug Review Process: Continued 23 Nisan 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ PhRMA. February 2007 Drug Discovery and Development 10 Nisan 2023 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Merck Manual. Last full review/revision October 2013 by Daniel A. Hussar, PhD Overview of Over-the-Counter Drugs 4 Şubat 2015 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Avorn J. (2004). Powerful Medicines, pp. 129–33. Alfred A. Knopf.
- ^ Van Spall HG, Toren A, Kiss A, Fowler RA (March 2007). "Eligibility criteria of randomized controlled trials published in high-impact general medical journals: a systematic sampling review". JAMA. 297 (11): 1233-40. doi:10.1001/jama.297.11.1233. PMID 17374817.
- ^ a b c d e f g h i j "What are the different types of clinical research?". US Food and Drug Administration. 2019. 12 Haziran 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Mayıs 2019.
- ^ The regulatory authority in the US is the Food and Drug Administration; in Canada, Health Canada; in the European Union, the European Medicines Agency; and in Japan, the Ministry of Health, Labour and Welfare
- ^ "Medical Devices, Premarket Clinical Studies for Investigational Device Exemption". US Food and Drug Administration. 17 Mart 2017. 1 Kasım 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ekim 2017.
- ^ Lederle FA, Freischlag JA, Kyriakides TC, Padberg FT, Matsumura JS, Kohler TR, Lin PH, Jean-Claude JM, Cikrit DF, Swanson KM, Peduzzi PN (October 2009). "Outcomes following endovascular vs open repair of abdominal aortic aneurysm: a randomized trial". JAMA. 302 (14): 1535-42. doi:10.1001/jama.2009.1426. PMID 19826022.
- ^ Lipp A, Shaw C, Glavind K (December 2014). "Mechanical devices for urinary incontinence in women". The Cochrane Database of Systematic Reviews. 2014 (12): CD001756. doi:10.1002/14651858.CD001756.pub6. PMC 7061494 $2. PMID 25517397.
- ^ Farrokhyar F, Karanicolas PJ, Thoma A, Simunovic M, Bhandari M, Devereaux PJ, Anvari M, Adili A, Guyatt G (March 2010). "Randomized controlled trials of surgical interventions". Annals of Surgery. 251 (3): 409-16. doi:10.1097/SLA.0b013e3181cf863d. PMID 20142732.
- ^ Metwally, Mostafa; Raybould, Grace; Cheong, Ying C; Horne, Andrew W (29 Ocak 2020). Cochrane Gynaecology and Fertility Group (Ed.). "Surgical treatment of fibroids for subfertility". Cochrane Database of Systematic Reviews (İngilizce). 2020 (1): CD003857. doi:10.1002/14651858.CD003857.pub4. PMC 6989141 $2. PMID 31995657.
- ^ Cao AM, Cox MR, Eslick GD (March 2016). "Study design in evidence-based surgery: What is the role of case-control studies?". World Journal of Methodology. 6 (1): 101-4. doi:10.5662/wjm.v6.i1.101. PMC 4804244 $2. PMID 27019801.
- ^ a b c d Meinert, Curtis L.; Tonascia, Susan (1986). Clinical trials: design, conduct, and analysis. Oxford University Press, USA. s. 3. ISBN 978-0-19-503568-1. 15 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Haziran 2020.
- ^ Simon, Harvey B. (2002). The Harvard Medical School guide to men's health. New York: Free Press. s. 31. ISBN 978-0-684-87181-3.
- ^ Brown, Stephen R. (2003). Scurvy: How a Surgeon, a Mariner, and a Gentleman Solved the Greatest Medical Mystery of the Age of Sail. New York, NY: St. Martin's Press. 0-312-31391-8
- ^ Rogers, Everett M. (1995). Diffusion of Innovations. New York, NY: The Free Press. 0-7432-2209-1. p. 7.
- ^ Carlisle, Rodney (2004). Scientific American Inventions and Discoveries, John Wiley & Songs, Inc., New Jersey. p. 393. 0-471-24410-4.
- ^ "James Lind: A Treatise of the Scurvy (1754)". 2001. 1 Ekim 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Eylül 2007.
- ^ "About Clinical Trials Day". Clinical Trials Day. 5 Şubat 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Nisan 2023.
- ^ Green, Stephanie; Crowley, John; Benedetti, Jacqueline; Smith, Angela (30 Temmuz 2002). Clinical Trials in Oncology, Second Edition. CRC Press. ss. 1-. ISBN 978-1-4200-3530-8.
- ^ Gad, Shayne Cox (17 Haziran 2009). Clinical Trials Handbook. John Wiley & Sons. ss. 118-. ISBN 978-0-470-46635-3.
- ^ O'Rourke MF (February 1992). "Frederick Akbar Mahomed". Hypertension. 19 (2): 212-7. doi:10.1161/01.HYP.19.2.212. PMID 1737655.
- ^ Creswell, J.W. (2008). Educational research: Planning, conducting, and evaluating quantitative and qualitative research (3rd). Upper Saddle River, NJ: Prentice Hall. 2008, p. 300. 0-13-613550-1
- ^ Hani (2009). "Replication study". 2 Haziran 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ekim 2011.
- ^ Metcalfe NH (February 2011). "Sir Geoffrey Marshall (1887-1982): respiratory physician, catalyst for anaesthesia development, doctor to both Prime Minister and King, and World War I Barge Commander". Journal of Medical Biography. 19 (1): 10-4. doi:10.1258/jmb.2010.010019. PMID 21350072.
- ^ Pharmabiz.com, 19 May 2014, Mumbai ISCR releases Guide for clinical trial participants on International Clinical Trials Day 7 Nisan 2023 tarihinde Wayback Machine sitesinde arşivlendi. (Accessed on 20 May 2014)
- ^ Pottegård, Anton; Haastrup, Maija Bruun; Stage, Tore Bjerregaard; Hansen, Morten Rix; Larsen, Kasper Søltoft; Meegaard, Peter Martin; Meegaard, Line Haugaard Vrdlovec; Horneberg, Henrik; Gils, Charlotte; Dideriksen, Dorthe; Aagaard, Lise; Almarsdottir, Anna Birna; Hallas, Jesper; Damkier, Per (16 Aralık 2014). "SearCh for humourIstic and Extravagant acroNyms and Thoroughly Inappropriate names For Important Clinical trials (SCIENTIFIC): qualitative and quantitative systematic study". BMJ (İngilizce). 349: g7092. doi:10.1136/bmj.g7092. PMC 4267482 $2. PMID 25516539.
- ^ a b "What is a clinical study?". National Library of Medicine, US National Institutes of Health. 1 Mart 2019. 19 Mayıs 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Mayıs 2019.
- ^ Helene S (2010). "EU Compassionate Use Programmes (CUPs): Regulatory Framework and Points to Consider before CUP Implementation". Pharm Med. 24 (4): 223-229. doi:10.1007/BF03256820.
- ^ Brennan, Zachary (5 Haziran 2013). "CROs Slowly Shifting to Adaptive Clinical Trial Designs". Outsourcing-pharma.com. 27 Ağustos 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Ocak 2014.
- ^ "Adaptive Clinical Trials for Overcoming Research Challenges". News-medical.net. 17 Eylül 2013. 11 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Ocak 2014.
- ^ Wang, Shirley S. (30 Aralık 2013). "Health: Scientists Look to Improve Cost and Time of Drug Trials - WSJ.com". Online.wsj.com. 14 March 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 January 2014.
- ^ Huber, Peter W. (12 Kasım 2013). The Cure in the Code: How 20th Century Law Is Undermining 21st Century Medicine. Basic Books. ISBN 978-0-465-06981-1.
- ^ The Lancet (July 2009). "Phase 0 trials: a platform for drug development?". Lancet. 374 (9685): 176. doi:10.1016/S0140-6736(09)61309-X. PMID 19616703.
- ^ a b "Phase IIa and Phase IIb clinical trial". www.musculardystrophyuk.org. 9 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Ağustos 2020.
- ^ a b c Hannan EL (June 2008). "Randomized clinical trials and observational studies: guidelines for assessing respective strengths and limitations". JACC. Cardiovascular Interventions. 1 (3): 211-7. doi:10.1016/j.jcin.2008.01.008. PMID 19463302.
- ^ Sessler DI, Imrey PB (October 2015). "Clinical Research Methodology 2: Observational Clinical Research". Anesthesia and Analgesia. 121 (4): 1043-51. doi:10.1213/ANE.0000000000000861. PMID 26378704.
- ^ Eldridge SM, Lancaster GA, Campbell MJ, Thabane L, Hopewell S, Coleman CL, Bond CM (2016). "Defining Feasibility and Pilot Studies in Preparation for Randomised Controlled Trials: Development of a Conceptual Framework". PLOS ONE. 11 (3): e0150205. Bibcode:2016PLoSO..1150205E. doi:10.1371/journal.pone.0150205. PMC 4792418 $2. PMID 26978655.
- ^ "Active Control / Active Comparator". 3 Mart 2017. 8 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ekim 2017.
- ^ Young, Susan. "Foundation Medicine Joins Coalition Aiming to Shake Up Cancer Drug Trials | MIT Technology Review". Technologyreview.com. 13 Kasım 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Kasım 2013.
- ^ "ICH Official web site" (PDF). www.ich.org. 21 Eylül 2008 tarihinde kaynağından (PDF) arşivlendi.
- ^ "ICH Official web site : ICH". ich.org. 25 Mayıs 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Ekim 2008.
- ^ a b c "Learn About Clinical Studies". clinicaltrials.gov. 10 April 2012 tarihinde kaynağından arşivlendi.
- ^ Maloney, Dennis M (1984). Protection of Human Research Subjects: A Practical Guide to Federal Laws and Regulations. Boston, MA: Springer US. s. 151. ISBN 9781461327035.
- ^ Dorey, Frederick (2011). "Statistics in Brief: Statistical Power: What Is It and When Should It Be Used?". Clinical Orthopaedics and Related Research. 469 (2): 619-620. doi:10.1007/s11999-010-1435-0. PMC 3018227 $2. PMID 20585913.
- ^ Norwitz ER, Greenberg JA (2011). "FDA approval for use of medications in pregnancy: an uphill battle". Reviews in Obstetrics & Gynecology. 4 (2): 39-41. PMC 3218552 $2. PMID 22102925.
- ^ "Frequently Asked Questions | University of Arizona Cancer Center". Azcc.arizona.edu. 2 Aralık 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Kasım 2013.
- ^ Miseta, Ed (17 Aralık 2019). "Janssen Uses Geofencing To Monitor Clinical Trial Patients". Clinical Leader. Pennsylvania, United States: VertMarkets. 27 Ocak 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Ocak 2020.
- ^ Unger, JM; Cook, E; Tai, E; Bleyer, A (2016). "The Role of Clinical Trial Participation in Cancer Research: Barriers, Evidence, and Strategies". American Society of Clinical Oncology Educational Book. American Society of Clinical Oncology. Annual Meeting. American Society of Clinical Oncology. 35 (36): 185-198. doi:10.1200/EDBK_156686. PMC 5495113 $2. PMID 27249699.
- ^ Weiss SC, Rowell R, Krochmal L (2008). "Impact of seasonality on conducting clinical studies in dermatology". Clinics in Dermatology. 26 (5): 565-9. doi:10.1016/j.clindermatol.2008.01.016. PMID 18755376.
- ^ Khan, Yamin; Tilly, Sarah. "Seasonality: The Clinical Trial Manager's Logistical Challenge" (PDF). Pharm-Olam International. 15 July 2011 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 26 April 2010.
- ^ Marshall, Megan (19 Aralık 2019). "Implementing QbD in Your Clinical Trial? 4 Questions To Answer First". Clinical Leader. Pennsylvania: VertMarkets. 27 Ocak 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Ocak 2020.
- ^ Yang, Z. J., et al. (2010). "Motivation for Health Information Seeking and Processing About Clinical Trial Enrollment". Health Communication 25(5): 423–436.
- ^ "BIO to Use ViS Analytics to Streamline Pediatric Clinical Research - WSJ.com". Online.wsj.com. 7 Mayıs 2013. 4 Şubat 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Kasım 2013.
- ^ Life Sciences Strategy Group, "Clinical Trial Technology Utilization, Purchasing Preferences & Growth Outlook" Syndicated Publication, May 2009
- ^ "Electronic Patient Reported Outcomes (ePRO) – Changing the Face of Clinical Trials". Med-Quest.org. 21 Mayıs 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Mayıs 2015.
- ^ a b Evans, Scott R. (2010). "Common statistical concerns in clinical trials". Journal of Experimental Stroke & Translational Medicine. 3 (1): 1-7. doi:10.6030/1939-067x-3.1.1. ISSN 1939-067X. PMC 3059317 $2. PMID 21423790.
- ^ a b Evans Jr., CH; Ildstad, ST, (Ed.) (2001). "Statistical Approaches to Analysis of Small Clinical Trials". Small Clinical Trials Issues and Challenges; In: Statistical Approaches to Analysis of Small Clinical Trials. National Academies Press (US). 15 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Kasım 2022.
- ^ Gordon, E. J.; Prohaska, T. R. (2006). "The Ethics of Withdrawal from Study Participation". Accountability in Research. 13 (4): 285-309. doi:10.1080/08989620600848645. PMC 9527709 $2. PMID 17849641.
- ^ "Assembly Bill No. 2328" (PDF). 2 Aralık 2007 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 19 Kasım 2007.
- ^ Hayden EC (November 2014). "Ethical dilemma for Ebola drug trials". Nature. 515 (7526): 177-8. Bibcode:2014Natur.515..177C. doi:10.1038/515177a. PMID 25391940.
- ^ Pattinson, Shaun D. (2012). "Emergency research and the interests of participants" (PDF). Medical Law International (İngilizce). 12 (2): 121-141. doi:10.1177/0968533212465615. 9 Nisan 2023 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 13 Temmuz 2019.
- ^ Span, Paula (3 Mart 2020). "When a Drug Study Abruptly Ends, Volunteers Are Left to Cope". The New York Times (İngilizce). ISSN 0362-4331. 7 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Nisan 2020.
- ^ Moynihan, R. (2003). "Who pays for the pizza? Redefining the relationships between doctors and drug companies. 2: Disentanglement". British Medical Journal. 326 (7400): 1193-1196. doi:10.1136/bmj.326.7400.1193. PMC 1126054 $2. PMID 12775622.
- ^ "Hogan & Hartson Update on Pharmaceutical Trial Registration" (PDF). 3 March 2008. 25 June 2008 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 2 June 2008.
- ^ "Rise in Scientific Journal Retractions Prompts Calls for Reform". The New York Times. 16 Nisan 2012. 18 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Mayıs 2018.
- ^ Woolley KL, Lew RA, Stretton S, Ely JA, Bramich NJ, Keys JR, Monk JA, Woolley MJ (June 2011). "Lack of involvement of medical writers and the pharmaceutical industry in publications retracted for misconduct: a systematic, controlled, retrospective study". Current Medical Research and Opinion. 27 (6): 1175-82. doi:10.1185/03007995.2011.573546. PMID 21473670.
- ^ Sox HC, Rennie D (August 2008). "Seeding trials: just say "no"". Annals of Internal Medicine. 149 (4): 279-80. doi:10.7326/0003-4819-149-4-200808190-00012. PMID 18711161.
- ^ "Development & Approval Process (Drugs)". U.S. Food and Drug Administration. 10 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Mayıs 2018.
- ^ "Information Sheet Guidance For IRBs, Clinical Investigators, and Sponsors: FDA Inspections of Clinical Investigators" (PDF). Food and Drug Administration. June 2010. 11 Haziran 2014 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 16 Ekim 2014.
- ^ Davidoff F, DeAngelis CD, Drazen JM, Nicholls MG, Hoey J, Højgaard L, Horton R, Kotzin S, Nylenna M, Overbeke AJ, Sox HC, Van Der Weyden MB, Wilkes MS (September 2001). "Sponsorship, authorship and accountability". CMAJ. 165 (6): 786-8. PMC 81460 $2. PMID 11584570. 15 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Şubat 2011.
- ^ Mansi, Bernadette A.; Clark, Juli; David, Frank S.; Gesell, Thomas M.; Glasser, Susan; Gonzalez, John; Haller, Daniel G.; Laine, Christine; Miller, Charles L.; Mooney, LaVerne A.; Zecevic, Maja (May 2012). "Ten recommendations for closing the credibility gap in reporting industry-sponsored clinical research: a joint journal and pharmaceutical industry perspective". Mayo Clinic Proceedings. 87 (5): 424-429. doi:10.1016/j.mayocp.2012.02.009. ISSN 1942-5546. PMC 3538468 $2. PMID 22560521.
- ^ Tohen, Mauricio (September 2013). "Credibility of industry-funded clinical trials". The International Journal of Neuropsychopharmacology. 16 (8): 1879-1884. doi:10.1017/S1461145713000461. ISSN 1469-5111. PMID 23672957.
- ^ Tohen, Mauricio (1 Şubat 2017). "Treatment Guidelines in Bipolar Disorders and the Importance of Proper Clinical Trial Design". The International Journal of Neuropsychopharmacology. 20 (2): 95-97. doi:10.1093/ijnp/pyx002. ISSN 1469-5111. PMC 5356994 $2. PMID 28927197.
- ^ Tohen, Mauricio (2018). "Severity of symptoms in mania-clinical guidelines and study design implications". Bipolar Disorders. 20 (2): 171-172. doi:10.1111/bdi.12598. ISSN 1399-5618. PMID 29327798. 8 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mayıs 2021.
- ^ Tohen, Mauricio (2013). "Credibility of industry-funded clinical trials". The International Journal of Neuropsychopharmacology. 16 (8): 1879-1884. doi:10.1017/S1461145713000461. ISSN 1469-5111. PMID 23672957.
- ^ a b c Edwards, Kathryn M.; Kochhar, Sonali (2020). "Ethics of Conducting Clinical Research in an Outbreak Setting". Annual Review of Virology. 7 (1): 475-494. doi:10.1146/annurev-virology-013120-013123. PMID 32212920.
- ^ "Data and Safety Monitoring Board Training Manual for Investigator-Initiated Studies – Tufts CTSI". tuftsctsi.wpengine.com. 7 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Kasım 2019.
- ^ Designing and Conducting Clinical Trials – An overview. International Journal of Statistics and Medical Informatics. 2019. ISBN 9781096489085.
- ^ "For Patients: Informed Consent for Clinical Trials". US Food and Drug Administration. 25 Şubat 2016. 22 Temmuz 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ağustos 2017.
- ^ Guidance for Industry: Financial Disclosure by Clinical Investigators, Food and Drug Administration, 20 Mart 2001, 11 Mayıs 2009 tarihinde kaynağından arşivlendi, erişim tarihi: 16 Aralık 2019
- ^ Lang T, Siribaddana S (2012). "Clinical trials have gone global: is this a good thing?". PLOS Medicine. 9 (6): e1001228. doi:10.1371/journal.pmed.1001228. PMC 3373653 $2. PMID 22719228.
- ^ "India: Prime Destination for Unethical Clinical Trials". Common Dreams. 15 Aralık 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Aralık 2007.
- ^ "Pmda.go.jp 独立行政法人 医薬品医療機器総合機構" (PDF). 17 Aralık 2008 tarihinde kaynağından (PDF) arşivlendi.
- ^ "ICH Official web site : ICH". www.ich.org. 30 Haziran 2007 tarihinde kaynağından arşivlendi.
- ^ "Management of Safety Information from Clinical Trials: Report of CIOMS Working Group VI". CIOMS Publications. 2005. 15 Ağustos 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Kasım 2017.
- ^ a b "Investigational New Drug (IND) Application - Final Rule: Investigational New Drug Safety Reporting Requirements for Human Drug and Biological Products and Safety Reporting Requirements for Bioavailability and Bioequivalence Studies in Humans". fda.gov (İngilizce). Center for Drug Evaluation and Research. 29 Eylül 2010. 23 Nisan 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Kasım 2017.
- ^ "Safety Assessment for IND Safety Reporting Guidance for Industry" (PDF). Food and Drug Administration. December 2015. 4 Mayıs 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 11 Kasım 2017.
- ^ "Evidence Synthesis and Meta-Analysis: Report of CIOMS Working Group X". CIOMS Publications. 2016. 15 Ağustos 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Kasım 2017.
- ^ Sertkaya, Aylin; Wong, Hui-Hsing; Jessup, Amber; Beleche, Trinidad (2016). "Key cost drivers of pharmaceutical clinical trials in the United States". Clinical Trials. 13 (2): 117-126. doi:10.1177/1740774515625964. PMID 26908540.
- ^ "Tax Credit for Testing Expenses for Drugs for Rare Diseases or Conditions". Food and Drug Administration. 17 Nisan 2001. 6 Nisan 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mart 2007.
- ^ Paul J, Seib R, Prescott T (March 2005). "The Internet and clinical trials: background, online resources, examples and issues". Journal of Medical Internet Research. 7 (1): e5. doi:10.2196/jmir.7.1.e5. PMC 1550630 $2. PMID 15829477.
- ^ Stunkel, Leanne; Grady, Christine (May 2011). "More than the money: A review of the literature examining healthy volunteer motivations". Contemporary Clinical Trials (İngilizce). 32 (3): 342-352. doi:10.1016/j.cct.2010.12.003. PMC 4943215 $2. PMID 21146635.
- ^ Liu JJ, Davidson E, Sheikh A (2011). "Achieving Ethnic Diversity in Trial Recruitment". Pharm Med. 25 (4): 215-222. doi:10.1007/BF03256863. 14 Kasım 2011 tarihinde kaynağından arşivlendi.
- ^ McDonald AM, Knight RC, Campbell MK, Entwistle VA, Grant AM, Cook JA, Elbourne DR, Francis D, Garcia J, Roberts I, Snowdon C (April 2006). "What influences recruitment to randomised controlled trials? A review of trials funded by two UK funding agencies". Trials. 7: 9. doi:10.1186/1745-6215-7-9. PMC 1475627 $2. PMID 16603070.
- ^ "Volunteering for a Clinical Trial". Boston, MA: CenterWatch. 2016. 25 Kasım 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Kasım 2016.
- ^ "Diversity and Inclusion in Clinical Trials". NIMHD (İngilizce). 18 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Aralık 2022.
- ^ Konkel, Lindsey (2015). "Racial and Ethnic Disparities in Research Studies: The Challenge of Creating More Diverse Cohorts". Environmental Health Perspectives. 123 (12): A297-A302. doi:10.1289/ehp.123-A297. ISSN 0091-6765. PMC 4670264 $2. PMID 26625444.
- ^ "Nearly Half of Black Patients With Metastatic Breast Cancer Report Not Being Informed About Clinical Trials". 6 Ağustos 2022. 7 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Nisan 2023.
- ^ Pittman, Corinne A.; Roura, Raúl; Price, Carrie; Lin, Frank R.; Marrone, Nicole; Nieman, Carrie L. (1 Temmuz 2021). "Racial/Ethnic and Sex Representation in US-Based Clinical Trials of Hearing Loss Management in Adults: A Systematic Review". JAMA Otolaryngology–Head & Neck Surgery (İngilizce). 147 (7): 656-662. doi:10.1001/jamaoto.2021.0550. ISSN 2168-6181. PMID 33885733.
- ^ "How to stop a lack of diversity undermining clinical trial data". Financial Times. 18 Ocak 2019. 10 Aralık 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Şubat 2019.
- ^ "Parkinson's Disease Clinical Trials". Fox Trial Finder. 8 Temmuz 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Kasım 2013.
- ^ "Medical Information on the Internet". Mlanet.org. 3 October 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Kasım 2013.
- ^ Klein, Harry; Mazor, Tali; Siegel, Ethan; Trukhanov, Pavel; Ovalle, Andrea; Vecchio Fitz, Catherine Del; Zwiesler, Zachary; Kumari, Priti; Van Der Veen, Bernd; Marriott, Eric; Hansel, Jason; Yu, Joyce; Albayrak, Adem; Barry, Susan; Keller, Rachel B.; MacConaill, Laura E.; Lindeman, Neal; Johnson, Bruce E.; Rollins, Barrett J.; Do, Khanh T.; Beardslee, Brian; Shapiro, Geoffrey; Hector-Barry, Suzanne; Methot, John; Sholl, Lynette; Lindsay, James; Hassett, Michael J.; Cerami, Ethan (6 Ekim 2022). "MatchMiner: an open-source platform for cancer precision medicine". npj Precision Oncology (İngilizce). 6 (1): 69. doi:10.1038/s41698-022-00312-5. ISSN 2397-768X. PMC 9537311 $2. PMID 36202909.
- ^ a b Yang ZJ, McComas KA, Gay GK, Leonard JP, Dannenberg AJ, Dillon H (2012). "Comparing decision making between cancer patients and the general population: thoughts, emotions, or social influence?". Journal of Health Communication. 17 (4): 477-94. doi:10.1080/10810730.2011.635774. PMID 22376222.
- ^ a b "What to Know About Cancer Clinical Trial Matching Programs". Cancer.Net (İngilizce). 14 Mart 2023. 28 Eylül 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Aralık 2023.
- ^ a b "How to Search for Clinical Studies". ClinicalTrials.gov, US National Library of Medicine. 2023. 26 Aralık 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Aralık 2023.
- ^ Fountzilas E, Tsimberidou AM, Vo HH, Kurzrock R (August 2022). "Clinical trial design in the era of precision medicine". Genome Medicine. 14 (1): 101. doi:10.1186/s13073-022-01102-1. PMC 9428375 $2. PMID 36045401.
- ^ Fleury ME (2023). "Consensus recommendations for improving the cancer clinical trial matching environment". Cancer: 1-5. doi:10.1002/cncr.35034. 26 Aralık 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Aralık 2023.
- ^ Van Norman, G. A. (27 Nisan 2021). "Decentralized Clinical Trials". JACC: Basic to Translational Science. 6 (4): 384-387. doi:10.1016/j.jacbts.2021.01.011. PMC 8093545 $2. PMID 33997523.
Ayrıca bakınız
[değiştir | kaynağı değiştir]Dış bağlantılar
[değiştir | kaynağı değiştir]- Beşeri İlaçların Ruhsatlandırılmasına İlişkin Teknik Şartların Uyumlaştırılması Uluslararası Konferansı, klinik araştırmaların düzenlenmesine ilişkin bir kılavuz (İngilizce)
- ClinicalTrials.gov, kayıtlı klinik araştırmaların dünya çapında bir veritabanı; ABD Ulusal Tıp Kütüphanesi (İngilizce)
- Cochrane Central Register of Controlled Trials (CENTRAL), randomize kontrollü çalışmaların bibliyografik raporları için konsantre bir kaynak (İngilizce)
