Toryum
Toryum; sembolü Th, atom numarası 90 olan zayıf radyoaktivite gösteren, metalik, kimyasal bir elementtir. Toryum havaya maruz kaldığında kararır ve toryum dioksit oluşturur; orta derecede yumuşak, işlenebilir ve yüksek bir erime noktasına sahiptir. Toryum, kimyasına +4 oksidasyon durumunun hakim olduğu elektropozitif bir aktinittir; oldukça reaktiftir ve ince bir şekilde bölündüğünde havada tutuşabilir.
Bilinen tüm toryum izotopları kararsızdır. En kararlı izotop olan 232Th 'nin yarı ömrü 14.05' milyar yıldır; toryum serisi adlı çok yavaş bir alfa bozunması zinciri ile kararlı 208Pb''e dönüşür.
Dünya'da, toryum ve uranyum, hala doğal olarak büyük miktarlarda ilkel elementler olarak bulunan önemli ölçüde radyoaktif elementlerdir. [a] Toryumun yer kabuğunda uranyumdan üç kat daha fazla olduğu tahmin ediliyor ve esas olarak nadir toprak metallerinin çıkarılmasının bir yan ürünü olarak monazit kumlarından rafine ediliyor.
Toryum, 1828'de Norveçli amatör mineralog Morten Thrane Esmark tarafından keşfedildi ve ona İskandinav tanrısı Thor'un adını veren İsveçli kimyager Jöns Jacob Berzelius tarafından tanımlandı. İlk uygulamaları 19. yüzyılın sonlarında geliştirilmiştir. Toryumun radyoaktivitesi, 20. yüzyılın ilk on yıllarında geniş çapta kabul görmüştür.
Toryum halen TIG kaynak elektrotlarında alaşım olarak kullanılmakta ve yerini yavaş yavaş farklı bileşimlere bırakmaktadır. Ayrıca, bazı vakum tüpleri ve gaz örtülerinde ışık kaynağı olarak kullanılan üst düzey optik ve bilimsel enstrümantasyonda da kullanılmaktaydı. Nükleer reaktörlerde nükleer yakıt olarak uranyumun yerini alması önerildi ve birkaç toryum reaktörü inşa edildi. Bu reaktörlerden birisine Çinde Çin Fizik enstitüsü tarafından deneysel işletme izni verildi.[1][2] Toryum ayrıca magnezyumun güçlendirilmesinde, elektrikli ekipmanlarda tungsten telinin kaplanmasında, elektrik lambalarında, yüksek sıcaklık potaların ve kamera ve bilimsel alet lensleri dahil olmak üzere camlarda tungsten tanecik boyutunun kontrol edilmesinde kullanılır. Toryumun diğer kullanımları arasında ısıya dayanıklı seramikler, uçak motorları ve ampuller bulunur. Okyanus bilimi, antik okyanusu anlamak için 231Pa / 230Th izotop oranlarını kullanmıştır.[3]
Kitle özellikleri
[değiştir | kaynağı değiştir]Toryum orta derecede yumuşak, paramanyetik, parlak gümüşi radyoaktif bir aktinit metalidir. Periyodik tabloda aktinyumun sağında, protaktinyumun solunda ve seryumun altında yer alır. Saf toryum çok sünektir ve metallerde olduğu gibi haddelenebilir, dövülebilir ve çekilebilir.[4]
Toryum metalinin kitle modülü (malzemenin sıkıştırılma karşısında gösterdiği bir direnç ölçüsü) 54'GPadır.[5] Toryum yaklaşık olarak yumuşak çelik kadar serttir, bu nedenle ısıtıldığında levha ve tel haline getirilebilir.[6]
Toryum, uranyum ve plütonyumun neredeyse yarısı yoğunlukta ve her ikisinden de serttir.[6] 1.4'K altında süper iletken hale gelir.[4] Toryumun erime noktası 1750 °C dir. Diğer periyotlarda olduğu gibi 7. periyodun da başındaki fransiyumdan toryuma, elementlerin erime noktaları artar, çünkü her atomun katkıda bulunduğu delokalize elektronların sayısı fransiyumda bir iken toryumda dörde çıkar ve bu da aralarında daha fazla çekime yol açar. Toryumdan sonra, erime noktalarında bir düşüş eğilimi vardır, burada f elektronlarının sayısı yaklaşık 0,4'ten 6'ya çıkar: bu eğilim, 5f ve 6d orbitallerinin artan hibridizasyonu ve yönlü oluşumundan kaynaklanmaktadır.[6][7] Kaliforniyuma kadar olan aktinitler arasında, toryum en yüksek erime ve kaynama noktalarına ve ikinci en düşük yoğunluğa sahiptir. Toryumun kaynama noktası 4788 °C, bilinen kaynama noktalarına sahip tüm elementler arasında beşinci en yüksek olanıdır.[b]
Toryumun özellikleri, numunedeki safsızlıkların derecesine bağlı olarak büyük ölçüde değişir. Ana safsızlık genellikle toryum dioksittir. (ThO
2 ); en saf toryum örnekleri bile yaklaşık yüzde on içerir.[4] Yoğunluğunun deneysel ölçümleri 11.5 ve11.66 g/cm 3 arasında değerler verir: bunlar teorik olarak beklenen değer olan 11,7'den biraz daha düşüktür. Kafes parametrelerinden hesaplanan bu değer farkı muhtemelen metal döküldüğünde oluşan mikroskobik boşluklardan kaynaklanmaktadır.[4]
Toryum metallerle alaşım oluşturabilir. Küçük oranlarda eklenmesi, magnezyumun mekanik gücünü artırır ve toryum-alüminyum alaşımları, toryumu gelecekteki toryum nükleer reaktörlerinde depolamanın bir yolu olarak düşünülür. Toryum, krom ve uranyum ile ötektik karışımlar oluşturur ve daha hafif türdeş seryum ile hem katı hem de sıvı halde tamamen karışabilir.[4]
İzotoplar
[değiştir | kaynağı değiştir]232Th, yarı ömrü 14.05 milyar yıldır. Bu Dünyanın yaşının yaklaşık üç katı ve evrenin yaşından biraz daha uzundur. Dünya'nın oluşumunda bulunan toryumun beşte dördü günümüze kadar gelmiştir.[9][10] 232 Th, toryumun doğada bulunan tek izotopudur.[9] Kararlılığı, 142 nötronlu kapalı nükleer alt kabuğuna atfedilir.[11][12] Atom ağırlığı 232,0377±0,0004 olan karakteristik bir karasal izotopik bileşime sahiptir.
Toryum çekirdekleri alfa bozunmasına karşı hassastır çünkü güçlü nükleer kuvvet, protonları arasındaki elektromanyetik itmeyi yenemez.[13] 232Th'nin alfa bozunması, kütle numarası 4'e bölünebilen izotopları içeren 4n bozunma zincirini başlatır (bu nedenle adı; toryum serisi olarak da anılır). Bu ardışık alfa ve beta bozunma zinciri, 232Th'den 228Ra'ya bozunma ile başlar ve 208Pb'de sona erer.[9] Herhangi bir toryum örneği, talyum, kurşun, bizmut, polonyum, radon, radyum ve aktinyum izotopları olan bu kızların izlerini içerir.[9] Doğal toryum numuneleri , nükleer tıpta kanser tedavisi için kullanılan 212Pb gibi faydalı kardeş çekirdekleri çıkarmak için kimyasal olarak saflaştırılabilir.[14][15] 227Th (18.68 günlük yarı ömre sahip alfa yayıcı), hedeflenen alfa terapileri gibi kanser tedavilerinde de kullanılabilir.[16][17][18] 232Th ayrıca çok nadiren alfa bozunması yerine kendiliğinden fisyona uğrar ve minerallerinde buna dair kanıtlar (bir fisyon ürünü olarak oluşan hapsolmuş ksenon gazı olarak) bırakmıştır. Ancak bu sürecin kısmi yarı ömrü 1021 yıl üzerinde, çok büyük ve alfa bozunması baskındır.[4][19]
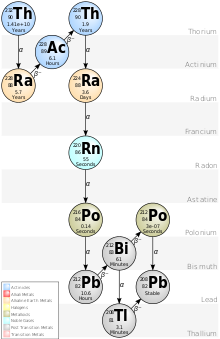
Toplamda, kütle numarası 207[20] ila 238 arasında değişen 32 radyoizotop karakterize edilmiştir.[4] 232 Th'den sonra, en kararlıları 230Th' (75.380 yıl), 229Th (7.917 yıl), 228Th (1,92 yıl), 234Th (24.10 gün) ve 227Th (18.68gün) dür.
Bu izotopların tümü, 232Th, 235U, 238U ve 237Np bozunma zincirlerinde bulunmaları nedeniyle doğada iz radyoizotoplar olarak bulunur: ancak uranyum cevherlerinde nötron yakalanması ile çok küçük izler halinde üretilir. Kalan tüm toryum izotoplarının yarılanma ömürleri otuz günden ve bunların çoğunluğunun yarılanma ömürleri on dakikadan azdır.[9]
Derin deniz sularında 230Th, doğal toryumun yüzde 0,02 oluşturur. Bunun nedeni, ebeveyni olan 238U'nun suda çözünür olması, ancak 230Th'nin çözünmemesi ve çökelmesidir. Düşük toryum konsantrasyonlarına sahip uranyum cevherleri, toryum örnekleri üretmek için saflaştırılabilir.[4] Uluslararası Saf ve Uygulamalı Kimya Birliği (IUPAC) toryumu 2013'te binuklidik bir element olarak yeniden sınıflandırdı; daha önce tek çekirdekli bir unsur olarak kabul edilmişti.[21]
Toryumun bilinen üç nükleer izomeri (veya metastabil durumu) vardır: 216m1Th, 216m2Th ve 229mTh. 229mTh, herhangi bir izomer arasında bilinen en düşük uyarılma enerjisine sahiptir,[22] 7,6±0,5 olarak ölçülmüştür. Bu o kadar düşüktür ki izomerik geçiş yaptığında yayılan gama radyasyonu ultraviyole aralığındadır.[23][24]
Farklı toryum izotopları kimyasal olarak aynıdır, ancak biraz farklı fiziksel özelliklere sahiptir: örneğin, saf 228Th, 229Th, 230Th ve 232Th'nin yoğunluklarının sırasıyla 11.5, 11.6, 11.6 ve 11.7 g/ cm3 olması beklenir.[25] 232 Th bölünebilir değildir, ancak nötron yakalama ve müteakip beta bozunması ile bölünebilir 233U'ya dönüştürülebildiği için verimlidir.[25][4]
Radyometrik tarihleme
[değiştir | kaynağı değiştir]İki radyometrik tarihleme yöntemi, 234U'nun 230Th'ye bozunmasına dayanan uranyum-toryum tarihlemesi ve 232Th'nin 230Th'a oranını ölçen iyonyum-toryum tarihlemesidir.[c] Bunlar, 232Th'nin ilksel bir radyoizotop olduğu, ancak 230Th'nin yalnızca 238U bozunma zincirinde bir bozunma ürünü olarak ortaya çıktığı gerçeğine dayanır.[26] Uranyum-toryum tarihleme, Dünya'nın yaşına göre 234U ve 230Th'nin kısa yarı ömürleri nedeniyle nispeten kısa menzilli bir süreçtir: ayrıca 235U'nun 231Th'ye alfa bozunmasını içeren bir kardeş süreç de eşlik eder; çok hızlı bir şekilde daha uzun ömürlü 231Pa olur ve bu süreç genellikle uranyum-toryum tarihlemesinin sonuçlarını kontrol etmek için kullanılır. Uranyum-toryum tarihlemesi, speleothem veya mercan gibi kalsiyum karbonat malzemelerinin yaşını belirlemek için yaygın olarak kullanılır, çünkü uranyum suda, oranlarının ölçüldüğü okyanus tabanı çökeltilerine seçici olarak çökeltilen toryum ve protaktinyumdan daha fazla çözünür. (birkaç yüz bin yıllık bir ölçümsapması ile).[26][27]
İyonyum-toryum tarihlemesi, toryumun (hem 232Th hem de 230Th) çözünmezliği ve dolayısıyla okyanus çökeltilerindeki varlığından yararlanarak 232Th ila 230Th oranını ölçerek bu çökeltileri tarihlendiren bir süreçtir.[28][29] Bu tarihleme yöntemlerinin her ikisi de, tortu tabakasının oluştuğu dönemde 230Th'nin 232Th'ye oranının sabit olduğunu, tortunun uranyumun çürümesinden kaynaklanan katkılardan önce toryum içermediğini ve toryumun tabaka içerisinde göç edemeyeceğini varsayar.[28][29]
Kimya
[değiştir | kaynağı değiştir]Bir toryum atomunun dördü değerlik elektronu olan 90 elektronu vardır. Değerlik elektronlarının işgal ettiği teorik olarak dört atomik orbital mevcuttur: 5f, 6d, 7s ve 7p.[4] Toryumun periyodik tablonun f bloğundaki konumuna rağmen, erken aktinitlerdeki 5f ve 6d alt kabukları enerji açısından çok yakın olduğundan, temel durumda anormal bir [Rn]6d27s2 elektron konfigürasyonuna sahiptir: toryumun 6d alt kabuklarının enerjisi, 5f alt kabuklarından daha düşüktür, çünkü 5f alt kabukları dolu 6s ve 6p alt kabukları tarafından iyi korunmaz ve dengesizleşir. Bunun nedeni, periyodik tablonun alt kısmına yakın yerlerde güçlenen göreli etkiler, özellikle göreli spin-yörünge etkileşimidir. Toryumun 5f, 6d ve 7s enerji seviyelerindeki yakınlık, toryumun neredeyse her zaman dört değerlik elektronunu kaybetmesi ve mümkün olan en yüksek oksidasyon durumu olan +4'te meydana gelmesine neden olur. Toryum, iyonlaşma enerjileri ve redoks potansiyelleri ve dolayısıyla kimyası açısından seryumdan çok geçiş metalleri zirkonyum ve hafniyuma benzer: bu geçiş metali benzeri davranış, aktinit serisinin ilk yarısında normdur.[30][31]

Th4+4+ : __ / O2− : __
Gaz halindeki toryum atomlarının anormal elektron konfigürasyonuna rağmen, metalik toryum önemli 5f katılımı gösterir. Fermi seviyesinin üzerinde 5f orbitalleri ile [Rn]6d27s2 konfigürasyonuna sahip varsayımsal bir metalik durumu, 4. grup elementleri titanyum, zirkonyum ve hafniyum gibi altıgen yakın paketli olmalı ve yüz merkezli kübik olmamalıdır. Gerçek kristal yapı ancak 5f durumları çağrıldığında açıklanabilir, bu da toryumun metalurjik olarak gerçek bir aktinit olduğunu kanıtlar.[7]
Tetravalan toryum bileşikleri, gümüş veya kurşuna benzer şekilde genellikle renksiz veya sarıdır. Th4+ iyonunun 5f veya 6d elektronu yoktur.[6] Bu nedenle toryum kimyası, büyük ölçüde, toryum ile s bloğunun ana grup elemanları arasında bir benzerliği gösteren, kararlı bir asal gaz konfigürasyonuna sahip tek bir diyamanyetik iyon oluşturan elektropozitif bir metalinkidir.[32] [d] Toryum ve uranyum radyoaktif elementler arasında radyoaktiviteleri laboratuvarda özel işlem gerektirmeyecek kadar düşük olmaları nedeniyle en çok araştırılanlardır.[33]
Reaktivite
[değiştir | kaynağı değiştir]Toryum oldukça reaktif, elektropozitif bir metaldir. −1,90 V standart indirgeme potansiyeli ile /Th çifti zirkonyum veya alüminyumdan biraz daha elektropozitiftir.[34] İnce bölünmüş toryum metali, havada kendiliğinden tutuşarak piroforiklik sergileyebilir.[4] Toryum talaşları havada ısıtıldığında parlak beyaz bir ışıkla yanarak dioksit üretir. Saf toryumun hava ile reaksiyonu yavaştır, ancak birkaç ay sonra korozyon meydana gelebilir; çoğu toryum numunesi, korozyonu büyük ölçüde hızlandıran, değişen derecelerde dioksit ile kirlenmiştir. Bu tür numuneler yavaş yavaş matlaşır, grileşir ve sonunda yüzey siyah olur.[4]
Standart sıcaklık ve basınçta, toryum su tarafından yavaşça saldırıya uğrar, ancak çözünmeyen siyah bir ThO(OH, Cl)H tortusu bırakarak çözündüğü hidroklorik asit haricinde, çoğu yaygın asitte kolayca çözünmez.[4][35] Az miktarda katalitik florür veya florosilikat iyonları içeren konsantre nitrik asitte çözünür;[4][36] bunlar mevcut değilse, uranyum ve plütonyumda olduğu gibi nitrat tarafından pasivasyon meydana gelebilir.[33][37]

İnorganik bileşikler
[değiştir | kaynağı değiştir]Metal olmayan toryum ikili bileşiklerinin çoğu, elementlerin birlikte ısıtılmasıyla hazırlanabilir.[33] Havada, toryum yanarak ThO
2 oluşur, florit yapıya sahiptir.[38] Toryum dioksit, bilinen oksitler arasında erime noktası en yüksek (3390 °C) olan refrakter bir malzemedir.[39] Biraz higroskopiktir ve su ve birçok gazla kolayca reaksiyona girer; florür varlığında konsantre nitrik asitte kolayca çözünür.[33]
Toryum dioksit havada ısıtıldığında yoğun mavi ışık yayar; ThO
2'un daha hafif olan homolog seryum dioksit (CeO
2, serya) ile karışımı ışığı beyazlatır : bu, gaz mantolarında geçmişte yaygın olarak kullanılan uygulamanın temelidir.[4] Bu etki için alev gerekli değildir: 1901'de sıcak bir Welsbach gaz mantosu keşfedildi. ThO
2, %1CeO
2 ile tutuşmayan soğuk yanıcı bir gaz ve hava karışımına maruz kaldığında "tam parlaklıkta" kalmıştı.[40] Toryum dioksit tarafından yayılan ışığın dalga boyu, aynı sıcaklıkta akkorluktan beklenen kara cisim emisyonundan daha yüksektir, bu etki kandolüminesans olarak adlandırılır. Bu ThO
2: Ce, alevde yüksek konsantrasyonda ortaya çıkan serbest radikallerin rekombinasyonu için bir katalizör görevi görür ve bunların uyarılması büyük miktarlarda enerji açığa çıkarır. Gaz mantolarında olduğu gibi %1 seryum dioksit ilavesi, spektrumun görünür bölgesindeki emisyon üzerinden etkiyi artırır; ancak seryum, toryumdan farklı olarak, çoklu oksidasyon durumlarında ortaya çıkabileceğinden, yükü ve dolayısıyla görünür emisyonu, bulunduğu alev üzerindeki bölgeye bağlı olacaktır.[40]
Toryumun Kükürt, selenyum ve tellür ile çeşitli ikili çeşitli kalkojenit ve oksikalkojenitleri de bilinmektedir.[4]
Toryumun dört tetrahalidinin tamamı bilinmektedir: tetrahalidlerin tümü, su gibi polar çözücülerde kolaylıkla çözünen 8-koordinatlı higroskopik bileşiklerdir. Pek çok ilişkili polihalid iyonu da bilinmektedir.[4] Toryum tetraflorür, zirkonyum tetraflorür ve hafniyum tetraflorür gibi monoklinik bir kristal yapıya sahiptir.Th4+ iyonları biraz bozulmuş kare antiprizmalarda F−
ile koordine edilir. Diğer tetrahalidler bunun yerine dodekahedral geometriye sahiptir.[33] Düşük iyodürler ThI
3 (siyah) ve ThI
2 (altın renkli), tetraiyodürün toryum metali ile indirgenmesiyle de hazırlanabilir: Th(III) ve Th(II) içermezler, bunun yerine Th4+ içerir ve daha açık bir şekilde elektrid bileşikleri olarak formüle edilebilir.[4]
Alkali metaller, baryum, talyum ve amonyum içeren birçok poliner halojenür, toryum florür, klorür ve bromürler bilinir.[4] Örneğin, potasyum florür ve hidroflorik asit ile işlendiğinde, karmaşık [ThF
6]2− (hekzaflorotorat(IV)) anyonu oluşur ve çözünmez bir tuz olarak K
2[ThF
6] (potasyum hekzaflorotorat(IV)) çöker.[36]
Toryum borür, karbür, silisit ve nitrürler, uranyum ve plütonyum gibi dayanıklı malzemelerdir ve bu nedenle olası nükleer yakıtlar olarak dikkat çekmiştir.[33] Dört ağır piktojenin tümü (fosfor, arsenik, antimon ve bizmut) ayrıca ikili toryum bileşikleri oluşturur. Toryum germanitler de bilinmektedir.[4] Toryum, hidritler oluşturmak üzere hidrojenle reaksiyona girer; ThH
2 ve Th
4H
15, ikincisi 7,5–8' K'in altında süper iletkendir; standart sıcaklık ve basınçta elektriği bir metal gibi iletir.[4] Hidritler termal olarak kararsızdır ve hava veya neme maruz kaldıklarında kolaylıkla ayrışırlar.[33]

Koordinasyon bileşikleri
[değiştir | kaynağı değiştir]Asidik sulu bir çözeltide, toryum tetrapozitif su iyonu olarak [Th(H
2O)
9]4+ oluşur, üç başlıklı trigonal prizmatik moleküler geometriye sahiptir:[4][41] pH<3 değerinde, toryum tuzlarının çözeltilerine bu katyon hakimdir.[4] Th4+ iyonu, tetrapozitif aktinit iyonlarının en büyüğüdür ve koordinasyon sayısına bağlı olarak 0,95 ile1.14A arasında bir yarıçapa sahip olabilir.[4]
Yüksek yükü nedeniyle oldukça asidiktir, asidik ortamda hidroliz ve polimerizasyona maruz kalma eğilimindedir. Ağırlıklı olarak [Th
2(OH)
2]6+. Ancak daha alkali çözeltilerde polimerizasyon jelatinimsi hidroksit oluşana kadar devam eder, Th(OH)
4 oluşur ve çökelir (dengeye ulaşılması haftalar alabilir, çünkü polimerizasyon genellikle çökelmeden önce yavaşlar).[33]
Sert bir Lewis asidi olarak,Th4+ donör olarak oksijen atomlu sert ligandları destekler: donör olarak kükürt atomlu kompleksler daha az kararlıdır ve hidrolize daha yatkındır.[30]
Büyük boyutundan dolayı toryum için yüksek koordinasyon sayıları kuraldır. Toryum nitrat pentahidrat 11 numaralı koordinasyonun bilinen ilk örneğiydi. Oksalat tetrahidrat 10, borohidrit (ilk olarak Manhattan Projesinde hazırlanan) 14 numaralı koordinasyona sahipti.[33] Bu toryum tuzları, su ve polar organik çözücülerde yüksek çözünürlükleriyle bilinir.[6]
Perklorat, sülfat, sülfit, nitrat, karbonat, fosfat, vanadat, molibdat ve kromatlar gibi çok atomlu anyonlara sahip diğer birçok inorganik toryum bileşiği ve bunların hidratlı biçimleri bilinmektedir.[4] Toryumun saflaştırılmasın ve nükleer atıkların bertaraf edilmesinde önemlidirler, ancak çoğu, yapısal özellikleri açısından henüz tam olarak karakterize edilmemiştir.[4] Örneğin, toryum nitrat, toryum hidroksitin nitrik asitle reaksiyona sokulmasıyla üretilir: su ve alkollerde çözünür ve toryum ve bileşiklerinin saflaştırılmasında önemli bir ara maddedir.[4] Oksalat, sitrat ve EDTA gibi organik ligandlara sahip toryum kompleksleri çok daha kararlıdır. Doğal toryum içeren sularda, organik toryum kompleksleri, inorganik ligandların konsantrasyonları organik ligandlarınkinden çok daha yüksek olduğunda bile, genellikle inorganik komplekslerden daha yüksek konsantrasyonlarda meydana gelir. [4]

-C
8H
8)ThCl
2(THF)
2
Ocak 2021'de, merkezi bir toryum katyonu ile stabilize edilmiş 12 bizmut atomundan oluşan büyük bir metal kümesi anyonunda aromatiklik gözlemlendi.[42] Daha önce bilinen pek çok aromatik metal kümesinin aksine, bu bileşiğin şaşırtıcı şekilde kararlı olduğu gösterildi.
Organik bileşikleri
[değiştir | kaynağı değiştir]Organotoryum bileşikleri üzerine yapılan çalışmaların çoğu, siklopentadienil kompleksleri ve siklooktatetraenillere odaklanmıştır. Erken ve orta aktinitlerin çoğu gibi (Amerikyum ve Küriyum için de bekleniyor), toryum bir siklooktatetraenit kompleksi oluşturur: sarı Th(C
8H
8)
2, torosen. Daha iyi bilinen uranyum bileşiği uranosen ile izotipiktir.[4] K2C8H8'in kuru buz sıcaklığında tetrahidrofuran (THF) içinde toryum tetraklorür ile reaksiyona sokulmasıyla veya toryum tetraflorürün MgC8H8 ile reaksiyona sokulmasıyla hazırlanabilir.[4] Havada kararsızdır ve suda veya 190 °C'de bozunur.[4] Yarım sandviç bileşikleri de bilinmektedir, örneğin(η8
-C
8H
8)ThCl
2(THF)
2, piyano-tabure yapısına sahip olan ve torosenin tetrahidrofuran içinde toryum tetraklorür ile reaksiyona sokulmasıyla yapılır.[30]
Siklopentadienillerin en basitleri Th(C
5H
5)
3 veTh(C
5H
5)
4 dir ve birçok türevleri bilinmektedir. Birincisinin biri mor diğeri yeşil olmak üzere iki formu vardır, resmi +3 oksidasyon durumundaki nadir bir toryum örneğidir;[33] bir türevde resmi bir +2 oksidasyon durumu oluşur.[43] Klorür türevi [Th(C
5H
5)
3Cl] toryum tetraklorürün sınırlandırırıcı KC
5H
5 (diğer tek değerlikli metal siklopentadieniller de kullanılabilir)ile ısıtılmasıyla hazırlanır. Alkil ve aril türevleri, klorür türevinden hazırlanır ve Th–C sigma bağının doğasını incelemek için kullanılmıştır.[33]
Diğer organotoryum bileşikleri iyi çalışılmamıştır. Tetrabenziltoryum,Th(CH
2C
6H
5)
4 ve tetraalliltoryum,Th(CH
2CH=CH
2)
4, bilinmekte, ancak yapıları belirlenmemiştir. Oda sıcaklığında yavaşça bozunurlar. Toryum, heptametiltorat(IV)[Li(tmeda)]
3[Th(CH
3)
7] (tmeda =(CH
3)
2NCH
2CH
2N(CH
3)
2 ) tuzu oluşturan tek başlıklı trigonal prizmatik anyon [Th(CH
3)
7]3− oluşturur.
Toryum atomuna yalnızca bir metil grubu bağlı olmasına rağmen (Th–C mesafesi 257.1pm) ve diğer altısı lityum ve toryum atomlarını birbirine bağlar (Th–C mesafeleri 265,5–276,5pm), çözeltide eşdeğer davranırlar. Tetrametiltoryum,Th(CH
3)
4 bilinmemekle birlikte, adüktleri fosfin ligandları ile stabilize edilir.[30]
Varoluşu
[değiştir | kaynağı değiştir]Oluşum
[değiştir | kaynağı değiştir]232Th, on milyar yıldan fazla bir süredir mevcut haliyle var olan ilkel bir çekirdektir; muhtemelen süpernova ve nötron yıldızı birleşmelerinde meydana gelen r-süreci sırasında oluşmuştur. Bu şiddetli olaylar onu galaksiye dağıttı.[44][45] "r" harfi, "hızlı nötron yakalama" anlamına gelir ve 56Fe gibi ağır tohum çekirdeklerinin, nötron damlama hattına karşı koşarak hızla nötronları yakaladığı çekirdek çökmesi süpernovalarında meydana gelir. Nüklidler kararlılığa doğru geri bozunabilir. Nötron yakalama, yüksek atom sayılarında yüklü parçacıklar arasındaki etkileşimleri zorlaştıran artan Coulomb engelleri ve 56Fe'nin ötesindeki füzyonun endotermik olması gerçeği nedeniyle yıldızların demirin ötesinde elementleri sentezlemesinin tek yoludur.[46] 209Bi'yi geçen ani stabilite kaybı nedeniyle, r-süreci toryum ve uranyum yaratabilen tek yıldız nükleosentezi sürecidir; diğer tüm işlemler çok yavaştır ve ara çekirdek alfa, bu elementlere ulaşmak için yeterli nötronları yakalamadan önce bozunur.[44][47][48]
Evrende toryum, yalnızca r-işleminde üretilebilen iki elementten biri (diğeri uranyum) olduğu ve ayrıca oluştuğu andan başlayarak yavaş yavaş bozunduğu için ilkel elementler arasında en nadir bulunanlar arasındadır. Toryumdan daha nadir olan diğer ilkel elementler tulyum, lutetium, tantal ve renyumdur, ağır platin grubu metallerin yanı sıra uranyum etrafındaki r-işlem bolluklarının üçüncü zirvesinden hemen önceki tek sayılı elementler.[44][46][e] Uzak geçmişte, toryum ve uranyum bolluğu, plütonyum ve küryum izotoplarının bozunmasıyla (236U'dan 232Th'ye bozunarak) gerçekleşir. 235U'nun doğal tükenmesi nedeniyle bu kaynaklar çoktan bitti ve artık katkıda bulunmuyor.[34]
Yerkabuğunda toryum çok daha fazladır: 8.1 g/ ton, ağır elementlerin en bol bulunanlarından biridir; kalaydan daha bol (2.1g/ton) ve kurşuna (13g/ton) yakın.[33] Bunun nedeni, toryumun muhtemelen çekirdeğe batmayan oksit mineralleri oluşturmasıdır; Goldschmidt sınıflandırması altında litofil olarak sınıflandırılır, yani genellikle oksijenle birlikte bulunur. Yaygın toryum bileşikleri de suda az çözünür. Bu nedenle, refrakter elementler, Dünya'da bir bütün olarak Güneş Sistemindeki ile aynı nispi bolluğa sahip olsa da, kabukta ağır platin grubu metallerden daha erişilebilir toryum vardır.[49]

Yeryüzünde
[değiştir | kaynağı değiştir]Toryum, yer kabuğunda en çok bulunan 41. elementtir. Doğal toryum genellikle, toryumun en uzun ömürlü ve en kararlı izotopu olan evrenin yaşıyla karşılaştırılabilir bir yarı ömre sahip neredeyse saf 232Th'dir.[4] Radyoaktif bozunması, Dünya'nın iç ısısına en çok katkıda bulunandır; diğer önemli katkıda bulunanlar, katkılarının azalan sırasına göre 238U, 40K ve 235U daha kısa ömürlü ilkel radyonüklidlerdir. (Dünya'nın oluşumu sırasında, 40K ve 235U, kısa yarı ömürleri nedeniyle çok daha fazla katkıda bulundular, ancak daha hızlı bozundular ve 232Th ve 238U'nun katkısını baskın bıraktılar.)[54] Çürümesi, Dünya'nın toryum içeriğinin kademeli olarak azalmasına neden olur: gezegen şu anda Dünya'nın oluşumunda mevcut olan miktarın yaklaşık %85'ine sahiptir.[39] Diğer doğal toryum izotopları çok daha kısa ömürlüdür; bunlardan yalnızca 230Th genellikle tespit edilebilir, ebeveyni 238U ile bir denge içindedir ve doğal toryumun en fazla %0,04'ünü oluşturur.[4][f]
Toryum, çoğu mineralin küçük bir bileşeni olarak bulunur ve bu nedenle daha önce nadir olduğu düşünülürdü.[4][57] Doğada +4 olarak uranyum(IV), zirkonyum(IV), hafniyum(IV) ve seryum(IV) ve ayrıca skandiyum, itriyum ile ve benzer iyonik yarıçaplara sahip üç değerlikli lantanitlerle birlikte bulunur.[4] Toryumun radyoaktivitesi nedeniyle, onu içeren mineraller genellikle metamiktir (amorf), kristal yapıları toryum tarafından üretilen alfa radyasyonu tarafından zarar görmüştür.[58] Ekstrem bir örnek ekanittir,(Ca,Fe,Pb)
2(Th,U)Si
8O
20, içerdiği toryum nedeniyle metamik olmayan formda neredeyse hiç oluşmaz.[59]
Monazit (temel olarak çeşitli nadir toprak elementlerinin fosfatlarıdır), dünya çapında, özellikle Hindistan, Güney Afrika, Brezilya, Avustralya ve Malezya'da büyük yataklarda bulunur ve en önemli ticari toryum kaynağıdır; Ortalama %2,5 civarında toryum içerir, ancak bazı birikintiler %20'ye kadar toryum içerebilir.[33] Monazit, sarı veya kahverengi kum olarak bulunan, kimyasal olarak reaktif olmayan bir mineraldir; düşük reaktivitesi, toryumun ondan çıkarılmasını zorlaştırır.[4] Alanit (başlıca çeşitli metallerin silikat-hidroksitleri) %0.1-2 toryum ve zirkon (başlıca zirkonyum silikat, ZrSiO
4 ) %0,4'e kadar toryum içerir.[4]
Toryum dioksit nadir mineral torianit olarak ortaya çıkar. Uranyum dioksit ile izotipik olması nedeniyle bu iki yaygın aktinit dioksit katı hal çözeltileri oluşturabilir ve mineralin adı ThO
2 içeriğine göre değişir.[g] Torit (esas olarak toryum silikat,ThSiO
4), toryum içeriği de yüksektir ve toryumun ilk keşfedildiği mineraldir.[4] Toryum silikat minerallerinde,Th4+ ve SiO4−
4 iyonları genellikle M3+ (burada M = Sc, Y veya Ln) ve sırasıyla fosfat (PO3−
4 ) iyonları ile değiştirilir.[4] Toryum dioksitin yüksek çözünmezliği nedeniyle, toryum salındığında çevrede hızlı bir şekilde yayılmaz. İyonu, özellikle asidik topraklarda çözünür ve bu tür koşullarda toryum konsantrasyonu daha yüksek olabilir.[39]
Tarih
[değiştir | kaynağı değiştir]
Hatalı rapor
[değiştir | kaynağı değiştir]1815'te İsveçli kimyager Jöns Jacob Berzelius, İsveç'in merkezindeki Falun'daki bir bakır madeninden alışılmadık bir gadolinit örneğini analiz etti. Bilinmeyen bir elementin toprağı (modern kimyasal terminolojide oksit ) olduğunu ihtiyatla varsaydığı beyaz bir mineralin emprenye edilmiş izlerini fark etti. Berzelius seryum ve selenyumu keşfetmiş, ancak yeni element gahnium'un çinko oksit olduğunu açıklamakla halka açık bir hata yapmıştı.[62] Berzelius, 1817'de varsayılan elemente "toryum" [63] sonra sözde oksitine de İskandinav gök gürültüsü tanrısı Thor'dan esinlenerek "thorina" adını verdi.[64] 1824'te, Norveç'in Vest-Agder kentinde aynı mineralin daha fazla yatağı keşfedilerek mineralin (daha sonra xenotime olarak adlandırıldı) çoğunlukla itriyum ortofosfat olduğu kanıtlandığı için bulgularını geri çekti.[4][62][65][66]
Keşif
[değiştir | kaynağı değiştir]1828'de Papaz olarak görev yaptığı yerde mineralleri inceleyen Norveçli bir rahip ve amatör bir mineralog olan Morten Thrane Esmark, Norveç'in Telemark ilçesindeki Løvøya adasında siyah bir mineral buldu. Bunun gibi en ilginç örnekleri, Christiania'daki Royal Frederick Üniversitesi'nde (bugün Oslo olarak anılır) tanınmış bir mineralog ve jeoloji profesörü olan babası Jens Esmark'a sık sık gönderirdi.[67] Yaşlı Esmark, bunun bilinen bir mineral olmadığını anladı ve incelemesi için Berzelius'a bir örnek gönderdi. Berzelius, bunun yeni bir element içerdiğini belirledi.[4] Bulgularını 1829'da yayınlayarak, saf olmayan bir örneği indirgeyerek izole etti. K[ThF
5] (potasyum pentaflorotorat(IV))ü Potasyum metali ile indirgemişti.[68][69][70] Berzelius, önceki sözde element keşfinin[68][71] adını yeniden kullandı ve kaynak minerali torit olarak adlandırdı.[4]

Berzelius, yeni metalin ve kimyasal bileşiklerinin bazı karakterizasyonlarını yaptı: toryum oksidin toryum-oksijen kütle oranının 7,5 olduğunu doğruya yakın bir şekilde (gerçek değeri ~7,3) belirledi, ancak yeni elementin dört değerlikli değil iki değerli olduğunu ve atom kütlesinin oksijenin 7.5 katı olduğu hesapladı; aslında 15 kat daha büyüktü. (120 amu )[h] Toryumun çok elektropozitif bir metal olduğunu, elektropozitiflikte seryumun önünde ve zirkonyumun arkasında olduğunu belirledi.[72] Metalik toryum ilk kez 1914 yılında Hollandalı girişimciler Dirk Lely Jr. ve Lodewijk Hamburger tarafından izole edildi.[i]
İlk sınıflandırma
[değiştir | kaynağı değiştir]Dmitri Mendeleyev'in 1869'da yayınladığı periyodik tabloda toryum ve nadir toprak elementleri, toprak alkali metallerden sonra her dikey periyodun sonunda tablonun ana gövdesinin dışına yerleştirildi. Bu, o zamanlar toryum ve nadir toprak metallerinin iki değerlikli olduğu inancını yansıtıyordu. Nadir toprak elementlerinin çoğunlukla üç değerlikli ve toryumun dört değerlikli olduğunun fark edilmesiyle Mendeleyev, 1871'de seryum ve toryumu maksimum +4 oksidasyonları nedeniyle modern karbon (grup 14) ve titanyum gruplarını (grup 4) içeren grup IV'e taşıdı.[75][76] Seryum kısa süre sonra tablonun ana gövdesinden çıkarıldı ve ayrı bir lantanit serisine yerleştirildi; toryum, titanyum ve zirkonyum gibi daha hafif olduğu varsayılan türdeşleriyle benzer özelliklere sahip olduğu için grup 4'te kaldı.[77][j]
İlk kullanımlar
[değiştir | kaynağı değiştir]
Toryumun ilk kullanımı 1885'te, Avusturyalı kimyager Carl Auer von Welsbach'ın gazlı yakıtlar yakılarak ısıtıldığında toryum oksidin akkorluğundan ışık üreten taşınabilir bir ışık kaynağı olan gaz mantosunu icat ettiği zamana dayanmaktadır.[4] Daha sonra toryum ve bileşikleri için seramikler, karbon ark lambaları, ısıya dayanıklı potalar ve amonyağın nitrik aside oksidasyonu gibi endüstriyel kimyasal reaksiyonlar için katalizörler gibi birçok uygulama alanı bulundu.[4]
Radyoaktivite
[değiştir | kaynağı değiştir]Toryumun radyoaktif olduğu ilk kez 1898'de Alman kimyager Gerhard Carl Schmidt ve ardından Polonyalı-Fransız fizikçi Marie Curie tarafından bağımsız olarak gözlemlendi. Fransız fizikçi Henri Becquerel tarafından 1896'da uranyumdaki radyoaktivitenin keşfinden sonra, radyoaktif olduğu bulunan ikinci elementti.[78][79][80] 1899'dan başlayarak Yeni Zelandalı fizikçi Ernest Rutherford ve Amerikalı elektrik mühendisi Robert Bowie Owens toryumdan gelen radyasyonu incelediler; ilk gözlemler bunun önemli ölçüde değiştiğini gösterdi. Varyasyonların yeni bir element olarak buldukları toryumun kısa ömürlü gaz halindeki bir kızından geldiği belirlendi. Doğada toryumun kızı olarak keşfedilen nadir elementlerden biri olan bu elemente radondur.[81]
İngiliz fizikçi Frederick Soddy ile birlikte çalışan Rutherford, 1900'-1903'e arası çalışmalarında toryumun zaman içinde sabit bir hızla bir dizi başka elemente bozunmasını gösterdi. Bu gözlem yarı ömrün, radyoaktivitenin parçalanma teorisine yol açan alfa parçacığı deneylerinin sonuçlarından biri olarak tanımlanmasına yol açtı.[82] Radyasyonun biyolojik etkisi 1903 yılında keşfedildi.[83] Yeni keşfedilen radyoaktivite fenomeni hem bilim insanlarını hem de halkı heyecanlandırdı. 1920'lerde toryumun radyoaktivitesi romatizma, diyabet ve cinsel iktidarsızlık için tedavi olarak tanıtıldı. 1932'de, bu kullanımların çoğu, radyoaktivitenin sağlık üzerindeki etkilerine yönelik federal bir soruşturmanın ardından Amerika Birleşik Devletleri'nde yasaklandı.[84] Amerika Birleşik Devletleri'nde 10.000 kişiye X-ışını teşhisi sırasında toryum enjekte edildi; daha sonra lösemi ve anormal kromozomlar gibi sağlık sorunlarından muzdarip oldukları bulundu.[39] Halkın radyoaktiviteye olan ilgisi 1930'ların sonunda azaldı.[84]

İleri sınıflandırma
[değiştir | kaynağı değiştir]19. yüzyılın sonlarına kadar kimyagerler, toryum ve uranyumun sırasıyla grup 4 ve grup 6'nın en ağır üyeleri olduğu konusunda hemfikirdi; altıncı sıradaki lantanitlerin tekil bir tesadüf kabul edildi. Henry Bassett,1892'de toryum ve uranyumun lantanitlere benzer olduğunu düşünerek, bilinen ve keşfedilmemiş elementleri barındıran ikinci bir ekstra uzun periyodik tablo sırasını öne sürdü. 1913'te Niels Bohr atom ve elektron orbitallerinin kısa sürede geniş kabul gören teorik bir modelini yayınladı.[75] Aktinitler biçiminde ikinci bir iç geçiş serisinin varlığı, lantanitlerin elektron yapılarıyla benzerlikler kurulana kadar kabul edilmedi;[85] Bohr, 5f orbitallerinin doldurulmasının uranyum sonrasına ertelenebileceğini öne sürdü.[75]
Ancak plütonyumdan itibaren lantanitler gibi baskın +3 ve +4 oksidasyon durumlarına sahip olan ilk transuranik elementlerin keşfedilmesiyle, aktinitlerin aslında d-orbitallerden ziyade f-orbitalleri doldurduğu fark edildi.[86] 1945'te Amerikalı fizikçi Glenn T. Seaborg ve ekibi transuranik elementler amerikyum ve Küriyum'u keşfettiklerinde aktinit kavramını önerdi ve toryumun lantanitlere benzer bir f-blok aktinit serisinin ikinci üyesi olduğunu fark etti.[77] [k]
Dışlanma
[değiştir | kaynağı değiştir]1990'larda, güvenlik ve çevresel kaygılar nedeniyle toryumun radyoaktivitesine bağlı olmayan çoğu uygulama, daha güvenli ikameler bulunduğundan hızla azaldı.[4][89] Amerika Birleşik Devletleri'ndeki Oak Ridge Ulusal Laboratuvarı tarafından 1981 yılında yapılan bir araştırma, her hafta sonu bir toryum gazı mantosu kullanmanın bir kişi için güvenli olacağını[89] ancak bunun mantoları üreten bazı fabrika insanları veya fabrika sahalarının etrafındaki topraklar için geçerli olamayacağını belirtti.[90] Bazı üreticiler, itriyum gibi başka malzemelere geçiş yaptı.[91] 2007 gibi yakın bir tarihte, bazı şirketler radyoaktiviteleri hakkında yeterli bilgi vermeden toryum mantoları üretme ve satmaya devam ettiler, hatta bazıları bunların radyoaktif olmadığını iddia etti.[89][92]
Nükleer enerji
[değiştir | kaynağı değiştir]
Toryum, prototip ölçekte bir güç kaynağı olarak kullanılmıştır. İlk toryum bazlı reaktör, 1962'de ABD New York, Buchanan'da bulunan Indian Point Energy Center'da inşa edildi.[93] Çin, teknolojiyi ticarileştirme şansına sahip olan ilk ülke olabilir.[94] Dünyada tahmini en büyük toryum rezervine sahip ülke, seyrek uranyum rezervlerine sahip olan Hindistan'dır. 1950'lerde Hindistan, üç aşamalı nükleer enerji programıyla enerji bağımsızlığını sağlamayı hedefledi.[95][96] Çoğu ülkede uranyum nispeten bol ve toryuma dayalı reaktörlerin gelişimi yavaştı; 20. yüzyılda Hindistan'da üç ve başka yerlerde on iki reaktör inşa edildi.[97] 1996 da Uluslararası Atom Enerjisi Ajansı, bir yıl sonra da Amerika Birleşik Devletleri Enerji Bakanlığı toryum reaktörlerinin kullanımını incelemek için araştırmalar başlattı. İsrail'deki Tel Aviv Üniversitesi'nden Alvin Radkowsky, toryum üreten ilk Amerikan sivil reaktörü olan Pennsylvania'daki Shippingport Atom Santrali'nin baş tasarımcısıydı.[98] Toryum reaktörlerini geliştirmek için diğer laboratuvarları da içeren bir konsorsiyum kurdu.(ABD'de Raytheon Nuclear Inc. ve Brookhaven Ulusal Laboratuvarı ve Rusya'da Kurchatov Enstitüsü)[99]
Toryumun nükleer yayılmayı azaltma potansiyeli ve atık özellikleri, toryum yakıt döngüsüne olan ilginin 21. yüzyılda, yeniden canlanmasına yol açtı.[100][101][102] Hindistan, 2050 yılına kadar elektrik ihtiyacının %30'unu toryum bazlı nükleer enerji ile karşılamayı öngörüyor. Şubat 2014'te, Hindistan'ın Mumbai kentinde bulunan Bhabha Atom Araştırma Merkezi (BARC), yakıt cevheri olarak toryumu yakan bir "yeni nesil nükleer reaktör" için son tasarımlarını sundu ve buna Gelişmiş Ağır Su Reaktörü (AHWR) adını verdi. 2009'da Hindistan Atom Enerjisi Komisyonu başkanı, Hindistan'ın "geniş toryum kaynaklarına dayalı olarak enerjiden bağımsız olma konusunda uzun vadeli bir hedefi" olduğunu söyledi.
Nükleer silahlar
[değiştir | kaynağı değiştir]Manhattan Projesinde gram miktarlarında plütonyum ilk kez üretildiğinde, küçük bir izotopun (240Pu) önemli ölçüde kendiliğinden fisyona uğradığı keşfedildi, bu da plütonyum yakıtlı tabanca tipi bir nükleer silahın yaşayabilirliğini gündeme taşıdı. Los Alamos ekibi nükleer silah, Chicago ekibi reaktör tasarım çözümleri üzerinde çalıştı. Eugene Wigner, özel bir dönüştürücü reaktörde toryumun 233U'ya dönüştürülmesini sağlamak için 240Pu ile kirlenmiş plütonyumun kullanılmasını önerdi. 232U'dan kaynaklanan kontaminasyonla ilgili endişeler dile getirilse de, 233U'nun silahta kullanılabileceği varsayıldı. Silahdaki ilerleme yeterliydi ve daha fazla geliştirilmedi, ancak tasarımın nükleer enerjinin gelişimi üzerinde muazzam bir etkisi oldu. Gelecekteki deniz ve ticari güç reaktörlerine benzer, oldukça zenginleştirilmiş, su soğutmalı, su kontrollü bir reaktörün ilk ayrıntılı açıklamasıydı.[103]
Soğuk Savaş sırasında ABD, 232Th'yi bir nükleer bombada kullanılmak üzere 233U kaynağı olarak kullanma olasılığını araştırdı; 1955'te bir deneme bombası ateşlediler.[104] 233U-ateşli bir bombanın çok güçlü bir silah olacağı sonucuna vardılar, ancak çağdaş uranyum-plütonyum bombalarına göre çok az "teknik avantaj" taşıyordu,[105] özellikle 233U'nun izotopik olarak saf formda üretilmesi zordu.[104]
Amerika Birleşik Devletleri tarafından (W71) konuşlandırılan en az bir nükleer silahın tasarımında radyasyon durumunda toryum metali kullanıldı.[106]
Üretim
[değiştir | kaynağı değiştir]| Ülke | rezervler |
|---|---|
| Hindistan | 1070 |
| Brezilya | 632 |
| Avustralya | 595 |
| Amerika Birleşik Devletleri | 595 |
| Mısır | 380 |
| Türkiye | 374 |
| Venezuela | 300 |
| Kanada | 172 |
| Rusya | 155 |
| Güney Afrika | 148 |
| Çin | 100 |
| Norveç | 87 |
| Grönland | 86 |
| Finlandiya | 60.5 |
| İsveç | 50 |
| Kazakistan | 50 |
| Diğer ülkeler | 1.725 |
| Dünya toplamı | 6579.5 |
Düşük talep, toryumun tek başına çıkarıldığı madenleri karsız hale getiriyor ve neredeyse her zaman, diğer minerallerin üretiminin yan ürünleri olabilecek nadir toprak elementleriyle çıkarılıyor.[34] Üretim için monazite olan mevcut güven, toryumun büyük ölçüde bir yan ürün olarak üretilmesinden kaynaklanmaktadır; torit gibi diğer kaynaklar daha fazla toryum içerir ve talep artarsa üretim için kolaylıkla kullanılabilir.[107] Düşük talep, arama çabalarının nispeten küçük olmasına yol açtığından, toryum kaynaklarının dağılımına ilişkin mevcut bilgiler zayıftır.[108] 2014 yılında toryumun çıkarılacağı monazit konsantresinin dünya üretimi 2.700 ton idi[109]
Toryumun ortak üretim yolu, toryumun minerallerinden ekstraksiyonu, saflaştırılması; ve (isteğe bağlı olarak) toryum dioksit gibi bileşiklere dönüştürme işlemlerini kapsar.[34]
Konsantrasyon
[değiştir | kaynağı değiştir]Toryum eldesinde kullanılabilecek mineraller iki çeşittir: Birincil birikintiler asidik granitik magmalarda ve pegmatitlerde meydana gelir. Konsantredirler, ancak küçük boyutludurlar. İkincil birikintiler, granitik dağlık bölgelerdeki nehir ağızlarında oluşur. Bu yataklarda toryum diğer ağır minerallerle birlikte zenginleşir.[34] İlk konsantrasyon, birikinti türüne göre değişir.[34]
Birincil yataklarda elde edilen pegmatitler küçük parçalara bölünür ve flotasyona tabi tutulur. Alkali toprak metal karbonatlar, hidrojen klorür ile reaksiyondan sonra çıkarılabilir; daha sonra koyulaştırma, süzme ve kalsinasyon gelir. Sonuç, %90'a kadar nadir toprak içeriğine sahip bir konsantredir.[34] İkincil malzemeler (kıyı kumları gibi) yerçekimi ayrımına tabi tutulur. Manyetik ayırma, artan güçteki bir dizi mıknatısla devam eder. Bu yöntemle elde edilen monazit, %98'e kadar saf olabilir.[34]
20. yüzyıldaki endüstriyel üretim, sonraki adımlarda olduğu gibi, dökme demir kaplarda sıcak, konsantre sülfürik asitle işleme, seyreltme ve seçici çökeltmeye dayanıyordu. Bu yönteme birçok alternatif önerilmiştir, ancak yalnızca birinin ekonomik olarak etkili olduğu kanıtlanmıştır: sıcak sodyum hidroksit çözeltisi ile alkali sindirim. Bu, orijinal yöntemden daha pahalıdır, ancak daha yüksek bir toryum saflığı sağlar ve konsantreden fosfatları uzaklaştırır.[34]
Asit sindirimi
[değiştir | kaynağı değiştir]Asit sindirimi, 210–230 °C'de %93'e kadar sülfürik asit kullanımını içeren iki aşamalı bir işlemdir. İlk olarak, kum kütlesinin %60'ını aşan sülfürik asit ilave edilerek koyu karışımda ürün elde edilir. Sonra sülfürik asitle seyreltilerek çözelti beş saat daha aynı sıcaklıkta tutulur. Sülfürik asidin konsantrasyonu, reaksiyon hızı ve viskoziteye göredir. Sıcaklığın artırılması da reaksiyonu hızlandırır, ancak sıcaklıklar 300 °C'dir ve üzeri sıcaklıklardan kaçınılmalıdır, çünkü çözünmez toryum pirofosfat oluşumuna neden olurlar. Çözünme çok ekzotermik olduğundan, monazit kumu aside çok hızlı bir şekilde eklenemez. Tersine, 200 °C'nin altındaki sıcaklıklarda reaksiyon yeterince hızlı gitmez. Reaktif monazit yüzeyini bloke edecek hiçbir çökelti oluşmadığından emin olmak için kullanılan asit kütlesi, stokiyometriden beklenen %60 yerine kumun iki katı olmalıdır. Karışım daha sonra 70 °C'ye soğutulur ve hacminin on katı seyreltilir, böylece kalan monazit dibe çökerken nadir toprak elementleri ve toryum çözelti halinde kalır. Toryum daha sonra pH'1.3, ta fosfat olarak çökeltilerek ayrılabilir, nadir toprak elementleri pH'2'ye kadar çökelmez.[34]
Alkali sindirim
[değiştir | kaynağı değiştir]Alkali sindirim, yaklaşık 140 °C'de %30-45'lik sodyum hidroksit çözeltisinde yaklaşık üç saatte gerçekleşir. Yüksek sıcaklık az çözünür toryum oksit ve süzüntüde fazla miktarda uranyuma, düşük alkali yavaş reaksiyona yol açar. Bu reaksiyon koşulları oldukça yumuşaktır ve partikül boyutu 45'mikron altında olan monazit kumu gerektirir. Filtrelemenin ardından filtre keki, hidroksitleri olarak toryum ve nadir toprakları, sodyum diuranat olarak uranyum ve trisodyum fosfat olarak fosfat içerir. Bu, 60 °C'nin altına soğutulduğunda trisodyum fosfat dekahidratı kristalleştirir Bu üründeki uranyum safsızlıkları, reaksiyon karışımındaki silikon dioksit miktarı ile artar ve ticari kullanımdan önce yeniden kristalleştirmeyi gerektirir. Hidroksitler 80 °C'de %37 hidroklorik asit içinde çözülür. Kalan çökeltilerin süzülmesi ve ardından %47 sodyum hidroksit eklenmesi, toryum ve uranyumun yaklaşık 5.8 pH'ta çökelmesine neden olur. Hava seryumu +3'ten +4 oksidasyon durumuna oksitleyebileceğinden ve oluşan seryum (IV) hidroklorik asitten serbest kloru serbest bırakabileceğinden, çökeltinin tamamen kurumasından kaçınılmalıdır. Nadir toprak elementleri daha yüksek pH değerlerinde tekrar çökelir. Çökeltiler, orijinal sodyum hidroksit çözeltisi ile nötralize edilir, ancak nadir toprak fosfatlarının çökelmesini önlemek için önce fosfatın çıkarılması gerekir. Solvent ekstraksiyonu, elde edilen filtre kekini nitrik asit içinde çözerek toryum ve uranyumun ayrılması için de kullanılabilir. Titanyum hidroksitin varlığı, toryumu bağladığı ve tamamen çözünmesini engellediği için zararlıdır.[34]
Arıtma
[değiştir | kaynağı değiştir]Nükleer uygulamalar yüksek konsantrasyonlara ihtiyaç duyar ve özellikle, yüksek nötron yakalama kesitlerine sahip (ör.gadolinyum ağırlıkça milyonda birden daha düşük olmalıdır) atomların konsantrasyonları çok düşük olmalıdır. Önceden, yüksek saflık elde etmek için tekrarlanan çözünme ve yeniden kristalleştirme kullanılıyordu. Günümüzde, seçici kompleksleştirmeyi içeren sıvı çözücü ekstraksiyon prosedürleri kullanılır. Örneğin, alkalin sindirimi ve fosfatın uzaklaştırılmasının ardından, ortaya çıkan toryum, uranyum ve nadir toprakların nitro kompleksleri, kerosende tributil fosfat ile ekstraksiyon yoluyla ayrılabilir.[34]
Modern uygulamalar
[değiştir | kaynağı değiştir]Toryumun radyoaktivite ile ilgili olmayan kullanımları, büyük ölçüde toryumun radyoaktivitesinden ve bozunma ürünlerinden kaynaklanan çevresel kaygılar nedeniyle 1950'lerden beri düşüştedir.[4][89]
Çoğu toryum uygulaması, metal yerine dioksitini (sektörde bazen "torya" olarak adlandırılır) kullanır. Bu bileşik 3300 °C (6000 °F), erime noktasıyla bilinen tüm oksitlerin en yükseğine, sadece birkaç madde daha yüksek erime noktalarına sahiptir.[39] Bu, bileşiğin alevde katı kalmasına yardımcı olur ve alevin parlaklığını önemli ölçüde artırır; toryumun gaz lambası mantolarında kullanılmasının ana nedeni budur.[34] Tüm maddeler yüksek sıcaklıklarda enerji (parıltı) yayar, ancak toryum tarafından yayılan ışığın neredeyse tamamı görünür spektrumdadır, dolayısıyla toryum örtülerinin parlaklığı budur.[40]
Toryum katot ışını, ısı veya ultraviyole ışık gibi bir enerji kaynağına maruz kaldığında görünür ışık şeklinde enerji yayar. Bu etki, ultraviyole ışığı daha verimli bir şekilde görünür ışığa dönüştüren seryum dioksit tarafından da paylaşılır, ancak toryum dioksit daha az kızılötesi ışıkla daha yüksek bir alev sıcaklığı verir.[34]
Mantolardaki toryum, 1990'ların sonlarından bu yana kademeli olarak itriyum ile değiştirilmiştir.[110] Birleşik Krallık Ulusal Radyolojik Koruma Kurulunun 2005 tarihli incelemesine göre, "[horiated gaz örtüleri] birkaç yıl önce yaygın olarak bulunsa da, artık yoklar."[111] Toryum ayrıca sözde bilimsel sağlık bileziklerinde olduğu gibi ucuz kalıcı negatif iyon jeneratörleri yapmak için de kullanılır.[112]
Akkor filamentlerin üretimi sırasında, filamentler çekilmeden önce sinterleme tozuna küçük miktarlarda toryum dioksit eklenerek tungstenin kristalleşmesi önemli ölçüde azaltılır.[34] Bir toryum yüzeyinden gelen iş fonksiyonu, muhtemelen toryumun daha büyük elektropozitifliği nedeniyle oluşan toryum ve tungsten arasındaki arayüzdeki elektrik alan nedeniyle düşer.[113] (Tungsten katotlara küçük bir toryum ilavesi, elektronların oldukça düşük sıcaklıklarda yayılmasını sağlar.[4]) Toryum, tungsten yüzeyinde bir atom kalınlığında bir tabaka oluşturur. 1920'lerden bu yana, elektronik ve X-ışını tüpleri ve doğrultucuların katotları ve antikotlarında torili tungsten teller kullanılmıştır. Toryumun atmosferik oksijen ve nitrojen ile reaktivitesi sayesinde, toryum ayrıca boşaltılan tüplerdeki safsızlıklar için alıcı görevi görür. 1950'lerde transistörlerin piyasaya sürülmesi, bu kullanımı tamamen olmasa da önemli ölçüde azalttı.[34] Toryum dioksit, gaz tungsten ark kaynağında (GTAW), tungsten elektrotların yüksek sıcaklık dayanımını artırmak ve ark stabilitesini iyileştirmek için kullanılır.[4] Toryum oksit, bu kullanımda zirkonyum, seryum ve lantan gibi diğer oksitlerle değiştirilmektedir.[114][115]
Toryum dioksit, yüksek sıcaklıklı laboratuvar potaları gibi ısıya dayanıklı seramiklerde[4] ya ana bileşen ya da zirkonyum dioksite ek olarak bulunur. %90 platin ve %10 toryum alaşımı, amonyağı azot oksitlere oksitlemek için etkili bir katalizördür. Ancak daha iyi ve dayanıklı %95 platin ve %5 rodyum alaşımı bunun yerini almıştır.[34]

Toryum dioksit cama eklendiğinde camın kırılma indisinin artması ve dağılımın azalmasına yardımcı olur. Bu tür camlar, kameralar ve bilimsel aletler için yüksek kaliteli lenslerde uygulama bulur.[35] Bu lenslerden çıkan radyasyon onları karartabilir, yıllar içerisinde sarartabilir, filmi bozar, ancak sağlık riskleri minimumdur.[116] Sararmış lensler, yoğun ultraviyole radyasyona uzun süre maruz bırakılarak orijinal renksiz durumlarına geri yüklenebilir. Toryum dioksit, benzer etkiler sağladıkları ve radyoaktif olmadıkları için bu uygulamada lantan gibi nadir toprak oksitlerle değiştirilmiştir.[34]
Toryum tetraflorür, çok katmanlı optik kaplamalarda yansıma önleyici bir malzeme olarak kullanılır. 0.350–12 µm dalga boyuna sahip, ultraviyole yakın, görünür ve orta kızılötesi ışığı içeren elektromanyetik dalgalara karşı şeffaftır. Radyasyonu, birincil olarak, başka bir malzemeden ince bir kaplama tabakası tarafından kolayca durdurulabilen alfa parçacıklarından kaynaklanmaktadır.[117] Toryum tetraflorür için ikameler, 2010'lardan itibaren geliştirilmektedir.[118] Bunlara Lantanum triflorür dahildir.
Mag-Thor alaşımları (aynı zamanda thoriated magnezyum olarak da adlandırılır), bazı havacılık uygulamalarında kullanım alanı bulmuş, ancak radyoaktivite konusundaki endişeler nedeniyle aşamalı olarak kaldırılmıştır.
Nükleer enerji için potansiyel kullanım
[değiştir | kaynağı değiştir]Bir reaktördeki ana nükleer güç kaynağı, bir nüklidin nötron kaynaklı fisyonudur; sentetik bölünebilir [lower-alpha 4] çekirdekler 233U ve 239Pu, doğal olarak oluşan nüklidler 232Th ve 238U tarafından nötron yakalanmasından türetilebilir. 235U doğal olarak bulunur ve aynı zamanda bölünebilir.[119][120][l] Toryum yakıt döngüsünde, verimli izotop 232Th, yavaş nötronlar tarafından bombardımana tutulur, nötron yakalanması geçirerek 233Th olur, bu izotop iki ardışık beta bozunumundan geçerek önce <sup id="mwBcE">233</sup>Pa ve ardından bölünebilir 233U oluşur: [4]
- 232Th + 3 n → 233Th + γ + 2 n β−→21.8 dk 233Pa + n β−→27.0 gün 233U α→1.60 × 105 yıl
233U bölünebilir ve 235U veya 239Pu ile aynı şekilde nükleer yakıt olarak kullanılabilir. 233U nükleer fisyona uğradığında, yayılan nötronlar döngüyü sürdürerek 232Th çekirdeğe daha fazla çarpabilir.[4] Bu, 238U'nun 239U olmak üzere nötron yakalamaya maruz kaldığı, betanın önce 239Np'ye ve ardından bölünebilir 239Pu'ya bozunduğu hızlı üretici reaktörlerdeki uranyum yakıt döngüsüne paraleldir.[121]
Avantajlar
[değiştir | kaynağı değiştir]Toryum uranyumdan bol ve dünyanın enerji taleplerini daha uzun süre karşılayabilir.[33] Ergimiş tuz reaktörlerinde verimli malzeme olarak kullanılmaya özellikle uygundur. 232Th, nötronları 238U'dan daha kolay soğurur ve 233U'nun, 235U'dan (%85,5) veya 239Pu'dan (%73,5) daha yüksek bir nötron yakalama olasılığı (%92,0) vardır.[122] Ayrıca, ortalama olarak fizyon sırasında daha fazla nötron salar. [33] 238U ile tek bir nötron yakalama, bölünebilir 239Pu ile birlikte transuranik atık üretir, ancak 232Th, bu atığı yalnızca beş yakalamadan sonra üreterek 237Np oluşturur. Bu yakalama sayısı, 232Th çekirdeğinin %98-99'u için gerçekleşmez çünkü ara ürünler 233U veya 235U fisyona uğrar ve daha az uzun ömürlü transuranik üretilir. Bu nedenle toryum, transuranik oluşumunu en aza indirmek ve plütonyumun yok edilmesini en üst düzeye çıkarmak için karışık oksit yakıtlarda uranyuma potansiyel olarak çekici bir alternatiftir.[123]
Toryum yakıtları daha güvenli ve daha iyi performans gösteren bir reaktör çekirdeği sağlar[4] çünkü toryum dioksit daha yüksek bir erime noktası, daha yüksek termal iletkenlik ve daha düşük bir termal genleşme katsayısına sahiptir. Kimyasal olarak da şu anda yaygın yakıt olan uranyum dioksitten daha kararlıdır; çünkü ikincisi triuranyum oktoksite okside olur (U
3O
8) ve yoğunluk azalır.[97]
Dezavantajları
[değiştir | kaynağı değiştir]Kullanılmış yakıtın yeniden işlenmesi zor ve tehlikelidir, çünkü 232Th ve 233U'nun kızlarının çoğu güçlü gama yayıcılardır.[33] Tüm 233U üretim yöntemleri, 232Th, 233Pa veya 233U'da bir nötron kaybıyla sonuçlanan parazitik nakavt reaksiyonlarından veya doğal ortamda bir safsızlık olan 230Th'nin çift nötron (n,2n) yakalamasından kaynaklanan 232Th safsızlıklarına neden olur.[124] 232U kendi başına özellikle zararlı değildir, ancak güçlü gama yayıcı 208Tl üretmek için hızla bozunur. (232Th aynı bozunma zincirini takip eder, ancak çok daha uzun yarı ömrü, üretilen 208Tl miktarının önemsiz olduğu anlamına gelir.) [34] 232U'nun bu safsızlıkları, 233U'nun tespit edilmesini kolay ve üzerinde çalışılması tehlikeli hale getirir. ayrılmalarının pratik olmaması, bölünebilir malzeme olarak 233U kullanan nükleer çoğalma olasılıklarını sınırlar.[124] 233Pa, 27gün gibi nispeten uzun bir yarı ömre sahiptir. ve nötron yakalama için yüksek bir kesit. Bu nedenle bir nötron zehiridir : yararlı 233U'ya hızla bozunmak yerine, önemli miktarda 233Pa 234U'ya dönüşür ve nötronları tüketerek reaktör verimliliğini düşürür. Bunu önlemek için toryum erimiş tuz reaktörlerinin çalışması sırasında aktif bölgesinden 233Pa çıkarılır, böylece nötron yakalama şansı kalmaz ve sadece 233U'ya bozunur.[125]
Toryum kullanımaına ait avantajların gerçekleştirilebilmesi için 232Th'nin nötronlarla ışınlanması ve işlenmesi gibi uranyum ve plütonyum yakıt döngüsünden daha ileri teknoloji gerektiren alanlara hakimiyet gerekir.[4] Bazıları toryum yakıt döngüsünün düşük ticari uygulanabilirliğinden bahsediyor:[126][127][128] Uluslararası Nükleer Enerji Ajansı, uranyum bol miktarda bulunurken toryum döngüsünün önümüzdeki birkaç on yıl" boyunca devam edebilecek ticari uygunsuzluğunu tahmin ediyor.[129] Toryum yakıt döngüsünde üretilen izotoplar çoğunlukla transuranik değildir, ancak yarı ömrü 32.760 yıl olan 231Pa gibi bazıları hala çok tehlikelidir. ve kullanılmış nükleer yakıtın uzun vadeli radyotoksisitesine önemli bir katkıda bulunur.[125]
Tehlikeler
[değiştir | kaynağı değiştir]
Radyolojik
[değiştir | kaynağı değiştir]Doğal toryum, diğer birçok radyoaktif maddeye kıyasla çok yavaş bozunur ve yayılan alfa radyasyonu insan derisinden geçmez. Sonuç olarak, gaz mantolarında olduğu gibi küçük miktarlarda toryumun işlenmesi güvenli kabul edilir, ancak bu tür öğelerin kullanımı bazı riskler oluşturabilir.[130] Kirlenmiş tozlar gibi bir toryum aerosolüne maruz kalmak akciğer, pankreas ve kan kanseri riskinin artmasına neden olabilir.[130] Toryuma dahili maruz kalma, karaciğer hastalıkları riskinin artmasına neden olur.[131]
232Th'nin bozunma ürünleri, radyum ve radon gibi daha tehlikeli radyonüklitleri içerir. Bu ürünlerin nispeten az bir kısmı toryumun yavaş bozunmasının sonucu olarak oluşmasına rağmen, 232Th'nin radyolojik toksisitesinin uygun bir değerlendirmesi, bazıları tehlikeli gama yayıcıları[132] olan kızlarının katkısını içermelidir.[34] Toryumun tehlikeli kızları, toryum dioksitten çok daha düşük erime noktalarına sahip olduğundan, manto kullanım için her ısıtıldığında buharlaşırlar. Kullanımın ilk saatinde, toryum kızları 224Ra, 228Ra, 212Pb ve 212Bi'nin büyük fraksiyonları salınır.[133] Normal bir kullanıcı tarafından alınan radyasyon çoğu, radyumun solunmasından kaynaklanır ve bu da kullanım başına 0,2 milisieverttir; bir mamogram sırasında alınan dozun yaklaşık üçte biri kadar bir radyasyon dozudur.[134]
Bazı güvenlik kurumları, toryum örtülerin üretimi ve imhası ile ilgili güvenlik endişelerini dile getirir; bir mantodan gelen radyasyon dozu ciddi bir sorun değildir, ancak fabrikalar veya depolama alanlarında bir araya toplanan birçok mantodan gelen radyasyon dozu ciddi bir sorundur.[131]
Biyolojik
[değiştir | kaynağı değiştir]Toryum kokusuz ve tatsızdır.[135] Toryumun kimyasal toksisitesi düşüktür, çünkü toryum ve en yaygın bileşikleri (çoğunlukla dioksit) suda çok az çözünür,[136] vücuda hidroksit olarak girmeden önce çökelir.[34] Bazı toryum bileşikleri, özellikle toryumu vücuda çözünür biçimde taşıyan sitrat gibi güçlü kompleks oluşturucu iyonların varlığında kimyasal olarak orta derecede toksiktir.[34] Toryum içeren bir nesne çiğnenir veya emilirse, toryumun %0,4'ünü ve tehlikeli kızlarının %90'ını vücuda verir.[92] Vücuda giren toryumun dörtte üçü iskelette birikir. Deri yoluyla absorpsiyon mümkün, ancak olası bir maruz kalma yolu değildir.[130] Toryumun sudaki çözünürlüğünün düşük olması, toryumun böbrekler ve dışkı yoluyla atılımının oldukça yavaş olduğu anlamına gelir.[34]
Testler Monazit işçilerinin vücutlarında önerilen sınırların üzerinde toryum seviyeleri gösterdi, ancak bu orta derecede düşük konsantrasyonlarda sağlık üzerinde herhangi bir olumsuz etki bulunmadı. Toryum maruziyetinden kaynaklanan trakeobronşiyal yol ve akciğerlerde henüz kimyasal toksisite gözlenmemiştir.[34] Toryum bileşikleri ile çalışan kişiler dermatit riski altındadır. Semptomların kendini göstermesi toryum alımından sonra otuz yıl kadar sürebilir.[39] Toryumun bilinen bir biyolojik rolü yoktur.[39]
Kimyasal
[değiştir | kaynağı değiştir]Toz haline getirilmiş toryum metali piroforiktir: havada kendiliğinden tutuşur.[4] 1964'te Amerika Birleşik Devletleri İçişleri Bakanlığı, "Metal tozlarının tutuşması ve patlayabilirliği" başlıklı bir tabloda toryumu "şiddetli" olarak listeledi. Tutuşma sıcaklığı toz bulutları için 270 °C (520 °F) olarak verildi. Minimum patlayıcı konsantrasyonu 0,075 ons/cu ft (0,075 kg/ m3 ) olarak listelendi. (mikron altı olmayan) toz için minimum tutuşma enerjisi 5 mJ olarak listelenmiştir.[137]
1956'da, Amerika Birleşik Devletleri'nin New York şehrinde toryum çamurunun yeniden işlenmesi ve yakılması sırasında Sylvania Electric Products patlaması meydana geldi. Dokuz kişi yaralandı; biri üçüncü derece yanıkların neden olduğu komplikasyonlardan öldü.[138][139][140]
Maruziyet yolları
[değiştir | kaynağı değiştir]Toryum, Dünya'nın her yerinde çok küçük miktarlarda bulunur, ancak belirli kısımlarda daha büyük miktarlar bulunur: ortalama bir insan vücudu yaklaşık 40 mikrogram toryum içerir ve kişi tipik olarak günde üç mikrogram tüketir.[39] Çoğu toryuma maruz kalma, toz soluma yoluyla gerçekleşir; bazı toryum yiyecek ve su ile birlikte gelir, ancak düşük çözünürlüğü nedeniyle bu maruz kalma ihmal edilebilir düzeydedir.[34]
Toryum yatakları veya radyoaktif atık imha alanlarının yakınında yaşayanlar, uranyum, fosfat veya kalay işleme fabrikalarının yakınında yaşayanlar veya buralarda çalışanlar ve gaz mantosu üretiminde çalışanlarda maruziyet artar.[141] Toryum özellikle Hindistan'ın Tamil Nadu kıyı bölgelerinde yaygındır ve burada yaşayanlar dünya ortalamasının on katı kadar doğal olarak oluşan radyasyon dozuna maruz kalabilirler.[142] Aynı zamanda güney Bahia'dan radyoaktif monazit kumlu plajlara sahip bir şehir olan Guarapari'ye kadar kuzey Brezilya kıyı bölgelerinde de yaygındır ve radyasyon seviyeleri dünya ortalama arka plan radyasyonundan 50 kat daha yüksektir.[143]
Diğer bir olası maruz kalma kaynağı, bazı füzelerin güdüm sistemlerinde toryum kullanıldığı için, silah test menzillerinde üretilen toryum tozudur. Bu, İtalya'nın Sardunya adasındaki Salto di Quirra'daki yüksek doğum kusurları ve kanser insidansından sorumlu tutuldu.[144]
Ayrıca bakınız
[değiştir | kaynağı değiştir]- Toryum Enerji İttifakı
Açıklayıcı notlar
[değiştir | kaynağı değiştir]Alıntılar
[değiştir | kaynağı değiştir]Genel kaynakça
[değiştir | kaynağı değiştir]- Chemistry of the Elements. 2nd. Butterworth-Heinemann. 1997. ISBN 978-0-08-037941-8.
- "Thorium and Thorium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. 2005. doi:10.1002/14356007.a27_001. ISBN 978-3-527-31097-5. Yazar
|ad1=eksik|soyadı1=(yardım) - "Thorium". The Chemistry of the Actinide and Transactinide Elements. 2006. ss. 52-160. doi:10.1007/1-4020-3598-5_3. ISBN 978-1-4020-3555-5.
Konuyla ilgili yayınlar
[değiştir | kaynağı değiştir]- "Thorium: Does Crustal Abundance Lead to Economic Availability?" (PDF). Colorado School of Mines. 2014. 30 Haziran 2017 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 29 Eylül 2017.
- International Atomic Energy Agency (2005). Thorium fuel cycle – Potential benefits and challenges 4 Ağustos 2016 tarihinde Wayback Machine sitesinde arşivlendi.
Not listesi
[değiştir | kaynağı değiştir]- ^ Bismuth is very slightly radioactive, but its half-life (1.9×1019 years) is so long that its decay is negligible even over geological timespans.
- ^ Behind osmium, tantalum, tungsten, and rhenium;[8] higher boiling points are speculated to be found in the 6d transition metals, but they have not been produced in large enough quantities to test this prediction.Şablon:Fricke1975
- ^ The name ionium for 230Th is a remnant from a period when different isotopes were not recognised to be the same element and were given different names.
- ^ Unlike the previous similarity between the actinides and the transition metals, the main-group similarity largely ends at thorium before being resumed in the second half of the actinide series, because of the growing contribution of the 5f orbitals to covalent bonding. The only other commonly-encountered actinide, uranium, retains some echoes of main-group behaviour. The chemistry of uranium is more complicated than that of thorium, but the two most common oxidation states of uranium are uranium(VI) and uranium(IV); these are two oxidation units apart, with the higher oxidation state corresponding to formal loss of all valence electrons, which is similar to the behaviour of the heavy main-group elements in the p-block.[32]
- ^ An even number of either protons or neutrons generally increases nuclear stability of isotopes, compared to isotopes with odd numbers. Elements with odd atomic numbers have no more than two stable isotopes; even-numbered elements have multiple stable isotopes, with tin (element 50) having ten.[9]
- ^ Other isotopes may occur alongside 232Th, but only in trace quantities. If the source contains no uranium, the only other thorium isotope present would be 228Th, which occurs in the decay chain of 232Th (the thorium series): the ratio of 228Th to 232Th would be under 10−10.[55] If uranium is present, tiny traces of several other isotopes will also be present: 231Th and 227Th from the decay chain of 235U (the actinium series), and slightly larger but still tiny traces of 234Th and 230Th from the decay chain of 238U (the uranium series).[55] 229Th is also been produced in the decay chain of 237Np (the neptunium series): all primordial 237Np is extinct, but it is still produced as a result of nuclear reactions in uranium ores.[56] 229Th is mostly produced as a daughter of artificial 233U made by neutron irradiation of 232Th, and is extremely rare in nature.[55]
- ^ Thorianite refers to minerals with 75–100 mol% ThO
2; uranothorianite, 25–75 mol% ThO
2; thorian uraninite, 15–25 mol% ThO
2; uraninite, 0–15 mol% ThO
2.[60] - ^ At the time, the rare-earth elements, among which thorium was found and with which it is closely associated in nature, were thought to be divalent; the rare earths were given atomic weight values two-thirds of their actual ones, and thorium and uranium are given values half of the actual ones.
- ^ The main difficulty in isolating thorium lies not in its chemical electropositivity, but in the close association of thorium in nature with the rare-earth elements and uranium, which collectively are difficult to separate from each other. Swedish chemist Lars Fredrik Nilson, the discoverer of scandium, had previously made an attempt to isolate thorium metal in 1882, but was unsuccessful at achieving a high degree of purity.[73] Lely and Hamburger obtained 99% pure thorium metal by reducing thorium chloride with sodium metal.[74] A simpler method leading to even higher purity was discovered in 1927 by American engineers John Marden and Harvey Rentschler, involving the reduction of thorium oxide with calcium in presence of calcium chloride.[74]
- ^ Thorium also appears in the 1864 table by British chemist John Newlands as the last and heaviest element, as it was initially thought that uranium was a trivalent element with an atomic weight of around 120: this is half of its actual value, since uranium is predominantly hexavalent. It also appears as the heaviest element in the 1864 table by British chemist William Odling under titanium, zirconium, and tantalum. It does not appear in the periodic systems published by French geologist Alexandre-Émile Béguyer de Chancourtois in 1862, German-American musician Gustav Hinrichs in 1867, or German chemist Julius Lothar Meyer in 1870, all of which exclude the rare earths and thorium.[75]
- ^ The filling of the 5f subshell from the beginning of the actinide series was confirmed in 1964 when the next element, rutherfordium, was first synthesised and found to behave like hafnium, as would be expected if the filling of the 5f orbitals had already finished by then.[87] Today, thorium's similarities to hafnium are still sometimes acknowledged by calling it a "pseudo group 4 element".[88]
- ^ The thirteen fissile actinide isotopes with half-lives over a year are 229Th, 233U, 235U, 236Np, 239Pu, 241Pu, 242mAm, 243Cm, 245Cm, 247Cm, 249Cf, 251Cf, and 252Es. Of these, only 235U is naturally occurring, and only 233U and 239Pu can be bred from naturally occurring nuclei with a single neutron capture.[120]
- ^ "Arşivlenmiş kopya". 3 Şubat 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Haziran 2023.
- ^ https://www.ntv.com.tr/teknoloji/cinde-ilk-toryum-reaktoru-icin-isletim-izni-verildi,ejXbPgVCkEq0Bbt8ZVDqFw [yalın URL]
- ^ Negre, César et al.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb Wickleder, Fourest & Dorhout 2006.
- ^ Smithells Metals Reference Book (İngilizce). Butterworth-Heinemann. 2003. ss. 15-2-15-3. ISBN 978-0-08-048096-1.
- ^ a b c d e Tretyakov, Yu. D., (Ed.) (2007). Non-organic chemistry in three volumes. Chemistry of transition elements. 3. Academy. ISBN 978-5-7695-2533-9.
- ^ a b Johansson (1995). "Anomalous fcc crystal structure of thorium metal". Physical Review Letters. 75 (2): 280-283. doi:10.1103/PhysRevLett.75.280. PMID 10059654. 8 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ Wickleder, Fourest & Dorhout 2006, ss. 61–63.
- ^ a b c d e f Audi (December 2003). "The Nubase evaluation of nuclear and decay properties" (PDF). Nuclear Physics A. 729 (1): 3-128. doi:10.1016/j.nuclphysa.2003.11.001. 16 Nisan 2023 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 13 Nisan 2023.
- ^ Wieser (1 Ocak 2006). "Atomic weights of the elements 2005 (IUPAC Technical Report)". Pure and Applied Chemistry. 78 (11): 2051-2066. doi:10.1351/pac200678112051.
- ^ Radiochemistry and Nuclear Chemistry. 2. EOLSS Publications. 2009. s. 374. ISBN 978-1-84826-127-3. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Nagy, S.; Klencsár, Z.; Lovas, R. G.; Rösch, F., (Ed.) (2010). "Natural Radioactive Decay Chains". Handbook of Nuclear Chemistry. Springer Science+Business Media. s. 668. ISBN 978-1-4419-0719-6. Yazar
|ad1=eksik|soyadı1=(yardım); r eksik|soyadı1=(yardım) - ^ "Nuclear Transformations" (PDF). Concepts of Modern Physics. 6. McGraw-Hill Education. 2003. ss. 432-434. ISBN 978-0-07-244848-1. 4 Ekim 2016 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 4 Temmuz 2016. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ (Basın açıklaması). 2013. Eksik ya da boş
|başlık=(yardım) - ^ "Mineral Yearbook 2012" (PDF). United States Geological Survey. 11 Nisan 2013 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 30 Eylül 2017.
- ^ Ramdahl (September 2016). "An efficient chelator for complexation of thorium-227". Bioorganic & Medicinal Chemistry Letters. 26 (17): 4318-4321. doi:10.1016/j.bmcl.2016.07.034. PMID 27476138.
- ^ Deblonde (19 Kasım 2018). "Solution Thermodynamics and Kinetics of Metal Complexation with a Hydroxypyridinone Chelator Designed for Thorium-227 Targeted Alpha Therapy". Inorganic Chemistry. 57 (22): 14337-14346. doi:10.1021/acs.inorgchem.8b02430. PMID 30372069. 11 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ Captain (21 Kasım 2016). "Engineered Recognition of Tetravalent Zirconium and Thorium by Chelator–Protein Systems: Toward Flexible Radiotherapy and Imaging Platforms". Inorganic Chemistry. 55 (22): 11930-11936. doi:10.1021/acs.inorgchem.6b02041. PMID 27802058. 29 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ Bonetti (1995). "First observation of spontaneous fission and search for cluster decay of 232Th". Physical Review C. 51 (5): 2530-2533. doi:10.1103/PhysRevC.51.2530. PMID 9970335.
- ^ "New isotope 207Th and odd-even staggering in α-decay energies for nuclei with Z > 82 and N < 126". Physical Review C. 105 (L051302). 2022. doi:10.1103/PhysRevC.105.L051302. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Standard Atomic Weights: Thorium 25 Mart 2023 tarihinde Wayback Machine sitesinde arşivlendi.".
- ^ Ruchowska (2006). "Nuclear structure of 229Th". Physical Review C. 73 (4): 044326. doi:10.1103/PhysRevC.73.044326. 28 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ Beck (2007). "Energy splitting in the ground state doublet in the nucleus 229Th". Physical Review Letters. 98 (14): 142501. doi:10.1103/PhysRevLett.98.142501. PMID 17501268. 13 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ von der Wense (2016). "Direct detection of the 229Th nuclear clock transition". Nature. 533 (7601): 47-51. arXiv:1710.11398 $2. doi:10.1038/nature17669. PMID 27147026.
- ^ a b "Evaluation of nuclear criticality safety data and limits for actinides in transport" (PDF). Institut de radioprotection et de sûreté nucléaire. s. 15. 10 Temmuz 2007 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 20 Aralık 2010.
- ^ a b "3–6: Uranium Thorium Dating" (PDF). Institute for Structure and Nuclear Astrophysics, University of Notre Dame. 4 Eylül 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 7 Ekim 2017.
- ^ "Uranium-Thorium Dating". Department of Geosciences, University of Arizona. 28 Mart 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Ekim 2017. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Geochronology, Dating, and Precambrian Time: The Beginning of the World As We Know It, The Geologic History of Earth, Rosen Publishing, 2010, s. 150, ISBN 978-1-61530-125-6
- ^ a b Klencsár, Z.; Lovas, R. G.; Rösch, F., (Ed.) (2010), Handbook of Nuclear Chemistry, 2nd, 5, Springer Science+Business Media, s. 800, ISBN 978-1-4419-0719-6 r eksik
|soyadı1=(yardım) - ^ a b c d Lanthanide and Actinide Chemistry. John Wiley & Sons. 2006. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Martin (July 1974). "Ground Levels and Ionization Potentials for Lanthanide and Actinide Atoms and Ions". Journal of Physical and Chemical Reference Data. 3 (3): 771-780. doi:10.1063/1.3253147.
- ^ a b Inorganic Chemistry of Main Group Elements. Wiley-VCH. 1995. ISBN 978-0-471-18602-1. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b c d e f g h i j k l m n o p Greenwood & Earnshaw 1997.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y Stoll 2005.
- ^ a b The Elements, in Handbook of Chemistry and Physics. 81st. CRC Press. 2004. ISBN 978-0-8493-0485-9. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Hyde, E. K. (1960). The radiochemistry of thorium (PDF). National Academy of Sciences. 5 Mart 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 29 Eylül 2017.
- ^ Moore (May 1957). "Nitric Acid Dissolution of Thorium. Kinetics of Fluoride-Catalyzed Reaction". Industrial & Engineering Chemistry. 49 (5): 885-887. doi:10.1021/ie50569a035.
- ^ Yamashita (1997). "Thermal expansions of NpO2 and some other actinide dioxides". J. Nucl. Mater. 245 (1): 72-78. doi:10.1016/S0022-3115(96)00750-7.
- ^ a b c d e f g h Nature's building blocks: an A–Z guide to the elements. Oxford University Press. 2011. ss. 544-548. ISBN 978-0-19-960563-7. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b c "Candoluminescence and radical-excited luminescence". Journal of Luminescence. 8 (4): 271-307. 1974. doi:10.1016/0022-2313(74)90001-5. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Hydrated metal ions in aqueous solution: How regular are their structures?". Pure and Applied Chemistry. 82 (10): 1901-1917. 2010. doi:10.1351/PAC-CON-09-10-22. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Heavy-metal cluster sets size record for metal aromaticity". Chemistry World (İngilizce). 4 Ocak 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Temmuz 2022. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Langeslay (2015). "Synthesis, structure, and reactivity of crystalline molecular complexes of the {[C5H3(SiMe3)2]3Th}1− anion containing thorium in the formal +2 oxidation state". Chemical Science. 6 (6): 517-521. doi:10.1039/C4SC03033H. PMC 5811171 $2. PMID 29560172.
- ^ a b c d Cameron (September 1973). "Abundances of the elements in the solar system". Space Science Reviews. 15 (1): 121. doi:10.1007/BF00172440.
- ^ Frebel (January 2018). "The formation of the heaviest elements". Physics Today. 71 (1): 30-37. arXiv:1801.01190 $2. doi:10.1063/pt.3.3815.
- ^ a b Roederer (2009). "The End of Nucleosynthesis: Production of Lead and Thorium in the Early Galaxy". The Astrophysical Journal. 698 (2): 1963-1980. arXiv:0904.3105 $2. doi:10.1088/0004-637X/698/2/1963.
- ^ Burbidge (1 Ekim 1957). "Synthesis of the Elements in Stars". Reviews of Modern Physics. 29 (4): 547-650. doi:10.1103/RevModPhys.29.547.
- ^ Principles of Stellar Evolution and Nucleosynthesis. McGraw-Hill Education. 1968. ss. 577-591. ISBN 978-0-226-10953-4. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Geochemistry: an introduction. Cambridge University Press. 2003. s. 17. ISBN 978-0-521-89148-6. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Trenn (1978). "Thoruranium (U-236) as the extinct natural parent of thorium: The premature falsification of an essentially correct theory". Annals of Science. 35 (6): 581-597. doi:10.1080/00033797800200441.
- ^ Diamond (1956). "Possible Existence of Cm247 or Its Daughters in Nature". Physical Review. 105 (2): 679-680. doi:10.1103/PhysRev.105.679.
- ^ Rao (1973). "Curium-248 in the Early Solar System". Nature. 245 (5424): 304-307. doi:10.1038/245304a0.
- ^ Rosenblatt (1953). "Effects of a Primeval Endowment of U236". Physical Review. 91 (6): 1474-1475. doi:10.1103/PhysRev.91.1474.
- ^ Gando (September 2011). "Partial radiogenic heat model for Earth revealed by geoneutrino measurements". Nature Geoscience. 4 (9): 647-651. doi:10.1038/ngeo1205. 17 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ a b c Wickleder, Fourest & Dorhout 2006, ss. 53–55.
- ^ Peppard, D. F.; Mason, G. W.; Gray, P. R.; Mech, J. F. (1952). "Occurrence of the (4n + 1) Series in Nature". Journal of the American Chemical Society. 74 (23): 6081-6084. doi:10.1021/ja01143a074. 28 Temmuz 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ Agency for Toxic Substances and Disease Registry (2016). Eksik ya da boş
|başlık=(yardım) - ^ Woodhead (1 Şubat 1991). "The metamictization of zircon: Radiation dose-dependent structural characteristics". American Mineralogist. 76 (1–2): 74-82. 13 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ Szymanski (1 Şubat 1982). "A mineralogical study and crystal-structure determination of nonmetamict ekanite, ThCa2Si8O20". The Canadian Mineralogist. 20 (1): 65-75. 24 Ekim 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ Wickleder, Fourest & Dorhout 2006, ss. 55–56.
- ^ "Tor's Fight with the Giants" (İngilizce). Google Arts & Culture. 9 Ekim 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Haziran 2016.
- ^ a b The Lost Elements: The Periodic Table's Shadow Side. Oxford University Press. 2014. s. 73. ISBN 978-0-19-938334-4.
- ^ The Analytical Chemistry of Thorium: International Series of Monographs on Analytical Chemistry. Elsevier. 2013. s. 1. ISBN 978-1-4831-5659-0.
- ^ A System of Chemistry of Inorganic Bodies. 1. Baldwin & Cradock and William Blackwood. 1831. s. 475. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Undersökning af några Mineralier. 1. Phosphorsyrad Ytterjord" [Examining some minerals. 1st phosphoric yttria.]. Kungliga Svenska Vetenskapsakademiens Handlingar (İsveççe). 2: 334-338. 1824. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Xenotime-(Y)". Mindat database. 28 Eylül 2003 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Ekim 2017.
- ^ Store norske leksikon (Norveççe). 2007. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Weeks (1932). "The discovery of the elements. XI. Some elements isolated with the aid of potassium and sodium: Zirconium, titanium, cerium, and thorium". Journal of Chemical Education. 9 (7): 1231. doi:10.1021/ed009p1231.
- ^ "Untersuchung eines neues Minerals und einer darin erhalten zuvor unbekannten Erde" [Investigation of a new mineral and of a previously unknown earth contained therein]. Annalen der Physik und Chemie (Almanca). 16 (7): 385-415. 1829. doi:10.1002/andp.18290920702. 27 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Undersökning af ett nytt mineral (Thorit), som innehåller en förut obekant jord" [Investigation of a new mineral (thorite), as contained in a previously unknown earth]. Kungliga Svenska Vetenskaps Akademiens Handlingar (İsveççe): 1-30. 1829. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Schilling (1902). "Die eigentlichen Thorit-Mineralien (Thorit und Orangit)" [The actual thoritic minerals (thorite and orangite)]. Zeitschrift für Angewandte Chemie (Almanca). 15 (37): 921-929. doi:10.1002/ange.19020153703. 13 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ "The Internet Database of Periodic Tables: Berzelius' Electronegativity Table". 29 Ocak 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Temmuz 2016. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Nilson, L. F. (1882). "Über metallisches Thorium" [About metallic thorium]. Berichte der Deutschen Chemischen Gesellschaft (Almanca). 15 (2): 2537-2547. doi:10.1002/cber.188201502213. 13 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023.
- ^ a b Meister, G. (1948). Production of Rarer Metals (PDF). United States Atomic Energy Commission. 24 Şubat 2017 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 22 Eylül 2017.
- ^ a b c d "The Internet Database of Periodic Tables". 1 Ekim 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Mayıs 2012. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Jensen (August 2003). "The Place of Zinc, Cadmium, and Mercury in the Periodic Table". Journal of Chemical Education. 80 (8): 952. doi:10.1021/ed080p952.
- ^ a b Chemistry: Principles and reactions. 7th. Cengage Learning. 2011. s. 173. ISBN 978-1-111-42710-8.
- ^ "Rayons émis par les composés de l'uranium et du thorium" [Rays emitted by compounds of uranium and thorium]. Comptes Rendus (Fransızca). 126: 1101-1103. 1898. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Über die vom Thorium und den Thoriumverbindungen ausgehende Strahlung" [On the radiation emitted by thorium and thorium compounds]. Verhandlungen der Physikalischen Gesellschaft zu Berlin (Almanca). 17: 14-16. 1898. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Über die von den Thorverbindungen und einigen anderen Substanzen ausgehende Strahlung" [On the radiation emitted by thorium compounds and some other substances]. Annalen der Physik und Chemie (Almanca). 65 (5): 141-151. 1898. doi:10.1002/andp.18983010512. 28 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Nisan 2023. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Rutherford, E. (1899). "Thorium and uranium radiation". Trans. R. Soc. Can. 2: 9-12.
- ^ The Scientific 100: A Ranking of the Most Influential Scientists, Past and Present. Carol. 1996. s. 19. ISBN 978-0-8065-2139-8. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Marie and Pierre Curie and the Discovery of Polonium and Radium". nobelprize.org. Nobel Media AB. 1996. 26 Temmuz 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Mayıs 2017. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Low-Level Radioactive Waste Regulation-Science, Politics and Fear. CRC Press. 1987. ss. 24-25. ISBN 978-0-87371-026-8. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ The periodic system of chemical elements. Elsevier. 1969. ss. 315-316. ISBN 978-0-444-40776-4. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ The Making of the Atomic Bomb. 25th Anniversary. Simon & Schuster. 2012. ss. 221-222, 349. ISBN 978-1-4516-7761-4. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Türler, A.; Buklanov, G. V.; Eichler, B.; Gäggeler, H. W.; Grantz, M.; Hübener, S.; Jost, D. T.; Lebedev, V. Ya.; Piguet, D.; Timokhin, S. N.; Yakushev, A. B.; Zvara, I. (1998). "Evidence for relativistic effects in the chemistry of element 104". Journal of Alloys and Compounds. 271–273: 287. doi:10.1016/S0925-8388(98)00072-3.
- ^ Kratz, J. V.; Nagame, Y. (2014). "Liquid-Phase Chemistry of Superheavy Elements". Schädel, M.; Shaughnessy, D. (Ed.). The Chemistry of Superheavy Elements (2. bas.). Springer-Verlag. s. 335. doi:10.1007/978-3-642-37466-1. ISBN 978-3-642-37465-4.
- ^ a b c d Furuta (2000). "Comparisons between radioactive and non-radioactive gas lantern mantles". J. Radiol. Prot. 20 (4): 423-431. doi:10.1088/0952-4746/20/4/305. PMID 11140713.
- ^ New Jersey Department of Health (1996). "Health and hazardous waste" (PDF). A Practitioner's Guide to Patients' Environmental Exposures. 1 (3): 1-8. 15 Nisan 2016 tarihinde kaynağından (PDF) arşivlendi.
- ^ Toepker (1996). "Thorium and yttrium in gas lantern mantles". American Journal of Physics. 64 (2): 109. doi:10.1119/1.18463.
- ^ a b Poljanc (2007). "Beyond low-level activity: on a "non-radioactive" gas mantle". Science of the Total Environment. 374 (1): 36-42. doi:10.1016/j.scitotenv.2006.11.024. PMID 17270253.
- ^ "Thorium Fuel for Nuclear Energy". American Scientist. 2003. 1 Ocak 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Eylül 2017. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Mallapaty (9 Eylül 2021). "China prepares to test thorium-fuelled nuclear reactor". Nature. 597 (7876): 311-312. doi:10.1038/d41586-021-02459-w. PMID 34504330.
- ^ . 1999. Eksik ya da boş
|başlık=(yardım) - ^ "Nuclear Power in India". World Nuclear Association. 2017. 9 Şubat 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Eylül 2017.
- ^ a b "IAEA-TECDOC-1450 Thorium Fuel Cycle – Potential Benefits and Challenges" (PDF). International Atomic Energy Agency. 2005. 13 Temmuz 2005 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 23 Mart 2009.
- ^ Shippingport Atomic Power Station. "Historic Achievement Recognized: Shippingport Atomic Power Station, A National Engineering Historical Landmark" (PDF). s. 4. 17 Temmuz 2015 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 24 Haziran 2006.
- ^ Friedman (September 1997). "More power to thorium?". Bulletin of the Atomic Scientists. 53 (5): 19-20. doi:10.1080/00963402.1997.11456765.
- ^ "IAEA-TECDOC-1349 Potential of thorium-based fuel cycles to constrain plutonium and to reduce the long-lived waste toxicity" (PDF). International Atomic Energy Agency. 2002. 6 Mart 2007 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 24 Mart 2009.
- ^ "Scientist urges switch to thorium". ABC News. 2006. 28 Mart 2010 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Eylül 2011. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Uranium is So Last Century – Enter Thorium, the New Green Nuke". Wired. 2009. 26 Haziran 2010 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Haziran 2010. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ The First Nuclear Era: The life and times of a technological fixer. New York: AIP Press. 1994. ss. 36-38. ISBN 978-1-56396-358-2. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b c "Thorium". World Nuclear Association. 2017. 6 Şubat 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Haziran 2017.
- ^ (İngilizce). Eksik ya da boş
|başlık=(yardım) - ^ "Classification Bulletin WNP-118" (PDF). U.S. Department of Energy. 12 Mart 2008. 3 Şubat 2017 tarihinde kaynağından (PDF) arşivlendi.
- ^ United States Geological Survey (2012). "Thorium" (PDF). 7 Temmuz 2012 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 12 Mayıs 2017.
- ^ . 1987. Eksik ya da boş
|başlık=(yardım) - ^ (İngilizce). 2017. Eksik ya da boş
|başlık=(yardım) - ^ The Book of Non-electric Lighting: The classic guide to the safe use of candles, fuel lamps, lanterns, gaslights, & fire-view stoves. Countryman Press. 2011. s. 60. ISBN 978-1-58157-829-4. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "A review of consumer products containing radioactive substances in the European Union" (PDF). NRPB Occupational Services Department. 9 Haziran 2005. 2 Ağustos 2017 tarihinde kaynağından (PDF) arşivlendi.
- ^ ""Negative Ion" Technology—What You Should Know". U.S. Nuclear Regulatory Commission. 28 Temmuz 2014. 8 Aralık 2014 tarihinde kaynağından arşivlendi.
- ^ Electronic Devices and Circuits. The Commonwealth and International Library: Electrical Engineering Division (İngilizce). Elsevier. 2016. s. 105. ISBN 978-1-4831-3979-1. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Weld Like a Pro: Beginning to advanced techniques. CarTech Inc. 2015. s. 42. ISBN 978-1-61325-221-5. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Welding: Principles and Applications. Cengage Learning. 2016. s. 393. ISBN 978-1-305-49469-5. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Thoriated Camera Lens (ca. 1970s)". Oak Ridge Associated Universities. 2021. 24 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Ekim 2021.
- ^ Optical Thin Films. User Handbook. SPIE Press. 1996. s. 196. ISBN 978-0-8194-2285-9. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Optical Interference Coatings (İngilizce). Springer. 2013. s. 111. ISBN 978-3-540-36386-6.
- ^ Ronen (March 2006). "A Rule for Determining Fissile Isotopes". Nuclear Science and Engineering. 152 (3): 334-335. doi:10.13182/nse06-a2588.
- ^ a b Ronen (2010). "Some remarks on the fissile isotopes". Annals of Nuclear Energy. 37 (12): 1783-1784. doi:10.1016/j.anucene.2010.07.006.
- ^ "Plutonium". World Nuclear Association. 2017. 12 Şubat 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Eylül 2017.
- ^ "Interactive Chart of Nuclides". Brookhaven National Laboratory. 24 Ocak 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Ağustos 2013.
- ^ "Thorium test begins". World Nuclear News. 2013. 19 Temmuz 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Temmuz 2013.
- ^ a b Introduction to Weapons of Mass Destruction: Radiological, Chemical, and Biological. John Wiley & Sons. 2004. s. 85. ISBN 978-0-471-46560-7. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Fluorinated Materials for Energy Conversion. Elsevier. 2005. ss. 562-565. ISBN 978-0-08-044472-7.
- ^ "Don't believe the spin on thorium being a greener nuclear option". The Guardian. 2011. 27 Eylül 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Eylül 2017. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ The National Politics of Nuclear Power: Economics, Security, and Governance. Routledge. 2012. s. 226. ISBN 978-1-136-29437-2.
- ^ "Nuclear Energy FAQs" (PDF). Argonne National Laboratory. 2014. 7 Ekim 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 13 Ocak 2018.
- ^ Nuclear Energy and Global Governance: Ensuring Safety, Security and Non-proliferation. Routledge. 2011. s. 9. ISBN 978-1-136-84993-0. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b c "Thorium: Radiation Protection". United States Environmental Protection Agency. 1 Ekim 2006 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Şubat 2016.
- ^ a b "Radioactivity in Lantern Mantles". Australian Radiation Protection and Nuclear Safety Agency. 14 Ekim 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Eylül 2017.
- ^ "Natural Decay Series: Uranium, Radium, and Thorium" (PDF). Argonne National Laboratory. 2005. 17 Ağustos 2016 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 30 Eylül 2017.
- ^ Luetzelschwab (1984). "Radioactivity released from burning gas lantern mantles". Health Phys. 46 (4): 873-881. doi:10.1097/00004032-198404000-00013. PMID 6706595.
- ^ Huyskens (1985). "Dose estimates for exposure to radioactivity in gas mantles". Sci. Total Environ. 45: 157-164. doi:10.1016/0048-9697(85)90216-5. PMID 4081711.
- ^ "Toxicological Profile for Thorium" (PDF). Agency for Toxic Substances and Disease Registry U.S. Public Health Service. 1990. s. 4. 21 Ekim 2004 tarihinde kaynağından (PDF) arşivlendi.
- ^ (Almanca). 1988. Eksik ya da boş
|başlık=(yardım) - ^ . 1964. Eksik ya da boş
|başlık=(yardım) - ^ "Nine Injured in Atomic Lab Blasts". Pittsburgh Post-Gazette. Associated Press. 1956. s. 2. 16 Mart 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Eylül 2017.
- ^ "No Radiation Threat Seen in A-laboratory Blast". The St. Petersburg Times. Associated Press. 1956. s. 2. 16 Mart 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Eylül 2017.
- ^ "Sad Memories of '56 Sylvania Explosion". New York Newsday. 2003. 4 Şubat 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Eylül 2017. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Thorium ToxFAQs" (PDF). Agency for Toxic Substances and Disease Registry. 5 Haziran 2012 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 29 Eylül 2017.
- ^ "Compendium of Policy And Statutory Provisions Relating To Exploitation of Beach Sand Minerals". Department of Atomic Energy. 4 Aralık 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Aralık 2008.
- ^ Pfeiffer, W. C. (1981). "Measurements of environmental radiation exposure dose rates at selected sites in Brazil". An. Acad. Bras. Ciênc. 53 (4): 683-691. PMID 7345962.
- ^ "Italian military officials' trial ignites suspicions of links between weapon testing and birth defects in Sardinia". ABC News. Australian Broadcasting Corporation. 29 Ocak 2019. 29 Ocak 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Ocak 2019. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım)
