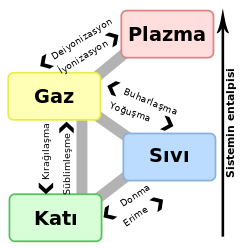
Süblimleşme
Süblimleşme, katı maddelerin ısıtılınca, ara bir hâl olan sıvı hâle geçmeden doğrudan gaz hâle geçmesi. Süblimleşme endotermik faz değişimidir. Faz diyagramındaki üçlü noktanın altında gerçekleşir. Süblimleşme'nin tersine ise kırağılaşma denir.
Normal basınç altında çoğu kimyasal bileşikler ve elementler değişik sıcaklıklarda üç farklı özellik gösterirler. Bu durumlarda katı hâlden gaz hâle geçiş için ara bir hâl olan sıvı hâl gereklidir. Burada bahsedilen basınç maddenin kısmi basıncıdır, tüm sistemin basıncı (atmosfer basıncını vs. kapsar) değildir. Gereken buharlaşma basıncına belli bir sıcaklıkta sahip olan bütün katılar genellikle süblimleşebilir. Karbon, arsenik gibi bazı maddelerin üçlü noktalarının yüksek olması dolayısıyla süblimleşmesi, eriyip buharlaşmasından daha kolaydır.
Süblimleşme endotermik bir hâl değişimi olduğundan dışarıdan enerji absorbe eder. Süblimleşme entalpisi, füzyon entalpisi ve buharlaşma entalpisinin toplamı olarak hesaplanabilir.
Örnekler
[değiştir | kaynağı değiştir]- Karbondioksit
Katı karbondioksit -78,5 °C'de atmosferik basınç altında süblimleşir. Sıvı karbondioksit ise üçlü noktanın üzerinde sıcaklık ve basınç değerlerinde elde edilebilir (5,2 atm, -56,4 °C).
- Su
Kar ve buz erime noktasının altında çok yavaşça süblimleşebilir. Bu durum ıslak çamasırların dondurucu sıcaklıkta asılıp sonradan kuru olarak alınmasını sağlayabilir.
- Diğer

Kaynakça
[değiştir | kaynağı değiştir]- King, R. B. Organometallic Syntheses. Volume 1 Transition-Metal Compounds; Academic Press: New York, 1965. ISBN 0-444-42607-8.
- Laurence M. Harwood, Christopher J. Moody. Experimental organic chemistry: Principles and Practice (Illustrated edition ed.). pp. 154–155.
Notlar
[değiştir | kaynağı değiştir]| Kimya ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. |