Spinal müsküler atrofi
| Spinal müsküler atrofi | |
|---|---|
| Diğer adlar | SMA |
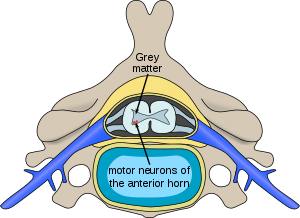 | |
| Omurilikte spinal müsküler atrofiden etkilenen nöronların yeri | |
| Uzmanlık | Nöroloji |
| Belirtiler | Progresif kas güçsüzlüğü[1] |
| Komplikasyon | Skolyoz, ortak kontraktürler, zatürre[2] |
| Tipler | Tip 0'dan Tip 4'e kadar[2] |
| Nedenleri | SMN1'deki bir mutasyon[2] |
| Tanı | Genetik test[1] |
| Ayırıcı tanı | Konjenital kas distrofisi, Duchenne kas distrofisi, Prader-Willi sendromu[2] |
| Tedavi | Semptomatik tedavi, ilaçlar[1] |
| İlaç | Nusinersen, onasemnogen abeparvovec |
| Prognoz | Tipine göre değişir[2] |
| Sıklık | 10,000 insanda 1 kişi[2] |
Spinal müsküler atrofi (SMA) (Türkçe: Omuriliğe bağlı kas atrofisi/körelme), motor nöronların kaybı ve ilerleyici kas erimesi ile sonuçlanan nadir görülen bir nöromüsküler bozukluktur.[3][4][5] Genellikle bebeklik veya erken çocukluk döneminde teşhis edilir ve tedavi edilmezse bebek ölümlerinin en yaygın genetik nedenidir.[6] Ayrıca hastalığın daha hafif bir seyirli bir türü yaşamın ilerleyen dönemlerinde ortaya çıkabilir. Ortak özellik, önce kol, bacak ve solunum kaslarının etkilendiği istemli kasların ilerleyici zayıflığıdır.[7][8] İlişkili problemler arasında zayıf baş kontrolü, yutma güçlüğü, skolyoz ve eklem kontraktürleri yer alabilir.[8][9]
Geleneksel sınıflandırmasının temelini hastalığın başlangıç yaşı ve semptomların şiddeti oluşturur.[4]
Spinal müsküler atrofi, motor nöronların hayatta kalması için gerekli bir protein olan SMN'yi kodlayan SMN1 genindeki[9][10] bir anormalliğe (mutasyon) bağlıdır.[8] Omurilikte bu nöronların kaybı, beyin ve iskelet kasları arasındaki sinyal iletimini engeller.[8] Başka bir gen olan SMN2, hastalığı modifiye eden bir gen olarak kabul edilir, çünkü genellikle SMN2 ne kadar çok kopyalanırsa hastalık seyri o kadar hafif olur. SMA'nın teşhisi semptomlara dayanır ve genetik testlerle doğrulanır.[10][11]
Genellikle SMN1 genindeki mutasyon, her iki ebeveynden de otozomal resesif kalıtılır, ancak vakaların yaklaşık %2'sinde erken gelişim sırasında de novo ortaya çıkar.[10][12] Spinal müsküler atrofi insidansı dünya çapında yaklaşık 4.000 doğumda 1 ila 16.000 doğumda 1 arasında değişmektedir,[13] Avrupa ve ABD için sırasıyla 7.000'de 1 ve 10.000'de 1 olarak belirtilmiştir.[9]
Hastalığın doğal seyri akut vakalarda doğumdan sonraki birkaç hafta içinde ölümden normal yaşam beklentisine kadar değişir.[8] 2016 yılında nedensel tedavilerin kullanılmaya başlanması, sonuçları önemli ölçüde iyileştirdi. Hastalığın genetik nedenini hedefleyen ilaçlar arasında nusinersen, risdiplam ve gen terapisi ilacı onasemnogene abeparvovec yer alır. Destekleyici bakım, fizik tedavi, mesleki terapi, solunum desteği, beslenme desteği, ortopedik müdahaleler ve hareketlilik desteğini içerir.[10]
Sınıflandırma
[değiştir | kaynağı değiştir]5q SMA, yetişkinliğe kadar bebekle etkileyen, geniş bir şiddet aralığında ortaya çıkan tek bir hastalıktır. Genetiği anlaşılmadan önce, değişen tezahürlerinin farklı hastalıklar olduğu düşünülüyordu; küçük çocuklar etkilendiğinde Werdnig-Hoffmann, geç başlangıçlı vakalar için Kugelberg-Welander hastalığı.[14]
Hastalıkların aynı bozukluğun ayrı spektrumlarını oluşturduğu 1990'da anlaşıldı. Spinal müsküler atrofi daha sonra semptomların başlama yaşı veya elde edilen maksimum motor fonksiyona göre 3-5 klinik tipte sınıflandırıldı.[12][14] Şu anda, fikir birliği, spinal müsküler atrofinin, alt tiplerin net bir şekilde tanımlanması olmaksızın bir dizi semptomu kapsadığı yönündedir.[12] Bununla birlikte, aşağıdaki tabloda özetlenen geleneksel sınıflandırma, günümüzde hem klinik araştırmalarda hem de bazen tartışmalı bir şekilde tedavilere erişim kriteri olarak kullanılmaktadır.
| Tip | isim | Olağan yaş ile ilgili başlangıç | Doğal tarih (farmakolojik tedavi olmadan) | OMİM |
|---|---|---|---|---|
| SMA 0 | doğum öncesi | Semptomlar doğumda görülür ve sıklıkla prenatal dönemde fetal hareketlerde azalma olarak belirginleşir. Etkilenen çocuklar tipik olarak SMN2 geninin yalnızca tek bir kopyasına sahiptir ve 7/24 solunum desteğiyle bile genellikle yalnızca birkaç hafta hayatta kalır. Bu form çok nadirdir - yakl. Vakaların% 2'si. | ||
| SMA 1 Çocuk |
Werdnig-Hoffmann hastalığı | 0–6 ay | Bu form, hastalığın yaşamın ilk birkaç haftası veya ayında kendini gösterdiği hastaların yaklaşık %50'sinde teşhis edilir. SMA daha sonra hızlı ve beklenmedik bir şekilde başlar ve çeşitli kas grupları aşamalı olarak başarısız olur. Bebekler asla desteksiz oturmayı öğrenmezler ve yavaş yavaş kas fonksiyonlarının çoğunu kaybederler. Ölüm genellikle pnömoninin (sıklıkla aspirasyon pnömonisi) neden olduğu solunum kaslarının başarısızlığından kaynaklanır. Erken dönemde solunum desteği ve/veya farmakolojik tedavi sağlanmadığı takdirde, SMA tip 1 tanısı alan bebekler genellikle iki yaşını geçemezler. Uygun solunum desteğiyle, SMA 1 vakalarının yaklaşık %10'unu oluşturan daha hafif SMA tip 1 fenotiplerine sahip olanların, her zaman 24 saat bakıma ihtiyaç duymalarına rağmen, farmakolojik tedavi olmaksızın bile ergenlik ve yetişkinliğe kadar hayatta kaldıkları bilinmektedir. | |
| SMA 2 Orta seviye |
Dubowitz hastalığı | 6–18 ay | Hastaların yaklaşık %20'sinde teşhis edilen ara form, hayatlarının en azından bir döneminde oturma pozisyonunu koruyabilen ancak desteksiz yürümeyi asla öğrenemeyen kişileri ifade eder. Zayıflığın başlangıcı genellikle yaşamın 6 ila 18 ayı arasında fark edilir. İlerlemenin büyük ölçüde değiştiği bilinmektedir, bazı insanlar zamanla kademeli olarak zayıflarken, diğerleri dikkatli bakım yoluyla nispeten sabit kalır. Vücut kasları zayıflar ve solunum sistemi, kas kontraktürleri ve spinal eğrilik gibi önemli bir endişe kaynağıdır. SMA 2'li çoğu insan tedavi görmese bile yetişkinliğe iyi bir şekilde yaşadığı halde yaşam beklentisi azalır. | |
| SMA 3 Genç |
Kugelberg-Welander hastalığı | >12 ay | Hastaların yaklaşık %30'unda teşhis edilen jüvenil form, 12 aylıktan sonra veya çocuklar en azından birkaç bağımsız adım atmayı öğrendikten sonra kendini gösterir. Hastalık yavaş ilerler ve SMA 3'lü çoğu insan yaşamlarının bir döneminde yürüme yeteneğini kaybederek hareket desteğine ihtiyaç duyar. Solunum tutulumu nadirdir ve yaşam beklentisi normal veya normale yakındır. | |
| SMA 4 Yetişkin başlangıçlı |
yetişkinlik | Bu, bazen geç başlangıçlı SMA tip 3 olarak da sınıflandırılan erişkin başlangıçlı formu belirtir. Yaklaşık olarak oluşur. Hastaların %5'inde görülür ve genellikle yaşamın üçüncü veya dördüncü dekadında ortaya çıkar. Semptomlar, sıklıkla hastanın yürüme yardımcılarını kullanmasını gerekli kılan bacak kaslarının kademeli olarak zayıflamasından oluşur. Diğer komplikasyonlar nadirdir ve yaşam beklentisi etkilenmez. |
Bakım odaklı yayınlar hastaları kolaylık için, işlevsel durumlarına göre "oturamayanlar", "oturanlar" ve "yürüyenler" olarak sınıflandırır.
SMA'lı kişilerde motor gelişim ve ilerleme genellikle onaylanmış ölçekler kullanılarak değerlendirilir; bebeklerde CHOP-INTEND (Philadelphia Çocuk Hastanesi Nöromüsküler Bozukluklar Bebek Testi) veya HINE (Hammersmith Bebek Nörolojik Muayenesi); ve yaşlı hastalarda MFM (Motor Fonksiyon Ölçümü) veya HFMS'nin (Hammersmith Fonksiyonel Motor Ölçeği)[15][16][17][18] gibi.
Werdnig-Hoffmann hastalığı Johann Hoffmann ve Guido Werdnig tarafından çocukluk SMA'sının en erken klinik tanımlarına atıfta bulunur.[14] Geç başlangıçlı formu ilk kez belgeleyen ve musküler distrofiden ayıran Erik Klas Hendrik Kugelberg (1913–1983) ve Lisa Welander' (1909–2001)dir.[14] Çok nadiren kullanılan Dubowitz hastalığı (Dubowitz sendromu ile karıştırılmamalı), adını ara SMA fenotipi üzerine birkaç çalışma yapan İngiliz nörolog Victor Dubowitz'den alır.
Belirti ve bulgular
[değiştir | kaynağı değiştir]
Belirtiler SMA tipi, evresi ve bireysel faktörlere bağlı olarak değişir. Aşağıdaki belirti ve semptomlar en çok şiddetli SMA tip 0/I'de görülür:[19]
- Arefleksi, özellikle ekstremitelerde
- Genel kas zayıflığı, zayıf kas tonusu, gevşeklik veya düşme eğilimi
- Gelişimsel dönüm noktalarına ulaşmada zorluk, oturma/ayakta durma/yürümede zorluk
- Küçük çocuklarda: otururken kurbağa bacağı pozisyonunun benimsenmesi (kalçalar kaçırılmış ve dizler fleksiyonda)
- Solunum kaslarının güç kaybı: zayıf öksürük, zayıf ağlama, akciğerler veya boğazda salgı birikmesi, solunum sıkıntısı
- Şiddetli SMA tipinde çan şeklindeki gövde (solunum için sadece karın kaslarının kullanılmasından kaynaklanır)
- Dilde fasikülasyonlar
- Emme veya yutma güçlüğü, zayıf beslenme
Nedenler
[değiştir | kaynağı değiştir]
Spinal müsküler atrofi, SMN1 genindeki genetik bir mutasyondan kaynaklanır.[20]
İnsan Kromozomu 5, 5q13 konumunda neredeyse aynı olan iki gen içerir: bir telomerik kopya SMN1 ve birsentromerik kopya SMN2. Sağlıklı bireylerde, SMN1 geni, adından da anlaşılacağı gibi, motor nöronların hayatta kalmasında çok önemli bir rol oynayan motor nöron proteinini (SMN) kodlar. Öte yandan, SMN2 geni - tek bir nükleotitteki (840.C→T) bir varyasyon nedeniyle - intron 6 ile ekson 8'in birleşme noktasında- alternatif eklemeye maruz kalır ve SMN2 transkriptlerinin yalnızca %10-20'si motor nöron proteininin (SMN-fl) fonksiyonel hayatta kalmasını tam olarak kodlar ve transkriptlerin kalan %80-90'ı, hücrede hızla parçalanan kesik bir protein bileşiği (SMNΔ7) ile sonuçlanır.[21]
SMA'dan etkilenen bireylerde, SMN1 geni, ekzon 7'de[22] meydana gelen bir delesyon[23] veya diğer nokta mutasyonları nedeniyle (sıklıkla SMA ile sonuçlanan) mutasyona uğrar. SMN1 dizisinin SMN2'ye fonksiyonel dönüşümü). Bununla birlikte, hemen hemen tüm insanlar, SMN proteininin normal seviyesinin %10-20'sini kodlayan ve bazı nöronların hayatta kalmasına izin veren SMN2 geninin en az bir işlevsel kopyasına (çoğunda 2-4 tanesine) sahiptir. Bununla birlikte, uzun vadede, SMN proteininin azalan mevcudiyeti, omuriliğin ön boynuzu ve beyindeki motor nöron hücrelerinin kademeli olarak ölmesiyle sonuçlanır. Hepsi nöral girdi için bu motor nöronlara bağlı olan iskelet kasları artık azalmış innervasyona sahiptir ve bu nedenle merkezi sinir sisteminden (CNS) gelen girdi azalmıştır. Motor nöronlar yoluyla azaltılmış impuls iletimi, denerve kasın kasılma aktivitesinin azalmasına yol açar. Sonuç olarak, denerve kaslar progresif atrofiye uğrar.
Genellikle önce alt ekstremite, ardından üst ekstremite, omurga ve boyun kasları ve daha şiddetli vakalarda pulmoner ve çiğneme kasları etkilenir. Proksimal kaslarda etkilenme distal kaslardan genellikle daha erken ve daha fazladır.[24]
Semptomlarının şiddeti geniş ölçüde geri kalan SMN2 genlerinin SMN1'in işlev kaybını ne kadar telafi edebildiği ile ilişkilidir. Bu durum kromozom üzerinde bulunan SMN2 geninin kopya sayısına da kısmen bağlı görünüyor. Sağlıklı bireyler genellikle iki SMN2 kopyası taşırken, SMA'lı kişilerde bunlardan 1 ile 5 arasında (veya daha fazla) bulunabilir; SMN2 kopyalarının sayısı ne kadar fazlaysa hastalık şiddeti o kadar hafiftir. Bu nedenle, çoğu SMA tip I bebeğin bir veya iki SMN2 kopyası; SMA II ve III'e sahip kişiler genellikle en az üç SMN2 kopyası; ve SMA IV'lü kişilerde normalde en az dördü vardır. Bununla birlikte, semptom şiddeti ile SMN2 kopya sayısı arasındaki korelasyon mutlak değil ve hastalık fenotipini etkileyen başka faktörler var gibi görünmektedir.[25]
Spinal müsküler atrofi, otozomal resesif bir modelde kalıtılır. Bozukluğun kalıtsal olarak alınması için her ebeveynden birer tane olmak üzere kusurlu genin iki kopyası gerekir: ebeveynler taşıyıcı olabilir ve kişisel olarak etkilenmemiş olabilir. SMA, vakaların yaklaşık %2-4'ünde de novo (yani, herhangi bir kalıtsal neden olmadan) ortaya çıkıyor gibi görünmektedir.
Spinal müsküler atrofi, orak hücre hastalığı ve kistik fibroz gibi diğer otozomal resesif hastalıkların aksine, tüm etnik gruplardan bireyleri etkiler. Tüm türlerde ve tüm etnik gruplarda SMA'nın genel yaygınlığı, yaklaşık 10.000 kişide 1 dir; gen frekansı 1:100 civarındadır, bu nedenle yaklaşık 50 kişiden biri taşıyıcıdır.[26][27] Taşıyıcı olmanın bilinen sağlık sonuçları yoktur. Kişi, yalnızca çocuğunun SMA'dan etkilenmesi veya SMN1 gen dizilimi yaptırması durumunda taşıyıcılık durumunu öğrenebilir.
Teşhis
[değiştir | kaynağı değiştir]SMA tanısı, vakaların %95'inden fazlasında SMN1 geninin silinmesini,[19] geri kalan hastalarda da bileşik bir SMN1 mutasyonunu saptayan genetik testle konur. Genetik test genellikle bir kan örneği kullanılarak gerçekleştirilir. MLPA klinik önemi olan SMN2 gen kopyalarının sayısını oluşturmaya da izin verdiği için daha sık kullanılan genetik test tekniklerinden biridir.[19]
SMAnın yalnızca paradoksal solunum, iki taraflı düşük kas tonusu ve tendon reflekslerinin olmadığı akut formu olan çocuklarda bir dereceye kadar semptomatik olarak, kesin teşhisi olanaklıdır.
Erken tanı
[değiştir | kaynağı değiştir]SMA'nın erken teşhisi, semptomların ortaya çıkmasını önlemek için yeterince erken nedensel tedavilerin uygulanmasına izin verir.
Preimplantasyon testi
[değiştir | kaynağı değiştir]Preimplantasyon genetik tanı, in vitro fertilizasyon sırasında embriyoyu taramada kullanılabilir.
Doğum öncesi testler
[değiştir | kaynağı değiştir]Koryon villus örnekleri, fetal DNA analizi ve diğer doğum öncesi testler mümkündür.
Yenidoğan taraması
[değiştir | kaynağı değiştir]SMA için rutin yenidoğan taraması, hastalığın asemptomatik aşamasında en etkili olan nedensel tedavilerin mevcudiyeti göz önüne alındığında, gelişmiş ülkelerde giderek yaygınlaşmaktadır.[28][29][30] 2018'de SMA için yenidoğan taraması, ABD'nin önerilen yenidoğan tarama testleri listesine[31][32][33] eklendi ve Nisan 2020 itibarıyla 39 ABD eyaletinde benimsendi.[34][35] Şubat 2023 itibarıyla SMA taraması, yaklaşık 15 ülkede ulusal yenidoğan tarama programlarına dahil edildi ve diğer ülkelerde pilot projeler devam etmektedir.[36]
Taşıyıcı testi
[değiştir | kaynağı değiştir]SMN1 silinmesi taşıyıcısı olma riski taşıyan ve dolayısıyla SMA'dan etkilenen yavru sahibi olma riski taşıyan kişiler, bir kan veya tükürük örneği kullanılarak taşıyıcı analizine tabi tutulabilir. American College of Obstetricians and Gynecologists, hamile kalmayı düşünen herkese taşıyıcı olup olmadıklarını anlamak için test yaptırmalarını öneriyor.[37] SMA'nın taşıyıcı sıklığı, talasemi gibi diğer bozukluklarla karşılaştırılabilir ve kuzey Hindistan'daki bir kohortta 38'de 1 olarak bulunmuştur.[38] Bununla birlikte, vakaların yaklaşık %2'sine de novo mutasyonlar neden olduğundan ve normal popülasyonun %5'inde aynı kromozom üzerinde SMN1'in iki kopyası bulunduğundan, genetik testler risk altındaki tüm bireyleri belirleyemez.[39][40]
Yönetim
[değiştir | kaynağı değiştir]SMA hastalığının yönetimi ciddiyet ve türüne göre değişir. En şiddetli formlarda (tip 0/1), bireyler hızlı müdahale gerektiren büyük kas zayıflığına sahiptir. En az şiddetli form tip 4/yetişkin başlangıçlı iken, bireyler bakımı yaşamlarının sonlarına kadar aramayabilirler. SMA türleri ve her türdeki bireylerin farklılıkları nedeniyle bakım değişir.
İlaç tedavisi
[değiştir | kaynağı değiştir]Nusinersen (Spinraza), spinal müsküler atrofiyi tedavi etmek için kullanılır.[41] SMN2 geninin alternatif eklenmesini modifiye eden bir antisens nükleotittir.[41] İntratekal bir enjeksiyon kullanılarak doğrudan Merkezî sinir sistemi verilir.[41][42] Nusinersen, SMA'lı bebeklerde hayatta kalma süresini uzatır ve motor fonksiyonlarını iyileştirir.[43][44] 2016'da ABD'de, 2017'de Avrupa Birliği'nde kullanılması onaylandı.[45][46][47]
Onasemnogene abeparvovec (Zolgensma), SMN1 transgenini iletmek için bir vektör olarak kendi kendini tamamlayan adeno-ilişkili virüs tip 9'u (scAAV-9) kullanan bir gen terapisi tedavisidir.[48][49] Terapi ilk olarak ABD'de Mayıs 2019'da 24 aylıktan küçük çocuklar için intravenöz bir formülasyon olarak onaylandı.[50] Bunu Avrupa Birliği, Japonya ve diğer ülkelerdeki onaylar izledi, ancak genellikle farklı onay kapsamları vardı.[51]
Risdiplam (Evrysdi), sıvı formda ağızdan alınan bir ilaçtır.[52] Bu bir piridazin türevidir ve SMN2 geni tarafından üretilen fonksiyonel hayatta kalan motor nöron proteininin miktarını, onun ekleme modelini değiştirerek arttırarak çalışır.[53][54] Risdiplam tıbbi kullanım için ilk olarak Ağustos 2020'de Amerika Birleşik Devletleri'nde ve o zamandan beri 30'dan fazla ülkede onaylandı.
Solunum
[değiştir | kaynağı değiştir]Solunum sistemi en sık etkilenen sistemdir ve SMA tip 0/1 ve 2'de önde gelen ölüm nedenidir. SMA tip 3, benzer solunum problemlerine sahip olabilir, ancak daha nadirdir. Sinirden uyarı gelmemesi nedeniyle kaburgalar arası kasların zayıflaması nedeniyle komplikasyonlar ortaya çıkar. Diyafram interkostal kaslardan daha az etkilenir.[24] Kaslar zayıfladığında, nefes alma ve öksürmede yardımcı olacak aynı işlevsel kapasiteyi asla tam olarak geri kazanamaz. Nefes almak zordur ve yeterli oksijen alamama ve hava yolu sekresyonlarının yetersiz temizlenmesi riski taşır. Bu sorunlar daha çok uyku sırasında ortaya çıkar. Farinksteki yutma kaslarının etkilenmesi aspirasyona yol açarak enfeksiyon / pnömoni olasılığını artırabilir.[55] Sekresyonların harekete geçirilmesi ve temizlenmesi, postüral drenaj ve manuel veya mekanik öksürme yardım cihazı ile manuel veya mekanik göğüs fizyoterapisini içerir. Nefes almaya yardımcı olmak için Non-invaziv ventilasyon (BiPAP) sıklıkla kullanılır ve daha ciddi vakalarda bazen trakeostomi yapılabilir;[56] trakeostomi konuşma gelişimini engellese de, her iki ventilasyon yöntemi de sağkalımı karşılaştırılabilir bir dereceye kadar uzatır.[57]
Beslenme
[değiştir | kaynağı değiştir]SMA şiddetliyse çene açma, çiğneme ve yutma güçlüğü gibi beslenme sorunları yaşanabilir. Bu tür güçlükleri olan bireyler, aşırı veya yetersiz beslenme, gelişememe ve aspirasyon riski altındadır. Diğer beslenme sorunları, özellikle ayaktan olmayan kişilerde (daha şiddetli SMA türleri), mideden yeterince hızlı geçmeyen yiyecekler, gastrik reflü, kabızlık, kusma ve şişkinliği içerir.[58] Bu nedenle, SMA tip I ve şiddetli tip II'ye sahip kişilerde beslenme tüpü veya gastrostomi gerekli olabilir.[58][59][60] Ek olarak, SMA'dan kaynaklanan metabolik anormallikler, kaslardaki yağ asitlerinin β-oksidasyonunu bozar ve açlıkta organik asidemi ve sonucunda kas hasarına yol açabilir.[61][62] SMA'lı kişilerin, özellikle hastalığın daha şiddetli formlarına sahip olanların, yağ alımını azaltmaları ve uzun süreli açlıktan kaçınmaları (yani, sağlıklı insanlardan daha sık yemek yemeleri)[63] ve aspirasyonu önlemek için daha yumuşak yiyecekleri seçmeleri önerilir.[55] Akut bir hastalık sırasında, özellikle çocuklarda, beslenme sorunları ortaya önce çıkabilir, mevcut bir sorunu şiddetlendirebilir ve ayrıca elektrolit ve kan şekeri bozuklukları gibi diğer sağlık sorunlarına neden olabilir.[64]
Ortopedi
[değiştir | kaynağı değiştir]Zayıf kaslarla ilişkili iskelet sorunları arasında sınırlı hareket açıklığına sahip eklemler, kalça çıkıkları, spinal deformite, osteopeni, kırık riskinde artış ve ağrı yer alır.[24] Omurga kasları gibi normalde eklemleri stabilize eden zayıf kaslar, kifoz ve/veya skolyoz gelişimine ve eklem kontraktürüne yol açar.[24] Omurga füzyonu bazen SMA I/II'li kişilerde, deforme olmuş bir omurganın akciğerler üzerindeki baskısını azaltmak için 8-10 yaşına geldiklerinde yapılır. Ayrıca hareketsiz bireyler, hareket cihazları üzerindeki postür ve pozisyon, hareket açıklığı egzersizleri ve kemik güçlendirme komplikasyonları önlemede önemli olabilir.[64] SMA'lı kişiler ayrıca çeşitli fizyoterapi ve mesleki terapi biçimlerinden büyük ölçüde faydalanabilir.
Ortotik cihazlar; vücudu desteklemek ve yürümeye yardımcı olmak için, örneğin ayağı stabilize etmek ve yürüyüşe yardımcı olmak için ayak bileği-ayak ortezleri gibi ortezler, gövdeyi stabilize etmek için torasik lomber sakral ortezler kullanılır. Yardımcı teknolojiler, hareketin ve günlük aktivitenin yönetilmesine yardımcı olabilir ve yaşam kalitesini büyük ölçüde artırabilir.
Diğer
[değiştir | kaynağı değiştir]Kalp rutin bir endişe konusu olmasa da, SMA ile belirli kalp rahatsızlıkları arasında bir bağlantı olduğu ileri sürülmüştür.[65][66][67][68]
SMA'lı çocuklar davranışlarında genel popülasyondan farklı değildir; bilişsel gelişimleri biraz daha hızlı olabilir ve zekalarının bazı yönleri ortalamanın üzerindedir.[69][70][71] Engellerine rağmen, SMA'dan etkilenen insanlar yaşamdan yüksek derecede memnuniyet bildirmektedir.[72]
SMA'da palyatif bakım Spinal Müsküler Atrofide Bakım Standardı Konsensüs Bildirgesi'nde[24] standardize edilmiştir.
Prognoz
[değiştir | kaynağı değiştir]Son zamanlarda, agresif ve proaktif destekleyici solunum ve beslenme desteği ile şiddetli SMA hastalarında sağ kalım artmıştır.[73]
Tedavi edilmediği takdirde, SMA tip 0 ve 1 teşhisi konulan çocukların çoğu 4 yaşına ulaşmıyor ve tekrarlayan solunum sorunları birincil ölüm nedeni oluyor.[74] Uygun bakım ile, daha "hafif SMA tip I vakaları" (tüm SMA1 vakalarının yaklaşık %10'unu oluşturur) yetişkinliğe kadar yaşar.[75] SMA tip I'de uzun süreli sağ kalım yeterince kanıtlanamadı, ancak 2007 itibarıyla solunum desteğindeki ilerlemeler ölüm oranını düşürmüş görünüyor.[76]
Tedavi edilmeyen SMA tip II'de hastalığın seyri daha yavaş olmakla birlikte yaşam beklentisi sağlıklı popülasyona göre daha azdır. 20 yaşından önce ölüm sıktır, ancak SMA'lı pek çok kişi ebeveyn ve büyükanne ve büyükbaba olmak için yaşamaktadır. SMA tip III, bakım standartlarına uyulduğu takdirde normal veya normale yakın yaşam beklentisine sahiptir. Tip IV, erişkin başlangıçlı SMA genellikle sadece hareket bozukluğu anlamına gelir ve yaşam beklentisini etkilemez.
Araştırma yönleri
[değiştir | kaynağı değiştir]SMA'nın altında yatan genetik neden 1995'te tanımlandığından,[22] öncelikle motor nöronlarda SMN proteininin mevcudiyetini artırmaya odaklanan birkaç terapötik yaklaşım önerilmiş ve araştırılmıştır.[77] Ana araştırma yönergeleri aşağıdaki gibidir:
SMN1 gen değişimi
[değiştir | kaynağı değiştir]SMA'da gen terapisi, bir viral vektör kullanılarak hücre çekirdeğine özel hazırlanmış nükleotit sekansı (bir SMN1 transgeni) sokarak SMN1 gen fonksiyonunu eski haline getirmeyi amaçlar. Bu yaklaşım, SMA için ilk onaylanmış gen terapisi olan scAAV -9 tabanlı tedavi onasemnogene abeparvovec tarafından kullanılmıştır.[78]
SMN2 alternatif ekleme modülasyonu
[değiştir | kaynağı değiştir]Bu yaklaşım, tam uzunluktaki SMN proteininin daha yüksek yüzdesini kodlamaya zorlamak için SMN2 geninin alternatif eklenmesini değiştirmeyi amaçlar. Bazen gen dönüşümü olarak da adlandırılır, çünkü SMN2 genini işlevsel olarak SMN1 genine dönüştürmeye çalışır. Onaylı ilaçlar olan nusinersen ve risdiplam'ın terapötik mekanizmasıdır.
Branaplam, klinik geliştirme aşamasına ulaşmış olan başka bir SMN2 ekleme modülatörüdür.[79]
Tarihsel olarak, bu araştırma yönü diğer molekülleri de araştırdı. Quinazoline495 olarak da bilinen RG3039, Repligen tarafından geliştirilen ve Mart 2014'te Pfizer'e lisanslanan ve yalnızca faz I denemelerini tamamladıktan kısa bir süre sonra durdurulan tescilli bir kinazolin türeviydi. PTK-SMA1, Paratek Pharmaceuticals tarafından geliştirilen ve 2013 yılında klinik geliştirmeye girmek üzere olan tetrasiklin grubunun tescilli bir küçük moleküllü ekleme modülatörüydü, ancak bu, Paratek'in o sırada küçülmesi nedeniyle asla gerçekleşmedi. Hoffmann-La Roche tarafından geliştirilen RG7800, faz I testinden geçen ancak hayvan toksisitesi nedeniyle durdurulan risdiplama benzer bir moleküldü.[80] İlk ipuçları arasında sodyum ortovanadat[81] ve aklarubisin de vardı.[82]
Nusinersen ile aynı hücresel hedefe sahip morfolino tipi antisens oligonükleotidler, University College London[83] ve Oxford Üniversitesi dahil olmak üzere SMA ve diğer tek gen hastalıklarının tedavisinde bir araştırma konusu olmaya devam etmektedir.[84]
SMN2 gen aktivasyonu
[değiştir | kaynağı değiştir]Bu yaklaşım, SMN2 geninin ekspresyonunu arttırmayı, böylece mevcut tam uzunluktaki SMN proteini miktarını arttırmayı amaçlar.
- Popüler bir astım ilacı olan oral salbutamol, hem in vitro[85] hem de SMA tip 2 ve 3 olan hastaları içeren üç küçük ölçekli klinik çalışmada[86][87][88] solunum faydaları yanında SMA'da terapötik potansiyel göstermiştir.
Birkaç bileşik başlangıçta umut vadetti, ancak klinik deneylerde etkinlik gösteremedi. Bütiratlar (sodyum bütirat ve sodyum fenilbütirat) in vitro çalışmalarda bir miktar umut vadetti[89][90][91] ancak semptomatik kişilerde yapılan bir klinik çalışma, etkinliklerini doğrulamadı.[92] Pre-semptomatik tip 1-2 bebeklerde yapılan başka bir klinik çalışma 2015 yılında tamamlandı, ancak herhangi bir sonuç yayınlanmadı.
- Valproik asit (VPA), in vitro araştırmalar orta derecede etkili olduğunu gösterdiği için 1990'lar ve 2000'lerde deneysel olarak SMA'da kullanıldı.[93][94] Bununla birlikte, büyük bir klinik deneye tabi tutulduğunda ulaşılabilir konsantrasyonlarda hiçbir etkinlik göstermedi.[95][96][97] SMA'lı kişilerin bir alt kümesinde etkili olabileceği, ancak diğerlerinde yağ asidi translokaz tarafından etkisinin baskılanabileceği de öne sürülmüştür.[98] Diğerleri bunun aslında SMA semptomlarını kötüleştirebileceğini iddia ediyor.[99] Uzun süreli kullanıma bağlı ciddi yan etki riski nedeniyle şu anda kullanılmamaktadır. 2019'da yapılan bir meta-analiz, VPA'nın fonksiyonel puanı iyileştirmeden bile fayda sağlayabileceğini öne sürdü.[100]
- Hidroksikarbamidin (hidroksiüre) fare modellerinde etkili olduğu gösterildi[101] ve daha sonra Novo Nordisk, Danimarka tarafından ticari olarak araştırıldı, ancak sonraki klinik deneylerde SMA'lı kişiler üzerinde hiçbir etki göstermedi.[102]
SMN2 aktivitesini in vitro artıran ancak klinik aşamaya ulaşmayan bileşikler arasında büyüme hormonu, çeşitli histon deasetilaz inhibitörleri,[103] benzamid M344,[104] hidroksamik asitler (CBHA, SBHA, entinostat, panobinostat,[105] trichostatin A,[106][107] vorinostat[108]), prolaktin[109] ve ayrıca resveratrol ve kurkumin gibi doğal polifenol bileşikleri bulunur.[110][111] Bir p38 yolağı aktivatörü olan selekoksib, tek bir hayvan çalışmasına dayalı olarak bazen SMA'lı kişiler tarafından etiket dışı olarak kullanılmaktadır,[112] ancak bu tür bir kullanım klinik aşamadaki araştırmalarla desteklenmemektedir.
SMN stabilizasyonu
[değiştir | kaynağı değiştir]SMN stabilizasyonu, SMN2 geni tarafından kodlanan kısa ömürlü kusurlu protein olan SMNΔ7 proteinini stabilize etmeyi amaçlar.[113]
Hiçbir bileşik klinik aşamaya götürülmemiştir. Aminoglikozidler, SMN protein kullanılabilirliğini arttırma kabiliyeti göstermiş,[114][115] Indoprofen, in vitro bazı umutlar vermiştir.[116]
Nöral koruma
[değiştir | kaynağı değiştir]Nöroprotektif ilaçlar, düşük seviyelerde SMN proteini ile bile motor nöronların hayatta kalmasını sağlamayı amaçlar.
- Olesoxime, Fransız şirketi Trophos tarafından geliştirilen ve daha sonra Hoffmann-La Roche tarafından satın alınan tescilli bir nöroprotektif bileşikti ve SMA tip 2 ve 3'ü olan kişilerin yer aldığı bir faz II klinik denemede dengeleyici etki gösterdi. Geliştirilmesi, nusinersen'den gelen rekabet ve açık etiketli bir uzatma denemesinden elde edilen yetersiz veriler nedeniyle 2018'de durduruldu.[117]
Etkinlik göstermeyen klinik olarak çalışılan bileşiklerden, tirotropin salgılayan hormon (TRH), açık etiketli kontrolsüz bir klinik çalışmada bir miktar umut vadetti,[118][119][120] ancak daha sonraki bir çift kör plaseboda etkili olduğunu kanıtlamadı. kontrollü deneme[121] Amyotrofik lateral sklerozda sınırlı klinik fayda sunan bir ilaç olan Riluzole'ün benzer şekilde SMA'da test edilmesi önerildi;[122][123] ancak, SMA tip 2 ve 3'te 2008-2010'da yapılan bir çalışma, tatmin edici sonuçların olmaması nedeniyle erken durduruldu.[124] İn vitro araştırmalarda bir miktar nöroprotektif etki sergileyen ancak in vivo araştırmalara hiç geçmeyen diğer bileşikler arasında β-laktam antibiyotikler (örn. seftriakson)[125][126] ve follistatin yer alır.[127]
Kas restorasyonu
[değiştir | kaynağı değiştir]Bu yaklaşım, SMA' tedavisi için nöronlar yerine kas dokusunu hedefler.
- Reldesemtiv (CK-2127107, CK-107), Cytokinetics tarafından Astellas ile işbirliği içinde geliştirilen bir iskelet troponin aktivatörüdür. İlaç, azaltılmış nöral sinyallemeye rağmen kas reaktivitesini artırmayı hedefliyor. Molekül, SMA tip 2, 3 ve 4'e sahip ergen ve yetişkinlerde faz II klinik çalışmasında bir miktar başarı gösterdi.[128]
- Apitegromab (SRK-015), iskelet kası proteini miyostatinin aktivasyonunu bloke eden ve böylece kas dokusu büyümesini destekleyen monoklonal bir antikordur. 2021 itibarıyla molekül, nusinersen ile tedavi edilen pediatrik ve yetişkin hastalarda deneysel bir ek tedavi olarak başarı gösterdi.[129]
- Hoffman-La Roche tarafından geliştirilen GYM329 (RO7204239), miyostatin aktivasyonunu bloke ederek apitegromab'a benzer şekilde çalışır. 2022 itibarıyla, 2-10 yaş arası SMA'lı ayaktan olmayan çocuklarda risdiplam ile birlikte klinik geliştirme sürecinden geçmektedir.[130]
Kök hücre tedavisi
[değiştir | kaynağı değiştir]Kök hücreler hiçbir zaman SMA için bilinen herhangi bir tedavinin bir parçasını oluşturmazken, genellikle gevşek düzenleyici denetime sahip ülkelerde bulunan bazı özel şirketler, SMA dahil çok çeşitli rahatsızlıklar için bir "tedavi" olarak medya aldatmacasından yararlanır.Tıbbi fikir birliği, bu tür prosedürlerin önemli riskler taşırken hiçbir klinik fayda sağlamadığı yönündedir, bu nedenle SMA'lı kişiler bunlara karşı tavsiyelerde bulunulmalıdır.[131][132] 2013-2014'te, İtalya'da az sayıda SMA1 çocuğu, Stamina dolandırıcılığının ardından mahkeme tarafından zorunlu kılınan kök hücre enjeksiyonları aldı, ancak tedavinin hiçbir etkisinin olmadığı bildirildi.[133][134]
Kayıtlar
[değiştir | kaynağı değiştir]Avrupa Birliği'nde SMA'lı kişiler, bilgilerini TREAT-NMD tarafından yönetilen kayıtlara girerek klinik araştırmalara katılabilirler.[135]
Ayrıca bakınız
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- ^ a b c "Spinal muscular atrophy". Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. 23 Ocak 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mayıs 2019.
- ^ a b c d e f "Spinal Muscular Atrophy". NORD (National Organization for Rare Disorders). 7 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mayıs 2019.
- ^ "Spinal muscular atrophy". nhs.uk (İngilizce). 23 Ekim 2017. 8 Mart 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Ekim 2020.
- ^ a b "Spinal muscular atrophy: MedlinePlus Genetics". medlineplus.gov (İngilizce). 4 Ekim 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Ekim 2020.
- ^ "Spinal Muscular Atrophy (SMA) | Boston Children's Hospital". www.childrenshospital.org. 7 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ekim 2020.
- ^ "FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality". FDA (İngilizce). 24 Mayıs 2019. 24 Mayıs 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mayıs 2019.
- ^ "Spinal Muscular Atrophy Fact Sheet | National Institute of Neurological Disorders and Stroke". NINDS. 5 Ocak 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mayıs 2019.
- ^ a b c d e "Spinal muscular atrophy". Genetics Home Reference (İngilizce). 15 Haziran 2010 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mayıs 2019.
- ^ a b c "Spinal Muscular Atrophy". NORD (National Organization for Rare Disorders). 7 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mayıs 2019.
- ^ a b c d "Spinal muscular atrophy". Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. 23 Ocak 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mayıs 2019.
- ^ "Spinal Muscular Atrophy – Conditions | Children's National". childrensnational.org. 22 Eylül 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ekim 2020.
- ^ a b c Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E., (Ed.) (1993), "Spinal Muscular Atrophy", GeneReviews®, Seattle (WA): University of Washington, Seattle, PMID 20301526, 27 Kasım 2020 tarihinde kaynağından arşivlendi, erişim tarihi: 25 Ekim 2020
- ^ Verhaart (July 2017). "A multi-source approach to determine SMA incidence and research ready population". Journal of Neurology (İngilizce). 264 (7): 1465-1473. doi:10.1007/s00415-017-8549-1. ISSN 0340-5354. PMC 5502065 $2. PMID 28634652.
- ^ a b c d "Ramblings in the history of spinal muscular atrophy". Neuromuscular Disorders (İngilizce). 19 (1): 69-73. 2009. doi:10.1016/j.nmd.2008.10.004. PMID 18951794. 28 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Nisan 2023. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "The Hammersmith functional motor scale for children with spinal muscular atrophy: a scale to test ability and monitor progress in children with limited ambulation". European Journal of Paediatric Neurology. 7 (4): 155-9. 2003. doi:10.1016/S1090-3798(03)00060-6. PMID 12865054.
- ^ "A modified Hammersmith functional motor scale for use in multi-center research on spinal muscular atrophy". Neuromuscular Disorders. 16 (7): 417-26. July 2006. doi:10.1016/j.nmd.2006.03.015. PMC 3260054 $2. PMID 16750368.
- ^ "An expanded version of the Hammersmith Functional Motor Scale for SMA II and III patients". Neuromuscular Disorders. 17 (9–10): 693-7. October 2007. doi:10.1016/j.nmd.2007.05.009. PMID 17658255.
- ^ "Validation of the Expanded Hammersmith Functional Motor Scale in spinal muscular atrophy type II and III". Journal of Child Neurology. 26 (12): 1499-507. December 2011. doi:10.1177/0883073811420294. PMID 21940700.
- ^ a b c "Chapter 1". Spinal Muscular Atrophy: Disease Mechanisms. Elsevier. 2017. ISBN 978-0-12-803685-3.
- ^ "Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2–13.3". Nature. 344 (6266): 540-1. April 1990. doi:10.1038/344540a0. PMID 2320125.
- ^ "Spinal muscular atrophy". Genetics Home Reference. 15 Haziran 2010 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Mayıs 2019.
- ^ a b "Identification and characterization of a spinal muscular atrophy-determining gene". Cell. 80 (1): 155-65. January 1995. doi:10.1016/0092-8674(95)90460-3. PMID 7813012.
- ^ "Antisense oligonucleotides delivered to the mouse CNS ameliorate symptoms of severe spinal muscular atrophy". Science Translational Medicine. 3 (72): 72ra18. March 2011. doi:10.1126/scitranslmed.3001777. PMC 3140425 $2. PMID 21368223.
- ^ a b c d e "Consensus statement for standard of care in spinal muscular atrophy". Journal of Child Neurology. 22 (8): 1027-49. August 2007. doi:10.1177/0883073807305788. PMID 17761659.
- ^ "Phenotype modifiers of spinal muscular atrophy: the number of SMN2 gene copies, deletion in the NAIP gene and probably gender influence the course of the disease". Acta Biochimica Polonica. 56 (1): 103-8. 2009. doi:10.18388/abp.2009_2521. PMID 19287802.
- ^ "Carrier screening for spinal muscular atrophy (SMA) in 107,611 pregnant women during the period 2005–2009: a prospective population-based cohort study". PLOS ONE. 6 (2): e17067. February 2011. doi:10.1371/journal.pone.0017067. PMC 3045421 $2. PMID 21364876.
- ^ "Pan-ethnic carrier screening and prenatal diagnosis for spinal muscular atrophy: clinical laboratory analysis of >72,400 specimens". European Journal of Human Genetics. 20 (1): 27-32. January 2012. doi:10.1038/ejhg.2011.134. PMC 3234503 $2. PMID 21811307.
- ^ "Perspectives in genetic counseling for spinal muscular atrophy in the new therapeutic era: early pre-symptomatic intervention and test in minors". European Journal of Human Genetics. 27 (12): 1774-1782. December 2019. doi:10.1038/s41431-019-0415-4. PMC 6871529 $2. PMID 31053787.
- ^ "Treatment Algorithm for Infants Diagnosed with Spinal Muscular Atrophy through Newborn Screening". Journal of Neuromuscular Diseases. 5 (2): 145-158. 29 Mayıs 2018. doi:10.3233/JND-180304. PMC 6004919 $2. PMID 29614695.
- ^ "244th ENMC international workshop: Newborn screening in spinal muscular atrophy May 10-12, 2019, Hoofdorp, The Netherlands". Neuromuscular Disorders. 30 (1): 93-103. January 2020. doi:10.1016/j.nmd.2019.11.002. PMID 31882184.
- ^ "SMA Added to List of Recommended Screenings for Disease Given to..." SMA News Today (İngilizce). 16 Temmuz 2018. 12 Mayıs 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Mayıs 2020. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "SMA Added to National List of Disorders to Screen for at Birth". Muscular Dystrophy Association (İngilizce). 5 Temmuz 2018. 26 Temmuz 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Mayıs 2020. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Recommended Uniform Screening Panel". Official web site of the U.S. Health Resources & Services Administration (İngilizce). 3 Temmuz 2017. 27 Mayıs 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Mayıs 2020.
- ^ "Newborn Screening for Spinal Muscular Atrophy". Cure SMA (İngilizce). 14 Ocak 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 4 Mayıs 2020. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Pilot study of population-based newborn screening for spinal muscular atrophy in New York state". Genetics in Medicine. 20 (6): 608-613. June 2018. doi:10.1038/gim.2017.152. PMID 29758563.
- ^ "SMA Newborn Screening Alliance – SMA: Test at birth, save a life" (İngilizce). 11 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Şubat 2023.
- ^ "Carrier Screening in the Age of Genomic Medicine – ACOG". www.acog.org. 25 Şubat 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Şubat 2017.
- ^ "Carrier frequency of SMN1 related spinal muscular atrophy in north Indian population: The need for population based screening program". American Journal of Medical Genetics Part A. 185 (1): 274-277. October 2020. doi:10.1002/ajmg.a.61918. PMID 33051992.
- ^ "Carrier screening for spinal muscular atrophy". Genetics in Medicine. 10 (11): 840-2. November 2008. doi:10.1097/GIM.0b013e318188d069. PMC 3110347 $2. PMID 18941424.
- ^ "Spinal muscular atrophy carriers with two SMN1 copies". Brain & Development. 39 (10): 851-860. November 2017. doi:10.1016/j.braindev.2017.06.002. PMID 28676237.
- ^ a b c "Spinraza- nusinersen injection, solution". DailyMed. 30 Haziran 2020. 24 Eylül 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ağustos 2020.
- ^ "Surprise Drug Approval Is Holiday Gift for Biogen". The Wall Street Journal. 27 Aralık 2016. ISSN 0099-9660. 8 Kasım 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Aralık 2016. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy". New England Journal of Medicine. 377 (18): 1723-32. November 2017. doi:10.1056/NEJMoa1702752. PMID 29091570. 26 Nisan 2023 tarihinde kaynağından arşivlendi.
- ^ Wadman (1 Haziran 2020). "Drug treatment for spinal muscular atrophy types II and III". The Cochrane Database of Systematic Reviews. 1 (1): CD006282. doi:10.1002/14651858.CD006282.pub5. ISSN 1469-493X. PMC 6995983 $2. PMID 32006461.
- ^ "Spinraza (nusinersen) Injection". U.S. Food and Drug Administration (FDA). 18 Ocak 2017. 26 Mart 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ağustos 2020.
- ^ "Spinraza EPAR". European Medicines Agency (EMA). 2 Ekim 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ağustos 2020.
- ^ "Spinraza (Nusinersen) Approved in the European Union as First Treatment for Spinal Muscular Atrophy". Agence France-Presse (AFP). 1 Haziran 2017. 4 Haziran 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Haziran 2017.
- ^ "Zolgensma 2 x 1013 vector genomes/mL solution for infusion". www.medicines.org.uk. 28 Ekim 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ağustos 2020.
- ^ "Zolgensma- onasemnogene abeparvovec-xioi kit". DailyMed. 24 Mayıs 2019. 19 Kasım 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ağustos 2020.
- ^ "Zolgensma". U.S. Food and Drug Administration (FDA). 24 Mayıs 2019. 5 Temmuz 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ağustos 2020.
- ^ "Zolgensma EPAR". European Medicines Agency (EMA). 24 Mart 2020. 5 Haziran 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ağustos 2020.
- ^ "Evrysdi (risdiplam) for oral solution" (PDF). Genentech. 18 Ağustos 2020 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 8 Ağustos 2020.
- ^ Maria Joao Almeida (8 Eylül 2016). "RG7916". BioNews Services. 13 Eylül 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Ekim 2017.
- ^ "Pharmacokinetics, pharmacodynamics, and efficacy of a small-molecule SMN2 splicing modifier in mouse models of spinal muscular atrophy". Human Molecular Genetics. 25 (10): 1885-1899. May 2016. doi:10.1093/hmg/ddw062. PMC 5062580 $2. PMID 26931466.
- ^ a b "Spinal Muscular Atrophy". uptodate.com. November 2017. 6 Aralık 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Aralık 2017. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Spinal muscular atrophy type 1: A noninvasive respiratory management approach". Chest. 117 (4): 1100-5. April 2000. doi:10.1378/chest.117.4.1100. PMID 10767247.
- ^ "Long-term survival in Werdnig-Hoffmann disease". American Journal of Physical Medicine & Rehabilitation. 86 (5): 339-45 quiz 346-8, 379. May 2007. doi:10.1097/PHM.0b013e31804a8505. PMID 17449977.
- ^ a b "Feeding problems and malnutrition in spinal muscular atrophy type II". Neuromuscular Disorders. 18 (5): 389-93. May 2008. doi:10.1016/j.nmd.2008.02.008. PMID 18420410.
- ^ "Prevalence and risk factors for feeding and swallowing difficulties in spinal muscular atrophy types II and III". The Journal of Pediatrics. 160 (3): 447-451.e1. March 2012. doi:10.1016/j.jpeds.2011.08.016. PMID 21924737.
- ^ "Nutrition and swallowing in pediatric neuromuscular patients". Seminars in Pediatric Neurology. 5 (2): 106-15. June 1998. doi:10.1016/S1071-9091(98)80026-0. PMID 9661244.
- ^ "Fatty acid oxidation abnormalities in childhood-onset spinal muscular atrophy: primary or secondary defect(s)?". Pediatric Neurology. 12 (1): 21-30. January 1995. doi:10.1016/0887-8994(94)00100-G. PMID 7748356.
- ^ "Abnormal fatty acid metabolism in childhood spinal muscular atrophy". Annals of Neurology. 45 (3): 337-43. March 1999. doi:10.1002/1531-8249(199903)45:3<337::AID-ANA9>3.0.CO;2-U. PMID 10072048.
- ^ "Nutrition issues associated with spinal muscular atrophy". Nutrition & Dietetics. 60 (2): 92-96. 2003.
- ^ a b "SMA CARE SERIES – Musculoskeletal System" (PDF). www.curesma.org. Yaz 2017. 19 Şubat 2018 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 7 Aralık 2017. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Congenital heart disease is a feature of severe infantile spinal muscular atrophy". Journal of Medical Genetics. 45 (10): 635-8. October 2008. doi:10.1136/jmg.2008.057950. PMID 18662980.
- ^ "Arrhythmia and cardiac defects are a feature of spinal muscular atrophy model mice". Human Molecular Genetics. 19 (20): 3906-18. October 2010. doi:10.1093/hmg/ddq330. PMC 2947406 $2. PMID 20693262.
- ^ "Cardiac defects contribute to the pathology of spinal muscular atrophy models". Human Molecular Genetics. 19 (20): 4059-71. October 2010. doi:10.1093/hmg/ddq329. PMID 20696672.
- ^ "Early heart failure in the SMNDelta7 model of spinal muscular atrophy and correction by postnatal scAAV9-SMN delivery". Human Molecular Genetics. 19 (20): 3895-905. October 2010. doi:10.1093/hmg/ddq300. PMC 2947399 $2. PMID 20639395.
- ^ "Intelligence and cognitive function in children and adolescents with spinal muscular atrophy". Neuromuscular Disorders. 12 (2): 130-6. February 2002. doi:10.1016/S0960-8966(01)00274-7. PMID 11738354.
- ^ "Cognitive functions in Duchenne muscular dystrophy: a reappraisal and comparison with spinal muscular atrophy". Neuromuscular Disorders. 2 (5–6): 371-8. 1992. doi:10.1016/S0960-8966(06)80008-8. PMID 1300185.
- ^ "Behavioural problems in children and adolescents with spinal muscular atrophy and their siblings". Developmental Medicine and Child Neurology. 45 (1): 44-9. January 2003. doi:10.1017/S0012162203000082. PMID 12549754.
- ^ "Self-reported quality of life has no correlation with functional status in children and adolescents with spinal muscular atrophy". European Journal of Paediatric Neurology. 15 (1): 36-9. January 2011. doi:10.1016/j.ejpn.2010.07.003. PMID 20800519.
- ^ Spinal Muscular Atrophy. United Kingdom, United States: Elsevier. 2017. s. 417. ISBN 978-0-12-803685-3.
- ^ "Laparoscopic Nissen fundoplication during gastrostomy tube placement and noninvasive ventilation may improve survival in type I and severe type II spinal muscular atrophy". Journal of Child Neurology. 22 (6): 727-31. June 2007. doi:10.1177/0883073807304009. PMID 17641258.
- ^ "Medical considerations of long-term survival of Werdnig-Hoffmann disease". American Journal of Physical Medicine & Rehabilitation. 86 (5): 349-55. May 2007. doi:10.1097/PHM.0b013e31804b1d66. PMID 17449979.
- ^ "The changing natural history of spinal muscular atrophy type 1". Neurology. 69 (20): 1931-6. November 2007. doi:10.1212/01.wnl.0000290830.40544.b9. PMID 17998484.
- ^ "Spinal Muscular Atrophy Therapeutics: Where do we Stand?". Neurotherapeutics. 12 (2): 303-16. April 2015. doi:10.1007/s13311-015-0337-y. PMC 4404440 $2. PMID 25631888.
- ^ "$2.1m Novartis gene therapy to become world's most expensive drug". The Guardian. Reuters. 25 Mayıs 2019. ISSN 0261-3077.
- ^ "Novartis Releases Update on LMI070 (Branaplam) Clinical Trial". CureSMA. 25 Kasım 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Ekim 2017.
- ^ Kletzl (2019). "The oral splicing modifier RG7800 increases full length survival of motor neuron 2 mRNA and survival of motor neuron protein: Results from trials in healthy adults and patients with spinal muscular atrophy". Neuromuscular Disorders. Elsevier BV. 29 (1): 21-29. doi:10.1016/j.nmd.2018.10.001. ISSN 0960-8966. PMID 30553700.
- ^ "An in vivo reporter system for measuring increased inclusion of exon 7 in SMN2 mRNA: potential therapy of SMA". Gene Therapy. 8 (20): 1532-8. October 2001. doi:10.1038/sj.gt.3301550. PMID 11704813.
- ^ "Aclarubicin treatment restores SMN levels to cells derived from type I spinal muscular atrophy patients". Human Molecular Genetics. 10 (24): 2841-9. November 2001. doi:10.1093/hmg/10.24.2841. PMID 11734549.
- ^ "Repeated low doses of morpholino antisense oligomer: an intermediate mouse model of spinal muscular atrophy to explore the window of therapeutic response". Human Molecular Genetics. 24 (22): 6265-77. November 2015. doi:10.1093/hmg/ddv329. PMC 4614699 $2. PMID 26264577.
- ^ "Systemic peptide-mediated oligonucleotide therapy improves long-term survival in spinal muscular atrophy". Proceedings of the National Academy of Sciences of the United States of America. 113 (39): 10962-7. September 2016. doi:10.1073/pnas.1605731113. PMC 5047168 $2. PMID 27621445.
- ^ "Salbutamol increases SMN mRNA and protein levels in spinal muscular atrophy cells". Journal of Medical Genetics. 45 (1): 29-31. January 2008. doi:10.1136/jmg.2007.051177. PMID 17932121.
- ^ "Daily salbutamol in young patients with SMA type II". Neuromuscular Disorders. 18 (7): 536-40. July 2008. doi:10.1016/j.nmd.2008.05.004. PMID 18579379.
- ^ "Salbutamol increases survival motor neuron (SMN) transcript levels in leucocytes of spinal muscular atrophy (SMA) patients: relevance for clinical trial design" (PDF). Journal of Medical Genetics. 47 (12): 856-8. December 2010. doi:10.1136/jmg.2010.080366. PMID 20837492. 10 Mart 2022 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 26 Nisan 2023.
- ^ "P.6.4 Salbutamol tolerability and efficacy in adult type III SMA patients: Results of a multicentric, molecular and clinical, double-blind, placebo-controlled study". Neuromuscular Disorders. 23 (9–10): 771. 2013. doi:10.1016/j.nmd.2013.06.475.
- ^ "Treatment of spinal muscular atrophy by sodium butyrate". Proceedings of the National Academy of Sciences of the United States of America. 98 (17): 9808-13. August 2001. doi:10.1073/pnas.171105098. PMC 55534 $2. PMID 11504946.
- ^ "Phenylbutyrate increases SMN expression in vitro: relevance for treatment of spinal muscular atrophy". European Journal of Human Genetics. 12 (1): 59-65. January 2004. doi:10.1038/sj.ejhg.5201102. PMID 14560316.
- ^ "Phenylbutyrate increases SMN gene expression in spinal muscular atrophy patients". European Journal of Human Genetics. 13 (2): 256-9. February 2005. doi:10.1038/sj.ejhg.5201320. PMID 15523494.
- ^ "Randomized, double-blind, placebo-controlled trial of phenylbutyrate in spinal muscular atrophy". Neurology. 68 (1): 51-5. January 2007. doi:10.1212/01.wnl.0000249142.82285.d6. PMID 17082463.
- ^ "Valproic acid increases the SMN2 protein level: a well-known drug as a potential therapy for spinal muscular atrophy". Human Molecular Genetics. 12 (19): 2481-9. October 2003. doi:10.1093/hmg/ddg256. PMID 12915451.
- ^ "Multiple therapeutic effects of valproic acid in spinal muscular atrophy model mice". Journal of Molecular Medicine. 86 (11): 1243-54. November 2008. doi:10.1007/s00109-008-0388-1. PMID 18649067.
- ^ "SMA CARNI-VAL trial part I: double-blind, randomized, placebo-controlled trial of L-carnitine and valproic acid in spinal muscular atrophy". PLOS ONE. 5 (8): e12140. August 2010. doi:10.1371/journal.pone.0012140. PMC 2924376 $2. PMID 20808854.
- ^ "SMA CARNIVAL TRIAL PART II: a prospective, single-armed trial of L-carnitine and valproic acid in ambulatory children with spinal muscular atrophy". PLOS ONE. 6 (7): e21296. 2011. doi:10.1371/journal.pone.0021296. PMC 3130730 $2. PMID 21754985.
- ^ "Evaluation of muscle strength and motor abilities in children with type II and III spinal muscle atrophy treated with valproic acid". BMC Neurology. 11: 36. March 2011. doi:10.1186/1471-2377-11-36. PMC 3078847 $2. PMID 21435220.
- ^ "VPA response in SMA is suppressed by the fatty acid translocase CD36". Human Molecular Genetics. 22 (2): 398-407. January 2013. doi:10.1093/hmg/dds437. PMID 23077215.
- ^ "Valproic acid blocks excitability in SMA type I mouse motor neurons". Neurobiology of Disease. 36 (3): 477-87. December 2009. doi:10.1016/j.nbd.2009.08.014. PMID 19733665.
- ^ "Efficacy and Safety of Valproic Acid for Spinal Muscular Atrophy: A Systematic Review and Meta-Analysis". CNS Drugs. 33 (3): 239-250. March 2019. doi:10.1007/s40263-019-00606-6. PMID 30796634.
- ^ "Hydroxyurea enhances SMN2 gene expression in spinal muscular atrophy cells". Annals of Neurology. 58 (2): 194-202. August 2005. doi:10.1002/ana.20548. PMID 16049920.
- ^ "Randomized, double-blind, placebo-controlled trial of hydroxyurea in spinal muscular atrophy". Neurology. 75 (24): 2190-7. December 2010. doi:10.1212/WNL.0b013e3182020332. PMID 21172842.
- ^ "Differential regulation of the SMN2 gene by individual HDAC proteins". Biochemical and Biophysical Research Communications. 414 (1): 25-30. October 2011. doi:10.1016/j.bbrc.2011.09.011. PMC 6538936 $2. PMID 21925145.
- ^ "The benzamide M344, a novel histone deacetylase inhibitor, significantly increases SMN2 RNA/protein levels in spinal muscular atrophy cells". Human Genetics. 120 (1): 101-10. August 2006. doi:10.1007/s00439-006-0186-1. PMID 16724231.
- ^ "LBH589 induces up to 10-fold SMN protein levels by several independent mechanisms and is effective even in cells from SMA patients non-responsive to valproate". Human Molecular Genetics. 18 (19): 3645-58. October 2009. doi:10.1093/hmg/ddp313. PMID 19584083.
- ^ "Sustained improvement of spinal muscular atrophy mice treated with trichostatin A plus nutrition". Annals of Neurology. 64 (4): 465-70. October 2008. doi:10.1002/ana.21449. PMID 18661558.
- ^ "Trichostatin A increases SMN expression and survival in a mouse model of spinal muscular atrophy". The Journal of Clinical Investigation. 117 (3): 659-71. March 2007. doi:10.1172/JCI29562. PMC 1797603 $2. PMID 17318264.
- ^ "SAHA ameliorates the SMA phenotype in two mouse models for spinal muscular atrophy". Human Molecular Genetics. 19 (8): 1492-506. April 2010. doi:10.1093/hmg/ddq023. PMID 20097677.
- ^ "Prolactin increases SMN expression and survival in a mouse model of severe spinal muscular atrophy via the STAT5 pathway". The Journal of Clinical Investigation. 121 (8): 3042-50. August 2011. doi:10.1172/JCI46276. PMC 3148738 $2. PMID 21785216.
- ^ "Induction of full-length survival motor neuron by polyphenol botanical compounds". Human Genetics. 122 (6): 635-43. January 2008. doi:10.1007/s00439-007-0441-0. PMID 17962980.
- ^ "Histone deacetylase inhibition activity and molecular docking of (e )-resveratrol: its therapeutic potential in spinal muscular atrophy". Chemical Biology & Drug Design. 73 (3): 355-64. March 2009. doi:10.1111/j.1747-0285.2009.00781.x. PMID 19207472.
- ^ "Celecoxib increases SMN and survival in a severe spinal muscular atrophy mouse model via p38 pathway activation". Human Molecular Genetics. 22 (17): 3415-24. September 2013. doi:10.1093/hmg/ddt191. PMID 23656793.
- ^ "Regulation of SMN protein stability". Molecular and Cellular Biology. 29 (5): 1107-15. March 2009. doi:10.1128/MCB.01262-08. PMC 2643817 $2. PMID 19103745.
- ^ "Novel aminoglycosides increase SMN levels in spinal muscular atrophy fibroblasts". Human Genetics. 120 (4): 589-601. November 2006. doi:10.1007/s00439-006-0245-7. PMID 16951947.
- ^ "Subcutaneous administration of TC007 reduces disease severity in an animal model of SMA". BMC Neuroscience. 10: 142. November 2009. doi:10.1186/1471-2202-10-142. PMC 2789732 $2. PMID 19948047.
- ^ "Indoprofen upregulates the survival motor neuron protein through a cyclooxygenase-independent mechanism". Chemistry & Biology. 11 (11): 1489-93. November 2004. doi:10.1016/j.chembiol.2004.08.024. PMC 3160629 $2. PMID 15555999.
- ^ "Roche scraps €120M SMA drug after hitting 'many difficulties'". www.fiercebiotech.com. 1 Haziran 2018. 12 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Haziran 2018. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ "Efficacy of thyrotropin-releasing hormone in the treatment of spinal muscular atrophy". Journal of Child Neurology. 9 (3): 287-9. July 1994. doi:10.1177/088307389400900313. PMID 7930408.
- ^ "A study of thyrotropin-releasing hormone for the treatment of spinal muscular atrophy: a preliminary report". American Journal of Physical Medicine & Rehabilitation. 79 (5): 435-40. 2000. doi:10.1097/00002060-200009000-00005. PMID 10994885.
- ^ "Oral administration of the thyrotropin-releasing hormone (TRH) analogue, taltireline hydrate, in spinal muscular atrophy". Journal of Child Neurology. 24 (8): 1010-2. August 2009. doi:10.1177/0883073809333535. PMID 19666885.
- ^ "Drug treatment for spinal muscular atrophy type I". Cochrane Database of Systematic Reviews. John Wiley & Sons, Ltd (12): CD006281. 7 Aralık 2011. doi:10.1002/14651858.cd006281.pub3. PMID 22161399.
- ^ "Riluzole attenuates spinal muscular atrophy disease progression in a mouse model". Muscle & Nerve. 28 (4): 432-7. October 2003. doi:10.1002/mus.10455. PMID 14506714.
- ^ "The neuroprotective drug riluzole acts via small conductance Ca2+-activated K+ channels to ameliorate defects in spinal muscular atrophy models". The Journal of Neuroscience. 33 (15): 6557-62. April 2013. doi:10.1523/JNEUROSCI.1536-12.2013. PMC 3652322 $2. PMID 23575853.
- ^ "Riluzole: premiers résultats décevants" (Fransızca). AFM Téléthon. 22 Eylül 2010. 8 Aralık 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Mart 2017.
- ^ "Beta-lactam antibiotic offers neuroprotection in a spinal muscular atrophy model by multiple mechanisms" (PDF). Experimental Neurology. 229 (2): 214-25. June 2011. doi:10.1016/j.expneurol.2011.01.017. PMID 21295027. 29 Ağustos 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 26 Nisan 2023.
- ^ "The protective effects of β-lactam antibiotics in motor neuron disorders". Experimental Neurology. 231 (1): 14-8. September 2011. doi:10.1016/j.expneurol.2011.06.002. PMID 21693120.
- ^ "Delivery of recombinant follistatin lessens disease severity in a mouse model of spinal muscular atrophy". Human Molecular Genetics. 18 (6): 997-1005. March 2009. doi:10.1093/hmg/ddn426. PMC 2649020 $2. PMID 19074460.
- ^ "CK-2127107". 16 Ekim 2014 tarihinde kaynağından arşivlendi.
- ^ "Scholar Rock Announces Positive 12-Month Top-Line Results From the TOPAZ Phase 2 Clinical Trial Evaluating Apitegromab in Patients With Type 2 and Type 3 Spinal Muscular Atrophy (SMA)". www.businesswire.com (İngilizce). 6 Nisan 2021. 6 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Mayıs 2021.
- ^ "Pediatric Phase 2/3 Trial to Test Anti-myostatin Antibody with Evrysdi" (İngilizce). 26 Ekim 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Ocak 2022. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Committee for Advanced Therapies and CAT Scientific Secretariat (August 2010). "Use of unregulated stem-cell based medicinal products". Lancet. 376 (9740): 514. doi:10.1016/S0140-6736(10)61249-4. PMID 20709228.
- ^ European Medicines Agency (16 Nisan 2010). "Concerns over unregulated medicinal products containing stem cells" (PDF). European Medicines Agency. 28 Aralık 2013 tarihinde kaynağından (PDF) arşivlendi.
- ^ "Stem cells in severe infantile spinal muscular atrophy (SMA1)". Neuromuscular Disorders. 22 (11): 1032-4. November 2012. doi:10.1016/j.nmd.2012.09.005. PMID 23046997.
- ^ "Stem cells in severe infantile spinal muscular atrophy". Neuromuscular Disorders. 22 (12): 1105. December 2012. doi:10.1016/j.nmd.2012.11.001. PMID 23206850.
- ^ "National registries for DMD, SMA and DM". 22 Ocak 2011 tarihinde kaynağından arşivlendi.
