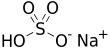Sodyum bisülfat
| |||

| |||
| Adlandırmalar | |||
|---|---|---|---|
Sodyum hidrojen sülfat | |||
Diğer adlar Sodyum asit sülfat | |||
| Tanımlayıcılar | |||
| |||
3D model (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.028.787 | ||
| EC Numarası |
| ||
| E numaraları | E514(ii) (asitliği düzenleyiciler, ...) | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Molekül formülü | NaHSO4 | ||
| Molekül kütlesi | 120.06 gr/mol (susuz) 138.07 gr/mol (monohidrat) | ||
| Görünüm | beyaz katı | ||
| Yoğunluk | 2.742 gr/cm3 (susuz) 1.8 gr/cm3 (monohidrat) | ||
| Erime noktası | 58.5 °C (monohidrat) 315 °C (susuz) | ||
| Kaynama noktası | 315 °C'de Na2S2O7 + H2O) a bozunur | ||
| Çözünürlük (su içinde) | 28.5 gr/100 mL (25 °C) 100 gr/100 mL (100 °C) | ||
| Çözünürlük | amonyakda çözünmez; alkolde bozunur | ||
| Asitlik (pKa) | 1.99 | ||
| Yapı | |||
| triklinik (susuz) monoklinik (monohidrat) | |||
| Tehlikeler | |||
| GHS etiketleme sistemi: | |||
| Piktogramlar | 
| ||
| İşaret sözcüğü | Tehlike | ||
| R-ibareleri | R34 R37 R41 | ||
| G-ibareleri | S26 S36 S37 S39 S45 | ||
| Tehlike ifadeleri | H318 | ||
| Önlem ifadeleri | P280, P305+P351+P338 | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | Yanıcı değildir. | ||
| AB İndeksi | Aşındırıcı (C) | ||
| Güvenlik bilgi formu (SDS) | External MSDS | ||
| Benzeyen bileşikler | |||
Diğer anyonlar
|
Sodyum sülfat | ||
Diğer katyonlar
|
Potasyum bisülfat | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Sodyum bisülfat, diğer bir adı sodyum hidrojen sülfat (NaHSO4) olan bu kimyasal madde asit tuz karakterlidir. Kuru halde iken güvenli bir şekilde nakledilebilir ve depolanabilir. Susuz formu higroskopiktir. Sodyum bisülfat suda hidroliz olarak asidik çözelti verir. 1 Molarlık çözeltisinin pH değeri 1 den küçüktür. Sodyum bisülfat yavaşça ısıtılırsa suyunu kaybederek sodyum pirosülfata dönüşür.
- 2NaHSO4 → Na2S2O7 + H2O
Eğer ısıtma yüksek sıcaklıklarda yapılırsa sodyum sülfat ve kükürt trioksit oluşur.
- 2NaHSO4 → Na2SO4 + SO3 + H2O
Üretimi
[değiştir | kaynağı değiştir]Üretim yöntemlerinden ilki stokiyometrik miktardaki sodyum hidroksit ve sülfürik asit karışımının reaksiyonuna dayanır.[1] İki eşdeğer asit ve bir eşdeğer baz kullanılması ile sodyum bisülfat ve su oluşur.
- NaOH + H2SO4 → NaHSO4 + H2O
İkinci bir üretim yöntemi ise sodyum klorür (tuz) ve sülfürik asit arasında gerçekleşen reaksiyondur. Yüksek sıcaklıkta gerçekleşen bu reaksiyon sonucunda sodyum bisülfat ve hidrojen klorür gazı oluşur.
- NaCl + H2SO4 → NaHSO4 + HCl
Sıcak ve derişik sodyum bisülfat çözeltisi püskürtmek suretiyle soğutulduğunda katı kristalleri oluşturur. Hidrojen klorür gazı ise reaksiyonun yan ürünü olarak hidroklorik asit üretmek için suda çözülür.
Kullanımı
[değiştir | kaynağı değiştir]Sodyum bisülfat başlıca pH düşürmek için kullanılır. Teknik olarak uygulamalarda metal parlatma, temizlik ürünleri ve yüzme havuzlarındaki klorlama işleminin etkinliğini artırmak için gerekli olan suyun pH derecesini düşürmek amacıyla kullanılır. Sodyum bisülfat kedilerde idrar yolları taşlarını azaltmak amacıyla kedi mamalarında yem katkı maddesi olarak kullanılır. Besin kalitesindeki sodyum bisülfat meşrubatlar da dahil olmak üzere çeşitli yiyecek ürünlerinde, mayonezler ve soslar da kullanılmaktadır. Ayrıca et ve kümes hayvanlarının işlenmesinde, kesilmiş taze etlerin kararmasını önlemek için oldukça sık kullanılır.
Kuyumculuk da da kendine kullanım yeri bulan sodyum bisülfat, ısıtılan yüzeylerde oluşan oksit tabakasını kaldırmak için kullanılan birçok çözeltilerde yüzey temizleme amacıyla bulunan başlıca maddedir.
Kaynakça
[değiştir | kaynağı değiştir]- ^ Helmold Plessen (2000). "Sodium Sulfates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_355. ISBN 978-3527306732.