Klorik asit
| |

| |
Diğer adlar Klorik(V) asit | |
| Tanımlayıcılar | |
|---|---|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.029.303 |
| EC Numarası |
|
PubChem CID
|
|
| UNII | |
| UN numarası | 2626 |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
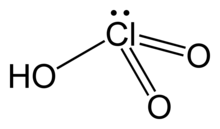
| Molekül formülü | HClO3 |
| Molekül kütlesi | 84.45914 g mol−1 |
| Görünüm | Renksiz çözelti |
| Yoğunluk | 1 g/mL, çözelti (yaklaşık) |
| Çözünürlük (su içinde) | >40 g/100 ml (20 °C) |
| Asitlik (pKa) | ~ −1 |
| Yapı | |
| piramidal | |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Oksitleyici, Aşındırıcı |
| GHS etiketleme sistemi: | |
| Piktogramlar |  
|
| İşaret sözcüğü | Tehlike |
| Tehlike ifadeleri | H271, H314 |
| Önlem ifadeleri | P210, P220, P221, P260, P264, P280, P283, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P306+P360, P310, P321, P363, P370+P378, P371+P380+P375, P405, P501 |
| NFPA 704 (yangın karosu) |
|
| Benzeyen bileşikler | |
Diğer anyonlar
|
bromik asit iyodik asit |
Diğer katyonlar
|
amonyum klorat sodyum klorat potasyum klorat |
Benzeyen bileşikler
|
hidroklorik asit hipokloröz asit kloröz asit perklorik asit |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.
Özellikler
[değiştir | kaynağı değiştir]Klorik asit, orantısızlık açısından termodinamik olarak kararsızdır.
Klorik asit, soğuk sulu çözeltide yaklaşık %30'luk bir konsantrasyona kadar kararlıdır ve %40'a kadar olan çözelti, indirgenmiş basınç altında dikkatlice buharlaştırmayla hazırlanabilir. Bu konsantrasyonların üzerinde, klorik asit çözeltileri, çeşitli ürünler verecek şekilde ayrışır, örneğin:
8 HClO3 → 4 HClO4 + 2 H2O + 2 Cl2 + 3 O2
3 HClO3 → HClO4 + H2O + 2 ClO2
Tehlikeler
[değiştir | kaynağı değiştir]Klorik asit güçlü bir oksitleyici ajandır. Çoğu organik ve yanıcı maddeler temas halinde alev alabilir.
Üretim
[değiştir | kaynağı değiştir]Sülfürik asidin baryum klorat ile reaksiyonu ile hazırlanabilir, çözünmeyen baryum sülfat çökeltme ile uzaklaştırılır:
Ba(ClO3)2 + H2SO4 → 2 HClO3 + BaSO4
Diğer bir yöntem ise, klorik asit ve hidrojen klorit üreten, hipokloröz asidin ısıtılmasıdır:
3 HClO → HClO3 + 2 HCl
Ayrıca bakınız
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- R. Bruce King, ed. (1994). "Chloric acid". Encyclopedia of Inorganic Chemistry. 2. Chichester: Wiley. p. 658. ISBN 0-471-93620-0.

