Periyodik asit
| |||
| |||
Diğer adlar Paraperiyodik asit İyodik(VII) asit Hidrojen periyodat | |||
| Tanımlayıcılar | |||
|---|---|---|---|
3D model (JSmol)
|
|||
| ECHA InfoCard | 100.030.839 | ||
PubChem CID
|
|||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
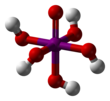
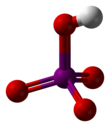
| Molekül formülü | H5IO6 (ortoperiyodik) HIO4 (metaperiyodik) | ||
| Molekül kütlesi | 227.941 g/mol (H5IO6) 190.91 g/mol (HIO4) | ||
| Görünüm | Renksiz kristal | ||
| Erime noktası | 128.5 C[1] | ||
| Çözünürlük (su içinde) | Alkollerde ve suda çözünür | ||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | Yanıcı, zehirli ve tahriş edici | ||
| GHS etiketleme sistemi: | |||
| R-ibareleri | R23, R24, R25, R34, R41 | ||
| NFPA 704 (yangın karosu) |
|||
| Güvenlik bilgi formu (SDS) | External MSDS | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Periyodik asit iyotun en yüksek oksoasitidir. Bütün periodatlar gibi iki form halinde var olur: H5IO6 formülü ile gösterilen ortoperiyodik asit ve HIO4 formüllü ile gösterilen metaperiyodik asit.
Periyodik asit Heinrich Gustav Magnus ve C. F. Ammermüller tarafından 1833 tarafından keşfedilmiştir.[2]
Sentezi[değiştir | kaynağı değiştir]
Modern endüstriyel ölçekli üretimi, PbO2 anotunun üzerinde, iyodik asitin elektrokimyasal oksidasyonunu aşağıdaki standart elektrot potansiyeli ile birlikte içerir:
- H5IO6 + H+ + 2 e− → IO-3 + 3 H2O E° = 1.6 V[3]
Ortoperiyodik asit metaperiyodik asit vermesi için 100 °C'de ısıtılarak dehidre edilebilir.
Daha ileri seviyede, 150 °C civarında, ısıtma umulan anhidrat diiyot heptaoksitin (I2O7) yerine iyot pentaoksiti (I2O5) verir. Metaperiyodik asit aynı zamanda çeşitli ortoperiyotadların nitrik asit ile işleminden de elde edilebilir.[4]
- H5IO6 → HIO4 + 2 H2O
Özellikleri[değiştir | kaynağı değiştir]
Ortoperiyodik asit çeşitli Ka değerlerine sahiptir.[5][6] Metaperiyodik asitin pKa değeri belirlenememiştir.
İki tür periyodik asitin varlığı iki tür periyodat tuzun oluşacağına da işarettir.
Kaynakça[değiştir | kaynağı değiştir]
- ^ Aylett, founded by A.F. Holleman ; continued by Egon Wiberg ; translated by Mary Eagleson, William Brewer ; revised by Bernhard J. (2001). Inorganic chemistry (1. English ed., [edited] by Nils Wiberg. bas.). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. s. 453. ISBN 0123526515.
- ^ Ammermüller, F.; Magnus, G. (1833). "Ueber eine neue Verbindung des Jods mit Sauerstoff, die Ueberjodsäure". Annalen der Physik und Chemie (Almanca). 104 (7). ss. 514-525. doi:10.1002/andp.18331040709.
- ^ Parsons, Roger (1959). Handbook of electrochemical constants. Butterworths Scientific Publications Ltd. s. 71.
- ^ Riley, edited by Georg Brauer; translated by Scripta Technica, Inc. Translation editor Reed F. (1963). Handbook of preparative inorganic chemistry. Volume 1 (2. bas.). New York, N.Y.: Academic Press. ss. 323-324. ISBN 012126601X.
- ^ Aylett, founded by A.F. Holleman; continued by Egon Wiberg; translated by Mary Eagleson, William Brewer; revised by Bernhard J. (2001). Inorganic chemistry (1. English ed., [edited] by Nils Wiberg. bas.). San Diego, Calif. : Berlin: Academic Press, W. de Gruyter. s. 454. ISBN 0123526515.
- ^ Burgot, Jean-Louis. Ionic equilibria in analytical chemistry. New York: Springer. s. 358. ISBN 1441983821.