Klorik asit
| |

| |
Diğer adlar Klorik(V) asit | |
| Tanımlayıcılar | |
|---|---|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.029.303 |
| EC Numarası |
|
PubChem CID
|
|
| UNII | |
| UN numarası | 2626 |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
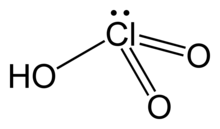
| Molekül formülü | HClO3 |
| Molekül kütlesi | 84.45914 g mol−1 |
| Görünüm | Renksiz çözelti |
| Yoğunluk | 1 g/mL, çözelti (yaklaşık) |
| Çözünürlük (su içinde) | >40 g/100 ml (20 °C) |
| Asitlik (pKa) | ~ −1 |
| Yapı | |
| piramidal | |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Oksitleyici, Aşındırıcı |
| GHS etiketleme sistemi: | |
| Piktogramlar |  
|
| İşaret sözcüğü | Tehlike |
| Tehlike ifadeleri | H271, H314 |
| Önlem ifadeleri | P210, P220, P221, P260, P264, P280, P283, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P306+P360, P310, P321, P363, P370+P378, P371+P380+P375, P405, P501 |
| NFPA 704 (yangın karosu) |
|
| Benzeyen bileşikler | |
Diğer anyonlar
|
bromik asit iyodik asit |
Diğer katyonlar
|
amonyum klorat sodyum klorat potasyum klorat |
Benzeyen bileşikler
|
hidroklorik asit hipokloröz asit kloröz asit perklorik asit |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Klorik asit (HClO3), bir klorun oksoasiti ve klorat tuzlarının formal öncüsüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.
Özellikler
Klorik asit, orantısızlık açısından termodinamik olarak kararsızdır.
Klorik asit, soğuk sulu çözeltide yaklaşık %30'luk bir konsantrasyona kadar kararlıdır ve %40'a kadar olan çözelti, indirgenmiş basınç altında dikkatlice buharlaştırmayla hazırlanabilir. Bu konsantrasyonların üzerinde, klorik asit çözeltileri, çeşitli ürünler verecek şekilde ayrışır, örneğin:
8 HClO3 → 4 HClO4 + 2 H2O + 2 Cl2 + 3 O2
3 HClO3 → HClO4 + H2O + 2 ClO2
Tehlikeler
Klorik asit güçlü bir oksitleyici ajandır. Çoğu organik ve yanıcı maddeler temas halinde alev alabilir.
Üretim
Sülfürik asidin baryum klorat ile reaksiyonu ile hazırlanabilir, çözünmeyen baryum sülfat çökeltme ile uzaklaştırılır:
Ba(ClO3)2 + H2SO4 → 2 HClO3 + BaSO4
Diğer bir yöntem ise, klorik asit ve hidrojen klorit üreten, hipokloröz asidin ısıtılmasıdır:
3 HClO → HClO3 + 2 HCl
Ayrıca bakınız
Kaynakça
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- R. Bruce King, ed. (1994). "Chloric acid". Encyclopedia of Inorganic Chemistry. 2. Chichester: Wiley. p. 658. ISBN 0-471-93620-0.

