Baryum klorür
| |

| |
Diğer adlar | |
| Tanımlayıcılar | |
|---|---|
| |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.030.704 |
| EC Numarası |
|
PubChem CID
|
|
| RTECS numarası |
|
| UNII |
|
| UN numarası | 1564 |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Molekül formülü | BaCl2 |
| Molekül kütlesi | 208.23 g/mol (susuz) 244.26 g/mol (dihidrat) |
| Görünüm | Beyaz katı |
| Yoğunluk | 3.856 g/cm3 (susuz) 3.0979 g/cm3 (dihidrat) |
| Erime noktası | 962 °C (960 °C, dihidrat) |
| Kaynama noktası | 1560 |
| Çözünürlük (su içinde) | 31.2 g/100 mL (0 °C) 35.8 g/100 mL (20 °C) 59.4 g/100 mL (100 °C) |
| Çözünürlük | metanol'de çözünür, etanol, etil asetatta çözünmez[2] |
| -72.6·10−6 cm3/mol | |
| Yapı | |
| PbCl2-tipi ortorombik (susuz) monoklinik (dihidrat) | |
| Termokimya | |
Standart molar entropi (S⦵298)
|
123.9 J/(k mol) |
Standart formasyon entalpisi (ΔfH⦵298)
|
−858.56 kJ/mol |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Son derece zehirli, aşındırıcı |
| GHS etiketleme sistemi: | |
| Piktogramlar | 
|
| İşaret sözcüğü | Tehlike |
| Tehlike ifadeleri | H301, H302, H332 |
| Önlem ifadeleri | P261, P264, P270, P271, P301+P310, P304+P312, P304+P340, P312, P321, P330, P405, P501 |
| NFPA 704 (yangın karosu) |
|
| Parlama noktası | Parlayıcı değil |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
78 mg/kg (sıçan, oral) 50 mg/kg (gine domuzu, oral)[4] |
LDLo (yayınlanan en düşük)
|
112 mg Ba/kg (tavşan, oral) 59 mg Ba/kg (köpek, oral) 46 mg Ba/kg (fare, oral)[4] |
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | TWA 0.5 mg/m3[3] |
| REL (tavsiye edilen) | TWA 0.5 mg/m3[3] |
| IDLH (anında tehlike) | 50 mg/m3[3] |
| Güvenlik bilgi formu (SDS) | NIH BaCl |
| Benzeyen bileşikler | |
Diğer anyonlar
|
Baryum florür Baryum bromür Baryum iyodür |
Diğer katyonlar
|
Berilyum klorür Magnezyum klorür Kalsiyum klorür Stronsiyum klorür Radyum klorür Kurşun klorür |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.
Laboratuvarda ve sanayide kullanımı sınırlıdır.[5]
Hazırlık[değiştir | kaynağı değiştir]
Endüstriyel ölçekte, baritten (baryum sülfat ) iki aşamalı işlemle hazırlanır:[6]
Bu ilk adım yüksek sıcaklıklar gerektirir.
İkinci adım, baryum sülfür ve hidrojen klorür arasında bir reaksiyon gerektirir:
- BaS + 2 HCl → BaCl
2 + H
2S
veya baryum sülfür ile kalsiyum klorür arasında reaksiyon gerektirir:
- BaS + CaCl
2 → CaS + BaCl
2[7]
HCl yerine klor kullanılabilir.[5] Baryum klorür su ile karışımdan ekstrakte edilir. Baryum klorürün su çözeltilerinden dihidratı (BaCl
2·2H2O) renksiz kristaller halinde kristalleştirilebilir.[7]
Baryum klorür prensip olarak baryum hidroksit veya baryum karbonatın hidrojen klorür ile reaksiyonuyla hazırlanabilir. Bu bazik tuzlar hidroklorik asitle reaksiyona girerek hidratlı baryum klorür verir.
- Ba(OH)
2 + 2 HCl → BaCl
2 + 2 H
2O - BaCO
3 + 2 HCl → BaCl
2 + H
2O + CO
2
Yapısı ve özellikleri[değiştir | kaynağı değiştir]
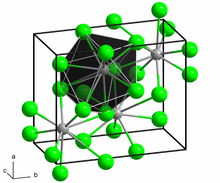
BaCl2 iki biçimde kristalleşir. Birinde kübik florür (CaF2) yapılı diğerinde ortorombik kotunnit (PbCl2) yapılıdır. Her iki polimorfda, altıdan büyük koordinasyon sayıları için büyük Ba2+ iyon tercihini barındırır.[8] Ba2+ 'nin koordinasyonu, florür yapısında[9] 8 ve kotunit yapısında 9'dur.[10] Kotunit-yapı BaCl2, 7-10 GPa basınçlarına maruz kaldığında üçüncü bir yapı olan monoklinik post-kotunnit faza dönüşür. Ba2+'nin koordinasyon sayısı 9'dan 10'a çıkar.[11]
Sulu bir eriyikte BaCl2 basit bir tuz olarak davranır ve suda 1:2 elektrolittir ve çözeltisi nötr pH gösterir.
Çözeltileri, kalın beyaz baryum sülfat çökeltisi oluşturmak için sülfat iyonu ile reaksiyona girer.
- BaCl
2 + Na
2SO
4 → 2 NaCl + BaSO
4
Bu çökeltme reaksiyonu, elektroliz için besleme tuzlu suyundaki sülfat konsantrasyonunu kontrol etmek amacıyla klor-alkali tesislerinde kullanılır.
Oksalat benzer bir reaksiyonu etkiler:
- BaCl
2 + Na
2C
2O
4 → 2 NaCl + BaC
2O
4
Sodyum hidroksit ile karıştırıldığında suda orta derecede çözünen baryum hidroksit verir.
- BaCl
2 + 2 NaOH → 2 NaCl + Ba(OH)
2
BaCl
2·2H2O, oda sıcaklığında havada kararlıdır ancak 55 °C (131 °F) üzerinde kristalizasyon suyunu kaybederek BaCl
2·H2O haline gelir ve 121 °C (250 °F) üzerinde susuz hale gelir.[7]
BaCl
2·H2O, dihidratın metanol ile çalkalanmasıyla oluşturulabilir.[12]
BaCl
2, alkali metal klorürlerle kolayca ötektik oluşturur.
- Ba2+ + SO42− → BaSO4
Okzalat benzer bir reaksiyonu etkiler:
- Ba2+ + C2O2-4 → BaC2O4
Sodyum hidroksit ile karıştırıldığında suda orta derecede çözünen dihidroksit verir.
Kullanımları[değiştir | kaynağı değiştir]
Ucuz olmasına rağmen baryum klorürün laboratuvarda ve endüstride sınırlı uygulaması vardır.
Sanayide, baryum klorür esasen kostik klor tesislerinde tuzlu su çözeltisinin saflaştırılmasında ve ayrıca ısıl işlem tuzlarının imalatında, çeliğin[13] sertleştirilmesinde kullanılır.
Ayrıca Lithol red ve Red Lake C gibi kırmızı pigmentleri yapmak için kullanılır.
Zehirliliği kullanımını sınırlar.
Zehirlilik[değiştir | kaynağı değiştir]
Baryum klorür, diğer suda çözünür baryum tuzları ile birlikte oldukça toksiktir.[14]
Gözleri ve cildi tahriş ederek kızarıklık ve ağrıya neden olur. Böbreklere zarar verir.
Bir insan için ölümcül baryum klorür dozunun yaklaşık 0,8-0,9 g olduğu rapor edilmiştir.
Akut baryum klorür zehirlenmesinin sistemik etkileri arasında karın ağrısı, ishal, bulantı, kusma, kardiyak aritmi, kas felci ve ölüm vardır.
Ba2+ iyonları, K+
iyonlarıyla rekabet ederek kas liflerinin elektriksel olarak uyarılamaz olmasına neden olur, dolayısıyla vücutta halsizlik ve felce neden olur.[12] Sodyum sülfat ve magnezyum sülfat potansiyel panzehirlerdir çünkü suda çözünmedikleri için nispeten zehirsiz baryum sülfat BaSO4 oluştururlar.
Baryum klorür insanlar için kanserojen olarak sınıflandırılmamıştır.[12]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Chemical Recreations: A Series of Amusing and Instructive Experiments, which May be Performed with Ease, Safety, Success, and Economy ; to which is Added, the Romance of Chemistry : An Inquiry into the Fallacies of the Prevailing Theory of Chemistry : With a New Theory and a New Nomenclature. R. Griffin & Company. 1834. 28 Temmuz 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Temmuz 2021.
- ^ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0045". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Barium (soluble compounds, as Ba)". Immediately Dangerous to Life or Health Concentrations (IDLH). Ulusal İş Sağlığı ve Güvenliği Enstitüsü (NIOSH).
- ^ a b "Barium and Barium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. 2007. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. bas.). Butterworth-Heinemann. ISBN 0080379419.
- ^ a b c Kaynak hatası: Geçersiz
<ref>etiketi;sciencedirectisimli refler için metin sağlanmadı (Bkz: Kaynak gösterme) - ^ Wells, A. F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. 0-19-855370-6
- ^ Haase (1978). "Hydratstufen und Kristallstrukturen von Bariumchlorid". Zeitschrift für anorganische und allgemeine Chemie. 441: 181-195. doi:10.1002/zaac.19784410120.
- ^ Brackett (1963). "The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide". The Journal of Physical Chemistry A. 67 (10): 2132. doi:10.1021/j100804a038.
- ^ Léger (1995). "The Post-Cotunnite Phase in BaCl2, BaBr2 and BaI2 under High Pressure". Journal of Applied Crystallography. 28 (4): 416. doi:10.1107/S0021889895001580.
- ^ a b c Kaynak hatası: Geçersiz
<ref>etiketi;pubchemisimli refler için metin sağlanmadı (Bkz: Kaynak gösterme) - ^ Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). "Barium and Barium Compounds". Ullman, Franz (Ed.). Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ^ The Merck Index, 7th edition, Merck & Co., Rahway, New Jersey, 1960.
Dış bağlantılar[değiştir | kaynağı değiştir]
- Uluslararası Kimyasal Güvenlik Kartı 0614 28 Temmuz 2021 tarihinde Wayback Machine sitesinde arşivlendi. . (susuz)
- Uluslararası Kimyasal Güvenlik Kartı 0615 28 Temmuz 2021 tarihinde Wayback Machine sitesinde arşivlendi. . (dihidrat)
- Baryum klorürün endüstride kullanımı .
- ChemSub Çevrimiçi: Baryum klorür 12 Aralık 2013 tarihinde Wayback Machine sitesinde arşivlendi. .

