Alüminyum klorür

| |
| |
| Adlandırmalar | |
|---|---|
aluminium chloride | |
Diğer adlar aluminium(III) chloride aluminum trichloride | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.371 |
| EC Numarası |
|
PubChem CID
|
|
| RTECS numarası |
|
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Molekül formülü | AlCl3 |
| Molekül kütlesi | 133.34 g/mol (anhydrous) 241.43 g/mol (hexahydrate) |
| Görünüm | beyaz veya açık sarı katı, hygroscopic |
| Yoğunluk | 2.48 g/cm3 (anhydrous) 1.3 g/cm3 (hexahydrate) |
| Erime noktası | 192.4 (anhydrous) 100 °C (212 °F; 373 K) (hexahydrate) 180 °C (356 °F; 453 K) (sublimes) |
| Kaynama noktası | 120 |
| Çözünürlük (su içinde) | 43.9 g/100 ml (0 °C) 44.9 g/100 ml (10 °C) 45.8 g/100 ml (20 °C) 46.6 g/100 ml (30 °C) 47.3 g/100 ml (40 °C) 48.1 g/100 ml (60 °C) 48.6 g/100 ml (80 °C) 49 g/100 ml (100 °C) |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| R-ibareleri | R34 |
| NFPA 704 (yangın karosu) |
|
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
380 mg/kg, rat (oral) hexahydrate: 3311 mg/kg, rat (oral) |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Alüminyum klorür (AlCl3), alüminyum ve klorürün temel bileşiği. Rengi genel olarak beyazdır fakat Demir(III) klorür ile etkileşime girdiğinde sarı bir renk alır. Katı erime ve kaynama noktası düşüktür. Genel olarak alüminyum metallerin üretiminde kullanılır. Ayrıca kimya endüstrisinin diğer alanlarında da yüksek miktarda kullanılır. Bileşik sıklıkla Lewis asiti olarak anılır.
Yapısı[değiştir | kaynağı değiştir]
Susuz[değiştir | kaynağı değiştir]
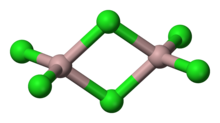
AlCl3 üç farklı yapıda bulunur, dereceye ve duruma göre (Katı, sıvı, gaz). Katı AlCl3, tabaka katmanlı kübik paketlenmiş tabakalar halindedir. Bu çerçevede, Al Oktahedral koordinasyon geometrisi şeklindedir.[1]
Heksahidrat[değiştir | kaynağı değiştir]
Heksahidrat [Al(H2O)6]3+ merkezler ve klorür karşı iyonlarından oluşur. Hidrojen bağı katyon ve anyonları birbirine bağlar.[2]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Bunun tersine, AlBr3 daha moleküler bir yapıdadır. Al3+ ile birlikte iyonların komşu paket çercevelerinin tetrahedral deliklerini işgal eder durumdadır. Br− ions.A. F. Wells, Structural Inorganic Chemistry, Oxford Press, Oxford, United Kingdom, 1984.
- ^ Andress, K.R.; Carpenter, C. "Kristallhydrate. II.Die Struktur von Chromchlorid- und Aluminiumchloridhexahydrat" Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie 1934, volume 87, p446-p463.
Dış bağlantılar[değiştir | kaynağı değiştir]
| Wikimedia Commons'ta Alüminyum klorür ile ilgili ortam dosyaları bulunmaktadır. |
- International Chemical Safety Card 1125 17 Ekim 2015 tarihinde Wayback Machine sitesinde arşivlendi.
- Index of Organic Synthesis procedures that utilize AlCl33 Eylül 2005 tarihinde Wayback Machine sitesinde arşivlendi.
- The period 3 chlorides 22 Kasım 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- MSDS
- Government of Canada Fact Sheets and Frequently Asked Questions: Aluminum Salts 5 Ekim 2016 tarihinde Wayback Machine sitesinde arşivlendi.

