Opioid: Revizyonlar arasındaki fark
| [kontrol edilmiş revizyon] | [kontrol edilmiş revizyon] |
Khutuck Bot (mesaj | katkılar) k Bot v3: Kaynak ve içerik düzenleme (hata bildir) |
Güncelleniyor |
||
| 109. satır: | 109. satır: | ||
==== Tolerans ==== |
==== Tolerans ==== |
||
Tolerans, ilaç etkilerinin azalmasıyla sonuçlanan nöroadaptasyonlarla karakterize edilen bir süreçtir. Reseptör yukarı regülasyonu sıklıkla önemli bir rol oynayabilirken, diğer mekanizmalar da bilinmektedir. Tolerans, bazı etkiler için diğerlerinden daha belirgindir; Duygudurum, kaşıntı, idrar retansiyonu ve solunum depresyonu üzerindeki etkilere karşı tolerans yavaş gelişir, ancak analjezi ve diğer fiziksel yan etkilere karşı daha çabuk oluşur. Bununla birlikte, kabızlık veya miyoz (gözbebeğinin iki milimetreye eşit veya daha az daralması) için tolerans gelişmez. Bununla birlikte, bazı yazarlar toleransın miyozise dönüştüğünü ileri sürerek bu fikre meydan okunmuştur. |
[[İlaç toleransı|Tolerans]], ilaç etkilerinin azalmasıyla sonuçlanan [[Nöral adaptasyon|nöroadaptasyonlarla]] karakterize edilen bir süreçtir. Reseptör [[Aşağı regülasyon ve yukarı regülasyon|yukarı regülasyonu]] sıklıkla önemli bir rol oynayabilirken, diğer mekanizmalar da bilinmektedir.<ref>{{cite journal|title=Ligand-directed trafficking of the δ-opioid receptor in vivo: two paths toward analgesic tolerance|date=December 2010|display-authors=6|issue=49|pages=16459–68|journal=The Journal of Neuroscience|volume=30|pmc=3086517|pmid=21147985|doi=10.1523/JNEUROSCI.3748-10.2010|vauthors=Pradhan AA, Walwyn W, Nozaki C, Filliol D, Erbs E, Matifas A, Evans C, Kieffer BL}}</ref> Tolerans, bazı etkiler için diğerlerinden daha belirgindir; Duygudurum, kaşıntı, idrar retansiyonu ve solunum depresyonu üzerindeki etkilere karşı tolerans yavaş gelişir, ancak analjezi ve diğer fiziksel yan etkilere karşı daha çabuk oluşur. Bununla birlikte, kabızlık veya [[miyoz]] (gözbebeğinin iki milimetreye eşit veya daha az daralması) için tolerans gelişmez. Bununla birlikte, bazı yazarlar toleransın miyozise dönüştüğünü ileri sürerek bu fikre meydan okunmuştur.<ref name="pmid15731628">{{cite journal|title=Tolerance to miotic effects of opioids|date=March 2005|issue=3|pages=701|journal=Anesthesiology|volume=102|pmid=15731628|doi=10.1097/00000542-200503000-00047|vauthors=Kollars JP, Larson MD}}</ref> |
||
Opioidlere tolerans, aşağıdakiler de dahil olmak üzere bir dizi madde tarafından azaltılır: |
Opioidlere tolerans, aşağıdakiler de dahil olmak üzere bir dizi madde tarafından azaltılır: |
||
* [[Kalsiyum kanal blokörü|Kalsiyum kanal blokerleri]]<ref>{{cite journal|title=Nimodipine-enhanced opiate analgesia in cancer patients requiring morphine dose escalation: a double-blind, placebo-controlled study|date=May 1998|issue=1–2|pages=17–26|journal=Pain|volume=76|pmid=9696455|doi=10.1016/S0304-3959(98)00019-0|vauthors=Santillán R, Hurlé MA, Armijo JA, de los Mozos R, Flórez J|s2cid=30963675}}</ref><ref>{{cite journal|title=Involvement of intracellular calcium in morphine tolerance in mice|date=February 1999|issue=2|pages=381–8|journal=Pharmacology, Biochemistry, and Behavior|volume=62|pmid=9972707|doi=10.1016/S0091-3057(98)00168-3|vauthors=Smith FL, Dombrowski DS, Dewey WL|s2cid=37434490}}</ref><ref>{{cite journal|title=Enhancement of opiate analgesia by nimodipine in cancer patients chronically treated with morphine: a preliminary report|date=July 1994|issue=1|pages=129–32|journal=Pain|volume=58|pmid=7970835|doi=10.1016/0304-3959(94)90192-9|vauthors=Santillán R, Maestre JM, Hurlé MA, Flórez J|s2cid=35138704}}</ref> |
|||
* Kalsiyum kanal blokerleri |
|||
* [[İntratekal uygulama|İntratekal]] [[magnezyum]]<ref>{{cite journal|url=http://www.anesthesia-analgesia.org/cgi/reprint/86/4/830|title=Antinociceptive potentiation and attenuation of tolerance by intrathecal co-infusion of magnesium sulfate and morphine in rats|date=April 1998|issue=4|pages=830–6|journal=Anesthesia and Analgesia|volume=86|pmid=9539610|doi=10.1097/00000539-199804000-00028|vauthors=McCarthy RJ, Kroin JS, Tuman KJ, Penn RD, Ivankovich AD}}</ref><ref>{{cite journal|url=|title=Effect of intrathecal magnesium in the presence or absence of local anaesthetic with and without lipophilic opioids: a systematic review and meta-analysis|date=May 2013|issue=5|pages=702–12|journal=British Journal of Anaesthesia|volume=110|pmid=23533255|doi=10.1093/bja/aet064|vauthors=Morrison AP, Hunter JM, Halpern SH, Banerjee A}}</ref> ve [[çinko]]<ref>{{cite journal|title=Intrathecal Zn2+ attenuates morphine antinociception and the development of acute tolerance|date=November 2000|issue=3|pages=267–72|journal=European Journal of Pharmacology|volume=407|pmid=11068022|doi=10.1016/S0014-2999(00)00715-9|vauthors=Larson AA, Kovács KJ, Spartz AK}}</ref> |
|||
* intratekal magnezyum ve çinko |
|||
* [[Dekstrometorfan]], [[ketamin]]<ref>{{cite journal|title=Effects of NMDA receptor antagonists on inhibition of morphine tolerance in rats: binding at mu-opioid receptors|date=February 1996|issue=1–2|pages=27–33|journal=European Journal of Pharmacology|volume=297|pmid=8851162|doi=10.1016/0014-2999(95)00728-8|vauthors=Wong CS, Cherng CH, Luk HN, Ho ST, Tung CS}}</ref> ve [[memantin]]<ref>{{cite journal|url=http://www.if-pan.krakow.pl/pjp/pdf/2008/2_149.pdf|title=Interaction of memantine and ketamine in morphine- and pentazocine-induced antinociception in mice|date=Mar–Apr 2008|issue=2|pages=149–55|journal=Pharmacological Reports|volume=60|pmid=18443375|vauthors=Malec D, Mandryk M, Fidecka S}}</ref> gibi [[NMDA reseptör antagonisti|NMDA antagonistleri]]. |
|||
* Dekstrometorfan, ketamin ve memantin gibi NMDA antagonistleri. |
|||
* [[Proglumid]] gibi [[Kolesistokinin antagonisti|kolesistokinin antagonistleri]]<ref>{{cite journal|title=Potentiation of opiate analgesia and apparent reversal of morphine tolerance by proglumide|date=April 1984|issue=4647|pages=395–6|journal=Science|volume=224|pmid=6546809|doi=10.1126/science.6546809|vauthors=Watkins LR, Kinscheck IB, Mayer DJ|bibcode=1984Sci...224..395W}}</ref><ref>{{cite journal|title=Proglumide prevents and curtails acute tolerance to morphine in rats|date=June 1984|issue=6|pages=715–8|journal=Neuropharmacology|volume=23|pmid=6462377|doi=10.1016/0028-3908(84)90171-0|vauthors=Tang J, Chou J, Iadarola M, Yang HY, Costa E|s2cid=33168040}}</ref><ref name="pmid12792559">{{cite journal|title=The cholecystokinin antagonist proglumide enhances the analgesic effect of dihydrocodeine|issue=3|pages=200–1|journal=The Clinical Journal of Pain|year=2003|volume=19|pmid=12792559|doi=10.1097/00002508-200305000-00008|vauthors=McCleane GJ|s2cid=29229782}}</ref> |
|||
* proglumid gibi kolesistokinin antagonistleri |
|||
* Fosfodiesteraz inhibitörü ibudilast gibi daha yeni ajanlar da bu uygulama için araştırılmıştır. |
* [[Fosfodiesteraz inhibitörü]] [[ibudilast]] gibi daha yeni ajanlar da bu uygulama için araştırılmıştır.<ref>{{cite journal|title=Ibudilast (AV-411). A new class therapeutic candidate for neuropathic pain and opioid withdrawal syndromes|date=July 2007|issue=7|pages=935–50|journal=Expert Opinion on Investigational Drugs|volume=16|pmid=17594181|doi=10.1517/13543784.16.7.935|vauthors=Ledeboer A, Hutchinson MR, Watkins LR, Johnson KW|s2cid=22321634}}</ref> |
||
Tolerans, vücudun sıklıkla mevcut olan bir ilaca uyum sağladığı ve genellikle aynı etkiyi elde etmek için zaman içinde aynı ilacın daha yüksek dozlarını gerektirdiği fizyolojik bir süreçtir. Uzun süreler boyunca yüksek dozda opioid alan kişilerde sık görülen bir durumdur, ancak kötüye kullanım veya bağımlılık ile herhangi bir ilişki öngörmemektedir. |
Tolerans, vücudun sıklıkla mevcut olan bir ilaca uyum sağladığı ve genellikle aynı etkiyi elde etmek için zaman içinde aynı ilacın daha yüksek dozlarını gerektirdiği fizyolojik bir süreçtir. Uzun süreler boyunca yüksek dozda opioid alan kişilerde sık görülen bir durumdur, ancak kötüye kullanım veya bağımlılık ile herhangi bir ilişki öngörmemektedir. |
||
=== Fiziksel |
==== Fiziksel bağımlılık ==== |
||
Fiziksel bağımlılık, vücudun bir maddenin, bu durumda opioid ilacının varlığına fizyolojik adaptasyonudur. Madde kesildiğinde, doz aniden azaltıldığında veya özellikle opioidler söz konusu olduğunda, bir antagonist (örn. |
[[Fiziksel bağımlılık]], vücudun bir maddenin, bu durumda opioid ilacının varlığına fizyolojik adaptasyonudur. Madde kesildiğinde, doz aniden azaltıldığında veya özellikle opioidler söz konusu olduğunda, bir antagonist (örn. [[nalokson]]) veya bir agonist-antagonist (örn. [[pentazosin]]) uygulandığında yoksunluk semptomlarının gelişmesi ile tanımlanır. Fiziksel bağımlılık, bazı ilaçların normal ve beklenen bir yönüdür ve mutlaka hastanın bağımlı olduğu anlamına gelmez. |
||
Opiatlar için yoksunluk belirtileri, şiddetli [[disfori]], başka bir afyon dozu için özlem, sinirlilik, terleme, bulantı, burun akıntısı, titreme, kusma ve kas ağrısını içerebilir. Opioid alımını günler ve haftalar içinde yavaş yavaş azaltmak, yoksunluk semptomlarını azaltabilir veya ortadan kaldırabilir.<ref name="oxford">{{cite book|title=Oxford Textbook of Palliative Medicine|publisher=Oxford University Press|edition=3rd|year=2004|isbn=978-0198566984|veditors=Doyle D, Hanks G, Cherney I, Calman K}}</ref> Çekilme hızı ve şiddeti, opioidin yarı ömrüne bağlıdır; eroin ve morfin yoksunluğu [[metadon]] yoksunluğundan daha hızlı gerçekleşir. Akut yoksunluk evresini genellikle aylarca sürebilen uzun süreli bir depresyon ve uykusuzluk evresi takip eder. Opioid yoksunluğu semptomları, [[klonidin]] gibi diğer ilaçlarla tedavi edilebilir.<ref>{{cite journal|title=Low efficacy of non-opioid drugs in opioid withdrawal symptoms|date=June 2005|issue=2|pages=165–9|journal=Addiction Biology|volume=10|pmid=16191669|doi=10.1080/13556210500123514|vauthors=Hermann D, Klages E, Welzel H, Mann K, Croissant B|s2cid=8017503}}</ref> Fiziksel bağımlılık, uyuşturucu kötüye kullanımını veya gerçek bağımlılığı öngörmez ve toleransla aynı mekanizma ile yakından ilişkilidir. [[İbogain]] ile ilgili anekdotsal fayda iddiaları olsa da madde bağımlılığında kullanımını destekleyen veriler yetersizdir.<ref>{{cite journal|title=Ibogaine in the treatment of substance dependence|date=March 2013|issue=1|pages=3–16|journal=Current Drug Abuse Reviews|volume=6|pmid=23627782|doi=10.2174/15672050113109990001|vauthors=Brown TK}}</ref> |
|||
Düzenli dozlarda opioid alan kritik hastalar, sık görülen bir sendrom olarak iyatrojenik yoksunluk yaşarlar.<ref>{{Cite journal|url=|title=Frequency, risk factors and symptomatology of iatrogenic withdrawal from opioids and benzodiazepines in critically Ill neonates, children and adults: A systematic review of clinical studies|date=April 2019|issue=2|pages=148–156|journal=Journal of Clinical Pharmacy and Therapeutics|volume=44|issn=1365-2710|pmid=30569508|doi=10.1111/jcpt.12787|last1=Duceppe|first1=Marc-Alexandre|last2=Perreault|first2=Marc M.|last3=Frenette|first3=Anne Julie|last4=Burry|first4=Lisa D.|last5=Rico|first5=Philippe|last6=Lavoie|first6=Annie|last7=Gélinas|first7=Céline|last8=Mehta|first8=Sangeeta|last9=Dagenais|first9=Maryse|last10=Williamson|first10=David R.}}</ref> |
|||
| ⚫ | |||
Düzenli dozlarda opioid alan kritik hastalar, sık görülen bir sendrom olarak iyatrojenik yoksunluk yaşarlar. |
|||
| ⚫ | Uyuşturucu [[Bağımlılık|bağımlılığı]], tipik olarak belirli ilaçların yanlış kullanımıyla ilişkili, zamänla ve daha yüksek ilaç dozajlarıyla gelişen karmaşık bir dizi davranıştır. Bağımlılık, etkilenen kişinin tehlikeli veya sağlıksız sonuçlara yol açan eylemlerde ısrar ettiği ölçüde psikolojik zorlamayı içerir. Opioid bağımlılığı, tıbbi nedenlerle reçete edildiği gibi ağızdan opioid almak yerine, [[İnsuflasyon (tıp)|insuflasyonu]] veya enjeksiyonu içerir.<ref name="oxford" /> |
||
Avusturya, Bulgaristan ve Slovakya gibi Avrupa ülkelerinde, [[buprenorfin]] veya [[Metadon|metadonun]] yan etkilerini iyi tolere edemeyen hastalar için opiat ikame tedavisinde (OİT) yavaş salınımlı oral morfin formülasyonları kullanılmaktadır. Buprenorfin, bağımlılığın daha uzun süreli tedavisi için [[nalokson]] ile birlikte de kullanılabilir. Birleşik Krallık da dahil olmak üzere diğer Avrupa ülkelerinde bu, değişen bir kabul ölçeğinde olsa da OİT için yasal olarak kullanılmaktadır. |
|||
| ⚫ | |||
| ⚫ | Uyuşturucu bağımlılığı, tipik olarak belirli ilaçların yanlış kullanımıyla ilişkili, zamänla ve daha yüksek ilaç dozajlarıyla gelişen karmaşık bir dizi davranıştır. Bağımlılık, etkilenen kişinin tehlikeli veya sağlıksız sonuçlara yol açan eylemlerde ısrar ettiği ölçüde psikolojik zorlamayı içerir. Opioid bağımlılığı, tıbbi nedenlerle reçete edildiği gibi ağızdan opioid almak yerine, |
||
Yavaş salınan ilaç formülasyonları, ağrı hastalarına hala meşru ağrı kesici ve kullanım kolaylığı sağlamaya çalışırken, kötüye kullanımı engellemeyi ve bağımlılık oranlarını düşürmeyi amaçlamaktadır. Bununla birlikte, bu tür müstahzarların etkinliği ve güvenliği hakkında sorular devam etmektedir. Daha fazla kurcalamaya dayanıklı ilaçlar şu anda [[FDA]] tarafından pazar onayı için denemeler ile değerlendirilmektedir.<ref>{{cite journal|title=Will abuse-deterrent formulations of opioid analgesics be successful in achieving their purpose?|date=September 2012|issue=13|pages=1713–23|journal=Drugs|volume=72|pmid=22931520|doi=10.2165/11635860-000000000-00000|vauthors=Bannwarth B|s2cid=26082561}}</ref><ref>{{cite journal|title=Abuse-deterrent and tamper-resistant opioid formulations: what is their role in addressing prescription opioid abuse?|date=October 2010|issue=10|pages=805–10|journal=CNS Drugs|volume=24|pmid=20839893|doi=10.2165/11584260-000000000-00000|vauthors=Schneider JP, Matthews M, Jamison RN|s2cid=17830622}}</ref> |
|||
Mevcut kanıt miktarı yalnızca zayıf bir sonuca varılmasına izin verir, ancak madde kullanım bozukluğu öyküsü olmayan hastalarda opioid kullanımını uygun şekilde yöneten bir doktorun, bağımlılık geliştirme veya diğer ciddi yan etkiler açısından çok az riskle uzun süreli ağrı kesici sağlayabileceğini düşündürür.<ref name="Long-term opioid management" /> |
|||
'''Opioidlerle ilgili sorunlar şunları içerir:''' |
'''Opioidlerle ilgili sorunlar şunları içerir:''' |
||
* Bazı insanlar opioidlerin tüm ağrılarını gidermediğini fark edebilirler.<ref>{{cite journal|url=|title=Opioid therapy pharmacogenomics for noncancer pain: efficacy, adverse events, and costs|pages=943014|journal=Pain Research and Treatment|year=2013|volume=2013|pmc=3791560|pmid=24167729|doi=10.1155/2013/943014|vauthors=Xu Y, Johnson A}}</ref> |
|||
* Bazı insanlar opioidlerin tüm ağrılarını gidermediğini fark eder. |
|||
* Bazı insanlar, opioidlerin yan etkilerinin, terapinin yararından daha ağır basan sorunlara yol açtığını |
* Bazı insanlar, opioidlerin yan etkilerinin, terapinin yararından daha ağır basan sorunlara yol açtığını düşünebilirler.<ref name="Long-term opioid management" /> |
||
* Bazı insanlar zamanla opioidlere tolerans geliştirir. Bu, faydayı sürdürmek için ilaç dozlarını artırmalarını gerektirir ve bu da istenmeyen yan etkileri artırır. |
* Bazı insanlar zamanla opioidlere tolerans geliştirir. Bu, faydayı sürdürmek için ilaç dozlarını artırmalarını gerektirir ve bu da istenmeyen yan etkileri artırır.<ref name="Long-term opioid management" /> |
||
* Uzun süreli opioid kullanımı, hastanın ağrıya duyarlılığının arttığı bir durum olan opioid kaynaklı hiperaljeziye neden olabilir. |
* Uzun süreli opioid kullanımı, hastanın ağrıya duyarlılığının arttığı bir durum olan [[Opioid kaynaklı hiperaljezi|opioid kaynaklı hiperaljeziye]] neden olabilir.<ref>{{cite journal|title=Complications of long-term opioid therapy for management of chronic pain: the paradox of opioid-induced hyperalgesia|date=December 2012|issue=4|pages=387–92|journal=Journal of Medical Toxicology|volume=8|pmc=3550256|pmid=22983894|doi=10.1007/s13181-012-0260-0|vauthors=Brush DE}}</ref> |
||
| ⚫ | Tüm opioidler yan etkilere neden olabilir. Ağrıyı gidermek için opioid alan hastalarda sık görülen yan etkiler bulantı ve kusma, uyuşukluk, kaşıntı, ağız kuruluğu, baş dönmesi ve kabızlığı içerir.<ref name="Furlan">{{cite journal|title=Opioids for chronic noncancer pain: a meta-analysis of effectiveness and side effects|date=May 2006|issue=11|pages=1589–94|journal=CMAJ|volume=174|pmc=1459894|pmid=16717269|doi=10.1503/cmaj.051528|vauthors=Furlan AD, Sandoval JA, Mailis-Gagnon A, Tunks E}}</ref><ref name="oxford" /> |
||
| ⚫ | |||
=== Mide bulantısı ve kusma belirtileri === |
=== Mide bulantısı ve kusma belirtileri === |
||
Bulantıya tolerans, antiemetiklerin (örneğin, gece bir kez düşük doz haloperidol) çok etkili olduğu 7-10 gün içinde ortaya çıkar. Tardif diskinezi gibi ciddi yan etkiler nedeniyle haloperidol artık nadiren kullanılmaktadır. Benzer risklere sahip olmasına rağmen, ilgili bir ilaç olan proklorperazin daha sık kullanılır. Ondansetron veya tropisetron gibi daha güçlü antiemetikler, daha yüksek maliyetlerine rağmen, bazen bulantı şiddetli veya sürekli ve rahatsız edici olduğunda kullanılır. Daha ucuz bir alternatif, domperidon ve metoklopramid gibi dopamin antagonistleridir. Domperidon kan-beyin bariyerini geçmez ve ters merkezi antidopaminerjik etkiler üretmez, ancak kemoreseptör tetikleme bölgesindeki opioid emetik etkisini bloke eder. (İlaç ABD'de mevcut değildir) Antikolinerjik özelliklere sahip bazı antihistaminikler (örneğin orfenadrin veya difenhidramin) de etkili olabilir. Birinci nesil antihistamin hidroksizin, hareket bozukluklarına neden olmaması ve ayrıca analjezik koruyucu özelliklere sahip olması gibi ek avantajlarla birlikte çok yaygın olarak kullanılmaktadır. Δ9-tetrahidrokanabinol bulantı ve kusmayı giderir; aynı zamanda daha düşük dozlarda opioid kullanımına izin veren, bulantı ve kusmayı azaltan analjezi üretir. |
[[Bulantı|Bulantıya]] tolerans, [[Antiemetik|antiemetiklerin]] (örneğin, gece bir kez düşük doz [[haloperidol]]) çok etkili olduğu 7-10 gün içinde ortaya çıkar.{{Kaynak belirt}} Tardif diskinezi gibi ciddi yan etkiler nedeniyle haloperidol artık nadiren kullanılmaktadır. Benzer risklere sahip olmasına rağmen, ilgili bir ilaç olan [[proklorperazin]] daha sık kullanılır. [[Ondansetron]] veya [[tropisetron]] gibi daha güçlü antiemetikler, daha yüksek maliyetlerine rağmen, bazen bulantı şiddetli veya sürekli ve rahatsız edici olduğunda kullanılır. Daha ucuz bir alternatif, [[domperidon]] ve [[metoklopramid]] gibi dopamin antagonistleridir. Domperidon [[Kan-beyin bariyeri|kan-beyin bariyerini]] geçmez ve ters merkezi antidopaminerjik etkiler üretmez, ancak [[Kemoreseptör tetikleme bölgesi|kemoreseptör tetikleme bölgesindeki]] opioid emetik etkisini bloke eder. (İlaç ABD'de mevcut değildir) [[Antikolinerjik]] özelliklere sahip bazı [[Antihistaminik|antihistaminikler]] (örneğin [[orfenadrin]] veya [[difenhidramin]]) de etkili olabilir. Birinci nesil antihistamin [[hidroksizin]], hareket bozukluklarına neden olmaması ve ayrıca analjezik koruyucu özelliklere sahip olması gibi ek avantajlarla birlikte çok yaygın olarak kullanılmaktadır. Δ9-[[Tetrahidrokannabinol|tetrahidrokanabinol]] bulantı ve kusmayı giderir;<ref>{{cite journal|title=The role of cannabinoids in regulation of nausea and vomiting, and visceral pain|date=February 2015|issue=2|pages=429|journal=Current Gastroenterology Reports|volume=17|pmid=25715910|doi=10.1007/s11894-015-0429-1|vauthors=Malik Z, Baik D, Schey R|s2cid=32705478}}</ref><ref>{{cite journal|title=Cannabis in cancer care|date=June 2015|issue=6|pages=575–86|journal=Clinical Pharmacology and Therapeutics|volume=97|pmid=25777363|doi=10.1002/cpt.108|vauthors=Abrams DI, Guzman M|s2cid=2488112}}</ref> aynı zamanda daha düşük dozlarda opioid kullanımına izin veren, bulantı ve kusmayı azaltan analjezi üretir.<ref>{{Cite web|url=https://www.ucsf.edu/news/2011/12/11077/ucsf-study-finds-medical-marijuana-could-help-patients-reduce-pain-opiates|title=UCSF Study Finds Medical Marijuana Could Help Patients Reduce Pain with Opiates|access-date=4 March 2016|website=UC San Francisco}}</ref><ref>{{cite journal|title=Cannabinoid-opioid interaction in chronic pain|date=December 2011|issue=6|pages=844–51|journal=Clinical Pharmacology and Therapeutics|volume=90|pmid=22048225|doi=10.1038/clpt.2011.188|vauthors=Abrams DI, Couey P, Shade SB, Kelly ME, Benowitz NL|s2cid=4823659}}</ref> |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
Kusma, beynin kusma merkezi olan postrema bölgesinin kemoreseptör tetikleyici bölgesi üzerindeki doğrudan etkinin yanı sıra, gastrik stazdan (büyük hacimli kusma, kusmayla geçen kısa süreli mide bulantısı, |
Kusma, beynin kusma merkezi olan [[Postrema bölgesi|postrema bölgesinin]] [[kemoreseptör tetikleyici bölgesi]] üzerindeki doğrudan etkinin yanı sıra, [[Gastroparezi|gastrik stazdan]] (büyük hacimli kusma, kusmayla geçen kısa süreli mide bulantısı, özofagal reflü, epigastrik dolgunluk, erken doyma) kaynaklanır. Kusma böylece prokinetik ajanlar (örn. [[domperidon]] veya [[metoklopramid]]) tarafından önlenebilir. Kusma zaten başlamışsa bu ilaçların oral olmayan bir yolla (örn. metoklopramid için subkutan, domperidon için rektal yoldan) uygulanması gerekir. |
||
* Prokinetik ajanlar (örn. domperidon) |
* Prokinetik ajanlar (örn. [[domperidon]]) |
||
* Antikolinerjik ajanlar (örn. orfenadrin) |
* Antikolinerjik ajanlar (örn. [[orfenadrin]]) |
||
Kanıtlar, opioid içeren anestezinin postoperatif bulantı ve kusma ile ilişkili olduğunu göstermektedir.<ref>{{cite journal|url=https://serval.unil.ch/notice/serval:BIB_6A01A1CDCF6A|title=Analgesic impact of intra-operative opioids vs. opioid-free anaesthesia: a systematic review and meta-analysis|date=May 2019|issue=5|pages=651–662|journal=Anaesthesia|volume=74|pmid=30802933|doi=10.1111/anae.14582|vauthors=Frauenknecht J, Kirkham KR, Jacot-Guillarmod A, Albrecht E|s2cid=73469631}}</ref> |
|||
Opioid kullanan kronik ağrısı olan hastalarda ağrıda ve fiziksel işlevde küçük iyileşmeler ve kusma riskinde artış olmuştur.<ref>{{Cite journal|url=|title=Opioids for Chronic Noncancer Pain: A Systematic Review and Meta-analysis|date=2018-12-18|issue=23|language=en|pages=2448–2460|journal=JAMA|volume=320|issn=0098-7484|pmc=6583638|pmid=30561481|doi=10.1001/jama.2018.18472|last1=Busse|first1=Jason W.|last2=Wang|first2=Li|last3=Kamaleldin|first3=Mostafa|last4=Craigie|first4=Samantha|last5=Riva|first5=John J.|last6=Montoya|first6=Luis|last7=Mulla|first7=Sohail M.|last8=Lopes|first8=Luciane C.|last9=Vogel|first9=Nicole|last10=Chen|first10=Eric|last11=Kirmayr|first11=Karin}}</ref> |
|||
Kanıtlar, opioid içeren anestezinin postoperatif bulantı ve kusma ile ilişkili olduğunu göstermektedir.Opioid kullanan kronik ağrısı olan hastalarda ağrıda ve fiziksel işlevde küçük iyileşmeler ve kusma riskinde artış olmuştur. |
|||
=== |
=== Somnolans === |
||
[[Somnolans]] toleransı genellikle 5-7 gün içinde gelişir, ancak zahmetliyse alternatif bir opioide geçmek genellikle yardımcı olur. [[Fentanil]], [[morfin]] ve diamorfin ([[eroin]]) gibi belirli opioidler özellikle yatıştırıcı olma eğilimindeyken; [[Oxycodone|oksikodon]], [[tilidin]] ve meperidin ([[petidin]]) gibi diğerleri nispeten daha az sedasyon üretme eğilimindedir, ancak bireysel hastaların yanıtları belirgin şekilde değişebilir ve bir dereceye kadar deneme ve belirli bir hasta için en uygun ilacı bulmak için hata gerekebilir. Aksi takdirde, [[Merkezî sinir sistemi|CNS]] [[Uyarıcı|uyarıcıları]] ile tedavi genellikle etkilidir.<ref>{{cite journal|title=Pharmacologic treatment of opioid-induced sedation in chronic pain|date=April 2005|issue=4|pages=727–31|journal=The Annals of Pharmacotherapy|volume=39|pmid=15755795|doi=10.1345/aph.1E309|vauthors=Reissig JE, Rybarczyk AM|s2cid=39058371}}</ref><ref>{{cite journal|title=Amphetamines to counteract opioid-induced sedation|date=December 1999|issue=12|pages=1362–6|journal=The Annals of Pharmacotherapy|volume=33|pmid=10630837|doi=10.1345/aph.19024|vauthors=Corey PJ, Heck AM, Weathermon RA|s2cid=23733242}}</ref> |
|||
* Uyarıcılar (örn. kafein, modafinil, amfetamin, metilfenidat) |
* Uyarıcılar (örn. [[kafein]], [[modafinil]], [[amfetamin]], [[metilfenidat]]) |
||
=== Kaşıntı === |
=== Kaşıntı === |
||
Sayfanın 13.00, 24 Şubat 2023 tarihindeki hâli
Bu maddedeki bilgilerin doğrulanabilmesi için ek kaynaklar gerekli. (Şubat 2023) (Bu şablonun nasıl ve ne zaman kaldırılması gerektiğini öğrenin) |
Bu sayfada devam eden bir çalışma vardır. Yardım etmek istiyorsanız ya da çalışma yarım bırakılmışsa, çalışmayı yapan kişilerle iletişime geçebilirsiniz. Bu sayfada son yedi gün içinde değişiklik yapılmadığı takdirde şablon sayfadan kaldırılacaktır. En son değişiklik, 14 ay önce MRTFR55 (katkılar | kayıtlar) tarafından gerçekleştirildi (). |
| Opioid | |
|---|---|
 Prototipik opioid olan morfinin kimyasal yapısı.[1] | |
| İlaç sınıfı | |
| Sınıf tanımlayıcıları | |
| Amaç | Ağrı Kesici |
| ATC kodu | N02A |
| Etki modu | Opioid reseptörü |
| MeSH | D000701 |
| Vikiveri öğesi | |
Opioidler, morfin benzeri etkiler üretmek için opioid reseptörleri üzerinde etkili olan maddelerdir.[2] Tıbbi olarak öncelikle anestezi de dahil olmak üzere ağrı kesici olarak kullanılırlar.[3] Diğer tıbbi kullanımlar arasında ishalin baskılanması, opioid kullanım bozukluğu için replasman tedavisi, opioid doz aşımının tersine çevrilmesi ve öksürüğün bastırılması sayılabilir.[3] Karfentanil gibi son derece güçlü opioidler sadece veteriner kullanımı için onaylanmıştır.[4][5][6] Opioidler ayrıca öforik etkileri veya yoksunluk sendromunu önlemek için tıbbi olmayacak şekilde de sıklıkla kullanılır.[7] Opioidler ölüme neden olabilir ve Amerika Birleşik Devletleri'nde infazlar için kullanılmıştır.
Opioidlerin yan etkileri kaşıntı, sedasyon, mide bulantısı, solunum depresyonu, kabızlık ve öfori içerebilir. Uzun süreli kullanım toleransa neden olabilir, yani aynı etkiyi elde etmek için artan dozların gerekli olduğu anlamına gelir ve fiziksel bağımlılık, ilacın aniden kesilmesinin hoş olmayan yoksunluk semptomlarına yol açtığı anlamına gelir.[8] Öfori rekreasyonel kullanımı çeker ve opioidlerin rekreasyonel kullanımının sık sık, artan rekreasyonel kullanımı tipik olarak bağımlılıkla sonuçlanır. Benzodiazepinler gibi diğer depresan ilaçlarla aşırı dozda veya eşzamanlı kullanım genellikle solunum depresyonundan ölümle sonuçlanır.[9]
Opioidler, esas olarak merkezi ve periferik sinir sisteminde ve gastrointestinal sistemde bulunan opioid reseptörlerine bağlanarak etki eder. Bu reseptörler, opioidlerin hem psikoaktif hem de somatik etkilerine aracılık eder. Opioid ilaçlar, ishal önleyici ilaç loperamid gibi kısmi agonistleri ve opioid kaynaklı kabızlık için naloksegol gibi antagonistleri içerir; bunlar kan-beyin bariyerini geçmez, ancak diğer opioidlerin bu reseptörlere bağlanmasını engelleyebilir.
Opioidler bağımlılık yaptığından ve ölümcül doz aşımına neden olabileceğinden, çoğu kontrollü maddelerdir. 2013 yılında, 28 ile 38 milyon insan opioidleri yasa dışı olarak kullandı (15 ile 65 yaş arasındaki küresel nüfusun %0,6 ile %0,8'i).[10] 2011 yılında, Amerika Birleşik Devletleri'nde tahmini 4 milyon insan opioidleri rekreasyonel olarak kullandı veya onlara bağımlıydı.[11] 2015 itibarıyla, artan rekreasyonel kullanım ve bağımlılık oranları, opioid ilaçların aşırı reçetelenmesine ve ucuz yasadışı eroine bağlanmaktadır.[12][13][14] Tersine, aşırı reçeteleme, abartılı yan etkiler ve opioidlerden bağımlılık konusundaki korkular benzer şekilde ağrının yetersiz tedavisi için suçlanmaktadır.[15][16]
Terminoloji
Opioidler, morfinin kendisi de dahil olmak üzere afyondan türetilen bu tür ilaçları ifade eden eski bir terim olan opiatları içerir.[17] Diğer opioidler hidrokodon, oksikodon ve fentanil gibi yarı sentetik ve sentetik ilaçlardır; nalokson gibi antagonist ilaçlar ve endorfinler gibi endojen peptitlerdir.[18] Afyon ve narkotik terimleri bazen opioid ile eş anlamlı olarak karşımıza çıkmaktadır. Afyon, afyon haşhaşının reçinesinde bulunan doğal alkaloidlerle sınırlıdır, ancak bazıları yarı sentetik türevleri içerir.[17][19] Amerikan yasal terimi olarak 'uyuşukluk' veya 'uyku' anlamına gelen kelimelerden türetilen narkotik, kokain ve opioidleri ve bunların kaynak materyallerini ifade eder; ayrıca herhangi bir yasadışı veya kontrollü psikoaktif ilaca gevşek bir şekilde uygulanır.[20][21] Bazı yargı bölgelerinde kontrol edilen tüm uyuşturucular yasal olarak uyuşturucu olarak sınıflandırılmıştır. Terim aşağılayıcı çağrışımlara sahip olabilir ve bu durumda kullanımı genellikle önerilmez.[22][23]
Tıbbi kullanımlar

Ağrı
Zayıf opioid kodein, düşük dozlarda ve bir veya daha fazla başka ilaçla birlikte, hafif ağrıları tedavi etmek için reçeteli ilaçlarda ve reçetesiz olarak yaygın olarak bulunur.[24][25][26] Diğer opioidler genellikle orta ile şiddetli ağrıların giderilmesi için kullanılır.[25]
Akut ağrı
Opioidler akut ağrının tedavisinde etkilidir (ameliyat sonrası ağrı gibi).[27] Orta ile şiddetli akut ağrının hızlıca giderilmesi için, opioidler hızlı başlangıçları, etkinlikleri ve azalmış bağımlılık riskleri nedeniyle sıklıkla tercih edilen tedavidir. Bununla birlikte, yeni bir rapor, ameliyat veya travma sonrası akut ağrı yönetimi için opioid analjezikler başlatıldığında uzun süreli opioid kullanımı için açık bir risk göstermiştir.[28] Ayrıca, palyatif bakımda, kanser gibi bazı terminal durumlarda ve romatoid artrit gibi dejeneratif durumlarda ortaya çıkabilecek şiddetli, kronik, sakat bırakıcı ağrıya yardımcı olmak için önemli oldukları bulunmuştur. Birçok durumda opioidler, kronik kanser ağrısı olanlar için başarılı bir uzun vadeli bakım stratejisidir.
ABD'deki tüm eyaletlerin yarısından biraz fazlası, akut ağrı için opioidlerin reçete edilmesini veya dağıtılmasını kısıtlayan yasalar çıkarmıştır.[29]
Kronik kanser dışı ağrı
Kılavuzlar, opioid riskinin, baş ağrısı, sırt ağrısı ve fibromiyalji dahil olmak üzere kanser dışı kronik durumların çoğu için kullanıldığında faydalarından daha büyük olduğunu öne sürmüştür.[30] Bu nedenle kronik kanser dışı ağrılarda dikkatli kullanılmalıdırlar.[31] Kullanılırsa fayda ve zararlar en az üç ayda bir yeniden değerlendirilmelidir.[32]
Kronik ağrının tedavisinde, opioidler, parasetamol/asetaminofen, ibuprofen veya naproksen gibi NSAID'ler dahil olmak üzere diğer daha az riskli ağrı kesiciler düşünüldükten sonra denenecek bir seçenektir.[33] Fibromiyalji veya migrenin neden olduğu ağrı da dahil olmak üzere bazı kronik ağrı türleri, tercihen opioidler dışındaki ilaçlarla tedavi edilir.[34][35] Kronik nöropatik ağrıyı azaltmak için opioidlerin kullanılmasının etkinliği belirsizdir.[36]
Opioidler baş ağrısı için birinci basamak tedavi olarak kontrendikedir, çünkü uyanıklığı bozar, bağımlılık riski taşır ve epizodik baş ağrılarının kronikleşme riskini arttırır.[37] Opioidler ayrıca baş ağrısı ağrısına karşı duyarlılığın artmasına neden olabilir.[37] Diğer tedaviler başarısız olduğunda veya kullanılamadığında, hasta kronik baş ağrısının gelişmesini önlemek için izlenebilirse opioidler baş ağrısı tedavisi için uygun olabilir.[37]
Opioidler malign olmayan kronik ağrıların tedavisinde daha sık kullanılmaktadır.[38][39][40] Bu uygulama günümüzde bağımlılık ve opioidlerin kötüye kullanımı ile ilgili yeni ve büyüyen bir soruna yol açmıştır.[31][41] Çeşitli olumsuz etkiler nedeniyle, kronik ağrının uzun süreli yönetimi için opioidlerin kullanımı, diğer daha az riskli ağrı kesicilerin etkisiz bulunmadığı sürece endike değildir. Sinir ağrısı, migren ve fibromiyalji gibi sadece periyodik olarak ortaya çıkan kronik ağrı, sıklıkla opioidler dışındaki ilaçlarla daha iyi tedavi edilir.[34] Parasetamol, ibuprofen ve naproksen dahil olmak üzere steroid olmayan antiinflamatuar ilaçlar daha güvenli alternatifler olarak kabul edilir.[42] Sıklıkla oksikodon (Percocet) ile kombine parasetamol ve hidrokodon (Vicoprofen) ile kombine ibuprofen gibi opioidlerle birlikte kullanılırlar, bu da ağrı kesimini arttırır, ancak aynı zamanda rekreasyonel kullanımı caydırmayı amaçlar.[43][44]
Diğer
Öksürük
Kodein bir zamanlar öksürük bastırıcılarda "altın standart" olarak görülüyordu, ancak bu pozisyonu günümüzde sorgulanmaktadır.[45] Son zamanlarda yapılan bazı plasebo kontrollü çalışmalar, çocuklarda akut öksürük de dahil olmak üzere bazı nedenlerden dolayı plasebodan daha iyi olmayabileceğini bulmuştur.[46][47] Bu nedenle çocuklar için önerilmez.[47] Ek olarak, hidrokodonun çocuklarda yararlı olduğuna dair bir kanıt yoktur.[48] Benzer şekilde 2012 Hollanda kılavuzu, akut öksürüğün tedavisi ile ilgili kullanımını önermemektedir.[49] (Uzun zamandır kodein kadar etkili bir öksürük bastırıcı olduğu iddia edilen opioid analog dekstrometorfan benzer şekilde birkaç yeni çalışmada çok az fayda göstermiştir.)[50][51]
Düşük doz morfin kronik öksürüğe yardımcı olabilir, ancak kullanımı yan etkilerle sınırlıdır.[52]
İshal ve kabızlık
İshal baskın irritabl bağırsak sendromu vakalarında, ishali baskılamak için opioidler kullanılabilir. Loperamid, ishali baskılamak için kullanılan reçetesiz olarak kullanılabilen periferik olarak seçici bir opioiddir.
İshali bastırma yeteneği, opioidler birkaç haftadan fazla kullanıldığında kabızlık da üretir.[53] Periferik olarak seçici bir opioid antagonisti olan Naloksegol, opioid kaynaklı kabızlığı tedavi etmek için artık mevcuttur.[54]
Nefes darlığı
Opioidler, özellikle kanser ve KOAH gibi ileri seviye hastalıklarda nefes darlığına yardımcı olabilir.[55][56] Bununla birlikte, yakın zamanda yapılan iki sistematik literatür incelemesinden elde edilen bulgular, opioidlerin ilerlemiş kanserli hastalarda nefes darlığı tedavisinde mutlaka daha etkili olmadığını ortaya koymuştur.[57][58]
Hiperaljezi
Opioid kaynaklı hiperaljezi (OIH), kronik opioid maruziyetinden sonraki hastalarda belirgindir.[59][60]
Yan etkiler
Diğer
- Bilişsel etkiler
- Opioid bağımlılığı
- Baş dönmesi
- İştah kaybı
- Gecikmiş mide boşalması
- Azalmış cinsel dürtü
- Cinsel işlev bozukluğu
- Testosteron seviyelerinde azalma
- Depresyon
- Bağışıklık yetmezliği
- Artan ağrı hassasiyeti
- Düzensiz menstrüasyon
- Düşme riskinde artış
- Yavaş nefes alma
- Koma
Her yıl dünya çapında 69.000 kişi aşırı doz opioid kullanımı nedeniyle ölmekte ve 15 milyon kişi opioid bağımlılığına sahiptir.[62]
Yaşlı yetişkinlerde, opioid kullanımı "sedasyon, bulantı, kusma, kabızlık, idrar retansiyonu ve düşmeler" gibi artan yan etkilerle ilişkilidir.[63] Sonuç olarak, opioid alan yaşlı yetişkinlerin yaralanma riski daha fazladır.[64] Opioidler, aspirin ve parasetamol gibi diğer birçok ilacın aksine herhangi bir spesifik organ toksisitesine neden olmaz. Üst gastrointestinal kanama ve böbrek toksisitesi ile ilişkili değildirler.[65]
Akut bel ağrısı ve osteoartrit tedavisi için opioidlerin reçete edilmesi uzun vadeli olumsuz etkilere sahip gibi görünmektedir.[66][67]
USCDC'ye göre, metadon 1999-2010 yılları arasında ABD'de opioid bağlantılı ölümlerin %31'inde ve diğer opioidlerden çok daha yüksek oranda, tek uyuşturucu olarak %40'ında yer almıştır.[68] Uzun süreli opioid çalışmaları, birçoğunun onları durdurduğunu ve küçük yan etkilerin yaygın olduğunu bulmuştur.[69] Bağımlılık yaklaşık %0.3 oranında gerçekleşti.[69] Amerika Birleşik Devletleri'nde 2016 yılında opioid doz aşımı, 10.000 kişiden 1,7'sinin ölümüyle sonuçlandı.[70]
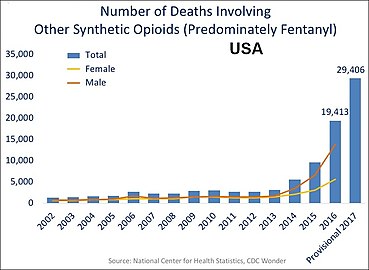
Aşağıdaki ABD tablolarında birçok ölüm birden fazla opioidi içermektedir:
-
ABD'de reçeteli opioidleri içeren yıllık ölümler. Metadon dışı sentetikler, yasa dışı yollardan elde edilen fentanilin hakim olduğu bir kategoridir ve hariç tutulmuştur.[71]
-
ABD'de eroin içeren yıllık aşırı doz ölümleri.[71]
Takviye bozuklukları
Tolerans
Tolerans, ilaç etkilerinin azalmasıyla sonuçlanan nöroadaptasyonlarla karakterize edilen bir süreçtir. Reseptör yukarı regülasyonu sıklıkla önemli bir rol oynayabilirken, diğer mekanizmalar da bilinmektedir.[72] Tolerans, bazı etkiler için diğerlerinden daha belirgindir; Duygudurum, kaşıntı, idrar retansiyonu ve solunum depresyonu üzerindeki etkilere karşı tolerans yavaş gelişir, ancak analjezi ve diğer fiziksel yan etkilere karşı daha çabuk oluşur. Bununla birlikte, kabızlık veya miyoz (gözbebeğinin iki milimetreye eşit veya daha az daralması) için tolerans gelişmez. Bununla birlikte, bazı yazarlar toleransın miyozise dönüştüğünü ileri sürerek bu fikre meydan okunmuştur.[73]
Opioidlere tolerans, aşağıdakiler de dahil olmak üzere bir dizi madde tarafından azaltılır:
- Kalsiyum kanal blokerleri[74][75][76]
- İntratekal magnezyum[77][78] ve çinko[79]
- Dekstrometorfan, ketamin[80] ve memantin[81] gibi NMDA antagonistleri.
- Proglumid gibi kolesistokinin antagonistleri[82][83][84]
- Fosfodiesteraz inhibitörü ibudilast gibi daha yeni ajanlar da bu uygulama için araştırılmıştır.[85]
Tolerans, vücudun sıklıkla mevcut olan bir ilaca uyum sağladığı ve genellikle aynı etkiyi elde etmek için zaman içinde aynı ilacın daha yüksek dozlarını gerektirdiği fizyolojik bir süreçtir. Uzun süreler boyunca yüksek dozda opioid alan kişilerde sık görülen bir durumdur, ancak kötüye kullanım veya bağımlılık ile herhangi bir ilişki öngörmemektedir.
Fiziksel bağımlılık
Fiziksel bağımlılık, vücudun bir maddenin, bu durumda opioid ilacının varlığına fizyolojik adaptasyonudur. Madde kesildiğinde, doz aniden azaltıldığında veya özellikle opioidler söz konusu olduğunda, bir antagonist (örn. nalokson) veya bir agonist-antagonist (örn. pentazosin) uygulandığında yoksunluk semptomlarının gelişmesi ile tanımlanır. Fiziksel bağımlılık, bazı ilaçların normal ve beklenen bir yönüdür ve mutlaka hastanın bağımlı olduğu anlamına gelmez. Opiatlar için yoksunluk belirtileri, şiddetli disfori, başka bir afyon dozu için özlem, sinirlilik, terleme, bulantı, burun akıntısı, titreme, kusma ve kas ağrısını içerebilir. Opioid alımını günler ve haftalar içinde yavaş yavaş azaltmak, yoksunluk semptomlarını azaltabilir veya ortadan kaldırabilir.[86] Çekilme hızı ve şiddeti, opioidin yarı ömrüne bağlıdır; eroin ve morfin yoksunluğu metadon yoksunluğundan daha hızlı gerçekleşir. Akut yoksunluk evresini genellikle aylarca sürebilen uzun süreli bir depresyon ve uykusuzluk evresi takip eder. Opioid yoksunluğu semptomları, klonidin gibi diğer ilaçlarla tedavi edilebilir.[87] Fiziksel bağımlılık, uyuşturucu kötüye kullanımını veya gerçek bağımlılığı öngörmez ve toleransla aynı mekanizma ile yakından ilişkilidir. İbogain ile ilgili anekdotsal fayda iddiaları olsa da madde bağımlılığında kullanımını destekleyen veriler yetersizdir.[88]
Düzenli dozlarda opioid alan kritik hastalar, sık görülen bir sendrom olarak iyatrojenik yoksunluk yaşarlar.[89]
Bağımlılık
Uyuşturucu bağımlılığı, tipik olarak belirli ilaçların yanlış kullanımıyla ilişkili, zamänla ve daha yüksek ilaç dozajlarıyla gelişen karmaşık bir dizi davranıştır. Bağımlılık, etkilenen kişinin tehlikeli veya sağlıksız sonuçlara yol açan eylemlerde ısrar ettiği ölçüde psikolojik zorlamayı içerir. Opioid bağımlılığı, tıbbi nedenlerle reçete edildiği gibi ağızdan opioid almak yerine, insuflasyonu veya enjeksiyonu içerir.[86]
Avusturya, Bulgaristan ve Slovakya gibi Avrupa ülkelerinde, buprenorfin veya metadonun yan etkilerini iyi tolere edemeyen hastalar için opiat ikame tedavisinde (OİT) yavaş salınımlı oral morfin formülasyonları kullanılmaktadır. Buprenorfin, bağımlılığın daha uzun süreli tedavisi için nalokson ile birlikte de kullanılabilir. Birleşik Krallık da dahil olmak üzere diğer Avrupa ülkelerinde bu, değişen bir kabul ölçeğinde olsa da OİT için yasal olarak kullanılmaktadır.
Yavaş salınan ilaç formülasyonları, ağrı hastalarına hala meşru ağrı kesici ve kullanım kolaylığı sağlamaya çalışırken, kötüye kullanımı engellemeyi ve bağımlılık oranlarını düşürmeyi amaçlamaktadır. Bununla birlikte, bu tür müstahzarların etkinliği ve güvenliği hakkında sorular devam etmektedir. Daha fazla kurcalamaya dayanıklı ilaçlar şu anda FDA tarafından pazar onayı için denemeler ile değerlendirilmektedir.[90][91]
Mevcut kanıt miktarı yalnızca zayıf bir sonuca varılmasına izin verir, ancak madde kullanım bozukluğu öyküsü olmayan hastalarda opioid kullanımını uygun şekilde yöneten bir doktorun, bağımlılık geliştirme veya diğer ciddi yan etkiler açısından çok az riskle uzun süreli ağrı kesici sağlayabileceğini düşündürür.[69]
Opioidlerle ilgili sorunlar şunları içerir:
- Bazı insanlar opioidlerin tüm ağrılarını gidermediğini fark edebilirler.[92]
- Bazı insanlar, opioidlerin yan etkilerinin, terapinin yararından daha ağır basan sorunlara yol açtığını düşünebilirler.[69]
- Bazı insanlar zamanla opioidlere tolerans geliştirir. Bu, faydayı sürdürmek için ilaç dozlarını artırmalarını gerektirir ve bu da istenmeyen yan etkileri artırır.[69]
- Uzun süreli opioid kullanımı, hastanın ağrıya duyarlılığının arttığı bir durum olan opioid kaynaklı hiperaljeziye neden olabilir.[93]
Tüm opioidler yan etkilere neden olabilir. Ağrıyı gidermek için opioid alan hastalarda sık görülen yan etkiler bulantı ve kusma, uyuşukluk, kaşıntı, ağız kuruluğu, baş dönmesi ve kabızlığı içerir.[61][86]
Mide bulantısı ve kusma belirtileri
Bulantıya tolerans, antiemetiklerin (örneğin, gece bir kez düşük doz haloperidol) çok etkili olduğu 7-10 gün içinde ortaya çıkar.[kaynak belirtilmeli] Tardif diskinezi gibi ciddi yan etkiler nedeniyle haloperidol artık nadiren kullanılmaktadır. Benzer risklere sahip olmasına rağmen, ilgili bir ilaç olan proklorperazin daha sık kullanılır. Ondansetron veya tropisetron gibi daha güçlü antiemetikler, daha yüksek maliyetlerine rağmen, bazen bulantı şiddetli veya sürekli ve rahatsız edici olduğunda kullanılır. Daha ucuz bir alternatif, domperidon ve metoklopramid gibi dopamin antagonistleridir. Domperidon kan-beyin bariyerini geçmez ve ters merkezi antidopaminerjik etkiler üretmez, ancak kemoreseptör tetikleme bölgesindeki opioid emetik etkisini bloke eder. (İlaç ABD'de mevcut değildir) Antikolinerjik özelliklere sahip bazı antihistaminikler (örneğin orfenadrin veya difenhidramin) de etkili olabilir. Birinci nesil antihistamin hidroksizin, hareket bozukluklarına neden olmaması ve ayrıca analjezik koruyucu özelliklere sahip olması gibi ek avantajlarla birlikte çok yaygın olarak kullanılmaktadır. Δ9-tetrahidrokanabinol bulantı ve kusmayı giderir;[94][95] aynı zamanda daha düşük dozlarda opioid kullanımına izin veren, bulantı ve kusmayı azaltan analjezi üretir.[96][97]
- 5-HT3 antagonistleri (örn. ondansetron)
- Dopamin antagonistleri (örn. domperidon)
- Antikolinerjik antihistaminikler (örn. difenhidramin)
- Δ9-tetrahidrokanabinol (örn. dronabinol)
Kusma, beynin kusma merkezi olan postrema bölgesinin kemoreseptör tetikleyici bölgesi üzerindeki doğrudan etkinin yanı sıra, gastrik stazdan (büyük hacimli kusma, kusmayla geçen kısa süreli mide bulantısı, özofagal reflü, epigastrik dolgunluk, erken doyma) kaynaklanır. Kusma böylece prokinetik ajanlar (örn. domperidon veya metoklopramid) tarafından önlenebilir. Kusma zaten başlamışsa bu ilaçların oral olmayan bir yolla (örn. metoklopramid için subkutan, domperidon için rektal yoldan) uygulanması gerekir.
- Prokinetik ajanlar (örn. domperidon)
- Antikolinerjik ajanlar (örn. orfenadrin)
Kanıtlar, opioid içeren anestezinin postoperatif bulantı ve kusma ile ilişkili olduğunu göstermektedir.[98]
Opioid kullanan kronik ağrısı olan hastalarda ağrıda ve fiziksel işlevde küçük iyileşmeler ve kusma riskinde artış olmuştur.[99]
Somnolans
Somnolans toleransı genellikle 5-7 gün içinde gelişir, ancak zahmetliyse alternatif bir opioide geçmek genellikle yardımcı olur. Fentanil, morfin ve diamorfin (eroin) gibi belirli opioidler özellikle yatıştırıcı olma eğilimindeyken; oksikodon, tilidin ve meperidin (petidin) gibi diğerleri nispeten daha az sedasyon üretme eğilimindedir, ancak bireysel hastaların yanıtları belirgin şekilde değişebilir ve bir dereceye kadar deneme ve belirli bir hasta için en uygun ilacı bulmak için hata gerekebilir. Aksi takdirde, CNS uyarıcıları ile tedavi genellikle etkilidir.[100][101]
- Uyarıcılar (örn. kafein, modafinil, amfetamin, metilfenidat)
Kaşıntı
Ağrıyı gidermek için opioidler kullanıldığında kaşıntı ciddi bir sorun olmama eğilimindedir, ancak antihistaminikler, ortaya çıktığında kaşıntıya karşı koymak için yararlıdır. Feksofenadin gibi yatıştırıcı olmayan antihistaminikler, opioid kaynaklı uyuşukluğun artmasını engelledikleri için sıklıkla tercih edilir. Bununla birlikte, orfenadrin gibi bazı yatıştırıcı antihistaminikler, daha küçük dozlarda opioidlerin kullanılmasına izin veren sinerjik bir ağrı giderici etki üretebilir. Sonuç olarak, Meprozin (meperidin/prometazin) ve Diconal (dipipanon/siklizin) gibi çeşitli opioid/antihistaminik kombinasyon ürünleri pazarlanmıştır ve bunlar aynı zamanda opioid kaynaklı mide bulantısını da azaltabilir.
- Antihistaminikler (örneğin feksofenadin)
Kabızlık
Opioid kaynaklı kabızlık (OIC), uzun süreli opioid alan kişilerin %90 ila 95'inde gelişir. Bu soruna tolerans genellikle gelişmediğinden, uzun süreli opioid kullanan çoğu kişinin müshil veya lavman alması gerekir.
İKT tedavisi ardışıktır ve ciddiyete bağlıdır. İlk tedavi şekli farmakolojik değildir ve diyet lifi, sıvı alımı (günde yaklaşık 15 L (510 US fl oz)) ve fiziksel aktivite gibi yaşam tarzı değişikliklerini içerir. Farmakolojik olmayan önlemler etkisiz ise, dışkı yumuşatıcılar (örn., polietilen glikol), yığın oluşturan laksatifler (örn., lif takviyeleri), uyarıcı laksatifler (örn., bisakodil, senna) ve/veya lavman dahil laksatifler kullanılabilir. İKT için yaygın bir müshil rejimi, docusate ve bisacodyl kombinasyonudur.Şablon:Güncelleme satır içi Ozmotik laksatifler, laktuloz, polietilen glikol ve magnezyum sütü (magnezyum hidroksit) ve ayrıca mineral yağ (bir yağlayıcı müshil) de yaygın olarak kullanılır. İKÖ için kullanılır.
Laksatifler yeterince etkili değilse (ki bu genellikle böyledir), metilnaltrekson bromür, naloksegol, alvimopan veya nalokson (oksikodon/naloksonda olduğu gibi) gibi periferik olarak seçici bir opioid antagonisti içeren opioid formülasyonları veya rejimleri denenebilir. Bir 2018 Cochrane incelemesi, kanıtların alvimopan, nalokson veya metilnaltrekson bromür için geçici olduğunu bulmuştur.Şablon:Ağız yoluyla Nalokson güncellemesi en etkili gibi görünmektedir. Günlük 0,2 mg naldemedin dozunun, OIC hastalarında semptomları önemli ölçüde iyileştirdiği gösterilmiştir.
Opioid rotasyonu, uzun süreli kullanıcılarda kabızlığın etkisini en aza indirmek için önerilen bir yöntemdir. Tüm opioidler kabızlığa neden olurken, ilaçlar arasında bazı farklılıklar vardır; çalışmalar, tramadol, tapentadol, metadon ve fentanilin nispeten daha az kabızlığa neden olabileceğini düşündürürken, kodein, morfin, oksikodon veya hidromorfon ile kabızlık nispeten daha şiddetli olabilir.
Solunum depresyonu
Solunum depresyonu, opioid kullanımıyla ilişkili en ciddi advers reaksiyondur, ancak genellikle opioid kullanmamış bir hastada tek bir intravenöz dozun kullanımıyla görülür. Ağrıyı gidermek için düzenli olarak opioid alan hastalarda solunum depresyonuna tolerans hızla oluşur, bu nedenle klinik bir sorun değildir. Solunum depresyonunu kısmen bloke edebilen birkaç ilaç geliştirilmiştir, ancak şu anda bu amaç için onaylanmış tek solunum uyarıcısı, bu uygulamada yalnızca sınırlı etkinliğe sahip olan doxapram'dır. BIMU-8 ve CX-546 gibi daha yeni ilaçlar çok daha etkili olabilir.Şablon:Birincil olmayan kaynak gerekli
- Solunum uyarıcıları: karotis kemoreseptör agonistleri (örn. doxapram), 5-HT4 agonistleri (örn. ilaçlar sadece orta derecede etkilidir veya insanlarda kullanımı engelleyen yan etkileri vardır. 8-OH-DPAT ve repinotan gibi 5-HT1A agonistleri de opioid kaynaklı solunum depresyonuna karşı koyar, ancak aynı zamanda bu uygulama için yararlılıklarını sınırlayan analjeziyi azaltır.
- Opioid antagonistleri (örn. nalokson, nalmefen, diprenorfin)
Opioid uygulamasından sonraki ilk 24 saat, yaşamı tehdit eden OIRD açısından en kritik olan gibi görünmektedir, ancak opioid kullanımına daha dikkatli bir yaklaşımla önlenebilir olabilir.
Kardiyak, solunum hastalığı ve/veya obstrüktif uyku apnesi olan hastalar OIRD için yüksek risk altındadır.
Artan ağrı duyarlılığı
Opioid kaynaklı hiperaljezi - ağrıyı gidermek için opioid kullanan kişilerin paradoksal olarak bu ilacın bir sonucu olarak daha fazla ağrı yaşadığı - bazı insanlarda gözlenmiştir. Bu fenomen, nadir olmakla birlikte, palyatif bakım alan bazı kişilerde, çoğunlukla doz hızla artırıldığında görülür. Karşılaşılırsa, birkaç farklı opioid ağrı kesici ilaç arasında rotasyon, artan ağrı gelişimini azaltabilir. Opioid kaynaklı hiperaljezi daha çok kronik kullanımda veya kısa süreli yüksek dozlarda ortaya çıkar, ancak bazı araştırmalar bunun çok düşük dozlarda da ortaya çıkabileceğini düşündürmektedir.
Bazen nöropatik ağrının kötüleşmesinin eşlik ettiği hiperaljezi ve allodini gibi yan etkiler, opioid analjeziklerle uzun süreli tedavinin sonuçları olabilir, özellikle de artan tolerans, etkinlik kaybına ve bunun sonucunda zamanla artan doz artışına yol açtığında. Bu, büyük ölçüde opioid ilaçlarının nosiseptin reseptörü, sigma reseptörü ve Toll benzeri reseptör 4 dahil olmak üzere üç klasik opioid reseptörü dışındaki hedeflerdeki etkilerinin bir sonucu gibi görünmektedir ve hayvan modellerinde bu hedeflerdeki antagonistler tarafından etkisiz hale getirilebilir. Sırasıyla J-113.397, BD-1047 veya ()-nalokson. İnsanlarda opioid kaynaklı hiperaljeziyi önlemek için şu anda hiçbir ilaç özel olarak onaylanmamıştır ve ciddi vakalarda tek çözüm opioid analjeziklerin kullanımını durdurmak ve bunları opioid olmayan analjezik ilaçlarla değiştirmek olabilir. Bununla birlikte, bu yan etkinin gelişimine karşı bireysel duyarlılık yüksek oranda doza bağımlı olduğundan ve hangi opioid analjeziğin kullanıldığına bağlı olarak değişebildiğinden, birçok hasta opioid ilacının dozunun azaltılmasıyla (genellikle ek bir ilacın eklenmesiyle birlikte) bu yan etkiden kaçınabilir. opioid olmayan analjezik), farklı opioid ilaçlar arasında dönerek veya nöropatik ağrıya, özellikle tramadol veya tapentadol'a da karşı koyan karışık bir etki modu ile daha hafif bir opioide geçerek.
- Ketamin gibi NMDA reseptör antagonistleri
- milnasipran gibi SNRI'ler
- Gabapentin veya pregabalin gibi antikonvülsanlar
Diğer olumsuz etkiler
Düşük seks hormonu seviyeleri
Klinik çalışmalar, farklı cinsiyetlerde tıbbi ve eğlence amaçlı opioid kullanımını hipogonadizm (düşük seks hormonu seviyeleri) ile tutarlı bir şekilde ilişkilendirmiştir. Etki doza bağlıdır. Çoğu çalışma, kronik opioid kullanıcılarının çoğunluğunun (belki de %90 kadarı) hipogonadizm geliştirdiğini göstermektedir. 2015 yılında yapılan sistematik bir inceleme ve meta-analiz, opioid tedavisinin erkeklerde testosteron düzeylerini ortalama olarak yaklaşık 165 ng/dL (5.7 nmol/L) bastırdığını ve bu da testosteron seviyesinde neredeyse %50'lik bir azalma olduğunu buldu. Tersine, opioid tedavisi kadınlarda testosteron düzeylerini önemli ölçüde etkilemedi. Bununla birlikte, opioidler, luteinize edici hormon (LH) üretimini sınırlayarak kadınlarda menstrüasyona da müdahale edebilir. Opioid kaynaklı hipogonadizm, muhtemelen östradiol eksikliği nedeniyle opioid kullanımının osteoporoz ve kemik kırığı ile güçlü ilişkisine neden olur. Ayrıca ağrıyı artırabilir ve dolayısıyla opioid tedavisinin amaçlanan klinik etkisine müdahale edebilir. Opioid kaynaklı hipogonadizm, muhtemelen hipotalamus ve hipofiz bezindeki opioid reseptörlerinin agonizmlerinden kaynaklanır. Bir çalışmada, eroin bağımlılarının depresif testosteron düzeylerinin, yoksunluktan sonraki bir ay içinde normale döndüğü saptanmış, bu da etkinin kolaylıkla geri dönüşümlü olduğunu ve kalıcı olmadığını düşündürmektedir. ( 2013), düşük doz veya akut opioid kullanımının endokrin sistem üzerindeki etkisi belirsizdir. Opioidlerin uzun süreli kullanımı diğer hormonal sistemleri de etkileyebilir.
İşin aksaması
Opioid kullanımı işe geri dönememe için bir risk faktörü olabilir.
Güvenlik açısından hassas herhangi bir görev yapan kişiler opioid kullanmamalıdır. Sağlık hizmeti sağlayıcıları, vinç veya forklift dahil ağır ekipman kullanan veya kullanan çalışanların kronik veya akut ağrıyı opioidlerle tedavi etmelerini önermemelidir. Güvenlik açısından hassas operasyonlar yürüten işçileri yöneten işyerleri, bu işçiler doktorları tarafından opioidlerle tedavi edildiği sürece işçileri daha az hassas görevlere vermelidir.
Opioidleri uzun süre alan kişilerin işsiz kalma olasılığı artmıştır. Opioid almak hastanın hayatını daha da bozabilir ve opioidlerin olumsuz etkileri hastaların aktif bir yaşam sürmeleri, iş bulmaları ve kariyer sürdürmeleri önünde önemli bir engel haline gelebilir.
Ek olarak, istihdam eksikliği, reçeteli opioidlerin anormal kullanımının bir göstergesi olabilir.
Artan kaza eğilimi
Opioid kullanımı kazaya yatkınlığı artırabilir. Opioidler trafik kazası ve kaza sonucu düşme riskini artırabilir.
Azaltılmış Dikkat
Opioidlerin, antidepresanlar ve/veya antikonvülzanlarla birlikte kullanıldığında dikkati azalttığı gösterilmiştir.
Nadir yan etkiler
Ağrıyı gidermek için opioid alan hastalarda seyrek görülen advers reaksiyonlar şunlardır: doza bağlı solunum depresyonu (özellikle daha güçlü opioidlerle), konfüzyon, halüsinasyonlar, deliryum, ürtiker, hipotermi, bradikardi/taşikardi, ortostatik hipotansiyon, baş dönmesi, baş ağrısı, idrar retansiyonu, üreter veya biliyer spazm, kas sertliği, miyoklonus (yüksek dozlarda) ve kızarma (fentanil ve remifentanil hariç histamin salınımına bağlı). Opioidlerin hem terapötik hem de kronik kullanımı, bağışıklık sisteminin işlevini tehlikeye atabilir. Opioidler, makrofaj progenitör hücrelerinin ve lenfositlerin proliferasyonunu azaltır ve hücre farklılaşmasını etkiler (Roy & Loh, 1996). Opioidler ayrıca lökosit göçünü de engelleyebilir. Bununla birlikte, bunun ağrı kesici bağlamında önemi bilinmemektedir.
Geçmiş
Doğal olarak oluşan opioidler
Opioidler dünyanın bilinen en eski ilaçları arasındadır. Bir insan arkeolojik alanında Papaver somniferum'un bilinen en eski kanıtı, M.Ö. 5.700-5.500 yılları arasındaki Neolitik döneme aittir. Tohumları İber Yarımadası'ndaki Cueva de los Murciélagos'ta ve İtalyan Yarımadası'ndaki La Marmotta'da bulunmuştur. 181182
Afyon haşhaşının tıbbi, rekreasyonel ve dini amaçlar için kullanılması, Sümer kil tabletlerindeki ideogramların bir "neşe bitkisi" olan "Hul Gil" in kullanımından bahsettiği M.Ö. dördüncü yüzyıla kadar izlenebilir. 184 Afyon Mısırlılar tarafından biliniyordu ve Ebers Papirüsü'nde çocukların yatıştırılması, ve meme apselerinin tedavisi için bir karışımda bir bileşen olarak bahsedilmektedir.
Afyon Yunanlılar tarafından da biliniyordu. Hipokrat (c. 460 – c. 370 BC) ve öğrencileri tarafından uykuya neden olan özellikleri nedeniyle değerlendirildi ve ağrı tedavisinde kullanıldı. Latince "Sedare dolorem opus divinum est", trans. "Acıyı hafifletmek ilahi olanın işidir" deyişi, Hipokrat'a ve Bergamalı Galen'e çeşitli şekillerde atfedilmiştir. Afyonun tıbbi kullanımı daha sonra Roma ordusunda görev yapan Yunan bir doktor olan Pedanius Dioscorides (MS 40 – 90 civarı) tarafından beş ciltlik eseri De Materia Medica'da tartışılmıştır.
İslami Altın Çağ boyunca, afyon kullanımı Avicenna (c. 980 – Haziran 1037 AD) tarafından The Canon of Medicine'de ayrıntılı olarak tartışılmıştır. Kitabın beş cildi afyonun hazırlanması, bir dizi fiziksel etki, çeşitli hastalıkları tedavi etmek için kullanımı, kullanımı için kontrendikasyonlar, zehir olarak potansiyel tehlikesi ve bağımlılık potansiyeli hakkında bilgi içermektedir. Avicenna, afyonun son çare olarak kullanılmasını teşvik etmedi ve analjeziklerle en aza indirmeye çalışmak yerine ağrının nedenlerini ele almayı tercih etti. İbn-i Sina'nın gözlemlerinin çoğu modern tıp araştırmaları tarafından desteklenmiştir.
Dünyanın Hindistan ve Çin'de afyonun tam olarak ne zaman farkına vardığı belirsizdir, ancak Çin tıbbi çalışması K'ai-pao-pen-tsdo'da (MS 973 gelindiğinde, afyon haşhaşları Agra Subah bölgesinde temel bir bahar ürünüdür.
Doktor Paracelsus (c. 1493-1541), Alman Rönesansı sırasında Batı Avrupa'da afyonu tıbbi kullanıma yeniden sokmakla tanınır. Afyonun tıbbi kullanım için faydalarını övdü. Ayrıca, laudanum adını verdiği bir hap olan bir "arcanum"a sahip olduğunu iddia etti, bu da özellikle ölüm aldatılacaksa, diğerlerinden daha üstündü. ("Ich hab' ein Arcanum – heiss' ich Laudanum, ist über das Alles, wo es zum Tode reichen will.") Daha sonraki yazarlar, Paracelsus'un laudanum tarifinin afyon içerdiğini, ancak kompozisyonunun bilinmediğini iddia etmişlerdir.
Laudanum
Laudanum terimi, 17. yüzyıla kadar yararlı bir ilaç için genel olarak kullanılmıştır. Thomas Sydenham, afyonun ilk sıvı tentürünü tanıttıktan sonra, "laudanum" hem afyon hem de alkolün bir karışımı anlamına geldi. Sydenham'ın 1669 laudanum tarifi, afyonu şarap, safran, karanfil ve tarçın ile karıştırdı. Sydenham'ın laudanumu 20. yüzyıla kadar hem Avrupa'da hem de Amerika'da yaygın olarak kullanılmıştır. Afyona dayanan diğer popüler ilaçlar, çocuklar için çok daha hafif bir sıvı preparat olan Paregoric'i içeriyordu; Siyah damla, daha güçlü bir hazırlık; ve Dover'ın tozu.
Afyon ticareti
Afyon, diğerlerinin yanı sıra Hindistan, Portekizliler, Hollandalılar, İngilizler ve Çin'i içeren ticaret ağları aracılığıyla yasal ve yasadışı olarak hareket eden büyük bir sömürge metası haline geldi. İngiliz Doğu Hindistan Şirketi, afyon ticaretini MS 1683'te bir yatırım fırsatı olarak gördü. Bengal Valisi, Doğu Hindistan Şirketi adına Bengal afyonu üretimi üzerinde bir tekel kurdu. Hint afyonunun ekimi ve üretimi, 1797 ve 1949 yılları arasında bir dizi eylemle daha da merkezileştirildi ve kontrol edildi. İngilizler, Çin hükümetinin yasaklarına meydan okuyarak Çin'e kaçırılan Hint afyonunu satarak Çin çayının ithalatından kaynaklanan ekonomik açığı dengeledi. Bu, Çin ve İngiltere arasında Birinci (1839-1842) ve İkinci Afyon Savaşları'na (1856-1860) yol açtı.
Morfin
19. yüzyılda, geniş kapsamlı etkileri olan iki büyük bilimsel ilerleme kaydedildi. 1804 civarında, Alman eczacı Friedrich Sertürner, morfinleri afyondan izole etti. Kristalleşmesini, yapısını ve farmakolojik özelliklerini 1817'de iyi karşılanan bir makalede açıkladı. Morfin, modern bilimsel ilaç keşfinin başlangıcı olan herhangi bir tıbbi bitkiden izole edilen ilk alkaloiddi.
İkinci ilerleme, yaklaşık elli yıl sonra, Alexander Wood ve diğerleri tarafından hipodermik iğnenin rafine edilmesiydi. Subkutan iğneli bir cam şırınganın geliştirilmesi, birincil aktif bir bileşiğin kontrollü ölçülebilir dozlarının kolayca uygulanmasını mümkün kılmıştır.
Morfin başlangıçta ağrıyı hafifletme kabiliyeti nedeniyle harika bir ilaç olarak selamlandı. İnsanların uyumasına yardımcı olabilir, ve öksürük ve ishal kontrolü de dahil olmak üzere diğer yararlı yan etkilere sahipti. Doktorlar tarafından yaygın olarak reçete edildi ve eczacılar tarafından kısıtlama olmaksızın dağıtıldı. Amerikan İç Savaşı sırasında, afyon ve laudanum askerleri tedavi etmek için yaygın olarak kullanıldı. Ayrıca kadınlar, adet ağrısı ve "sinir karakterli" hastalıklar için sık sık reçete edildi. İlk başta (yanlışlıkla) bu yeni uygulama yönteminin bağımlılık yapmayacağı varsayılıyordu.
Kodein
Kodein 1832'de Pierre Jean Robiquet tarafından keşfedildi. Robiquet, İskoç kimyager William Gregory (1803-1858) tarafından tanımlanan morfin ekstraksiyonu için bir yöntemi gözden geçiriyordu. Gregory'nin prosedüründen kalan kalıntıyı işleyen Robiquet, afyonun diğer aktif bileşenlerinden kristalin bir maddeyi izole etti. Keşfi hakkında şunları yazdı: "İşte afyonda bulunan yeni bir madde ... Şimdiye kadar afyonun tek aktif prensibi olduğu düşünülen morfinin tüm etkileri hesaba katmadığını biliyoruz ve fizyologlar uzun süredir doldurulması gereken bir boşluk olduğunu iddia ediyorlar." Alkaloidi keşfetmesi, kodeine dayanan bir nesil antitussif ve antidiarreal ilaçların geliştirilmesine yol açtı.
Yarı sentetik ve sentetik opioidler
Sentetik opioidler icat edildi ve eylemleri için biyolojik mekanizmalar 20. yüzyılda keşfedildi. Bilim adamları bağımlılık yapmayan opioid formlarını aradılar, ancak bunun yerine daha güçlü olanları yarattılar. İngiltere'de Charles Romley Alder Wright, bağımlılık yapmayan bir afyon türevi arayışında yüzlerce afyon bileşiği geliştirdi. 1874'te, birkaç saat boyunca asetik anhidrit ile kaynatılmış morfini içeren asetilasyon adı verilen bir işlem kullanarak diamorfin (eroin) sentezleyen ilk kişi oldu.
Eroin, Bayer Laboratuvarları'nda Heinrich Dreser (1860-1924) için çalışan Felix Hoffmann (1868-1946) tarafından bağımsız olarak sentezlenene kadar çok az ilgi gördü. Dreser, yeni ilacı 1898'de tüberküloz, bronşit ve astım için analjezik ve öksürük tedavisi olarak piyasaya sürdü. Bayer, eroinin bağımlılık potansiyeli fark edildikten sonra 1913'te üretimi durdurdu.
1910'larda Almanya'da birkaç yarı sentetik opioid geliştirildi. İlki, oksimorfon, 1914'te afyon haşhaşlarında bir opioid alkaloid olan thebaine'den sentezlendi. Daha sonra, Martin Freund ve Edmund Speyer, 1916'da Frankfurt Üniversitesi'nde yine thebaine'den oksikodon geliştirdiler. 1920'de hidrokodon, Carl Mannich ve Helene Löwenheim tarafından kodeinden türetilerek hazırlandı. 1924'te hidromorfon, morfine hidrojen eklenerek sentezlendi. Etorfin, 1960 yılında afyon haşhaş samanındaki oripavin'den sentezlendi. Buprenorfin 1972 yılında keşfedildi.
İlk tam sentetik opioid, 1932'de IG Farben'de Alman kimyager Otto Eisleb (veya Eislib) tarafından tesadüfen bulunan meperidin (daha sonra demerol) idi. Meperidin, morfin ile ilgisi olmayan, ancak afyon benzeri özelliklere sahip bir yapıya sahip ilk afyondu. Analjezik etkileri 1939'da Otto Schaumann tarafından keşfedildi. Yine IG Farben'de bulunan Gustav Ehrhart ve Max Bockmühl, Eisleb ve Schaumann'ın çalışmaları üzerine inşa edildi. 1937 civarında "Hoechst 10820" (daha sonra metadon) geliştirdiler. 1959'da Belçikalı doktor Paul Janssen, eroinin gücünün 30 ila 50 katı olan sentetik bir ilaç olan fentanil geliştirdi. Şu anda yaklaşık 150 sentetik opioid bilinmektedir.
Kriminalizasyon ve tıbbi kullanım
Afyonun klinik olmayan kullanımı, Amerika Birleşik Devletleri'nde 1914 Harrison Narkotik Vergi Yasası ve diğer birçok yasa tarafından suç sayılmıştır. Opioidlerin kullanımı damgalandı ve ölmekte olan hastalar için sadece son çare olarak reçete edilmesi tehlikeli bir madde olarak görüldü. 1970 tarihli Kontrollü Maddeler Yasası sonunda Harrison Yasası'nın sertliğini hafifletti.
Birleşik Krallık'ta, Kraliyet Hekimler Koleji Başkanı'nın başkanlığındaki Morfin ve Eroin Bağımlılığı Bölüm Komitesi'nin 1926 tarihli raporu, tıbbi kontrolü yeniden ileri sürdü ve 1960'lara kadar süren "İngiliz kontrol sistemini" kurdu.
1980'lerde Dünya Sağlık Örgütü, farklı ağrı seviyeleri için opioidler de dahil olmak üzere ilaçların reçete edilmesi için kılavuzlar yayınladı. ABD'de, Kathleen Foley ve Russell Portenoy, opioidlerin "inatçı malign olmayan ağrı" vakaları için ağrı kesici olarak liberal kullanımının önde gelen savunucuları oldular. İddialarını destekleyecek çok az bilimsel kanıt veya hiç bilimsel kanıt olmadan, endüstri bilim adamları ve savunucuları kronik ağrısı olan kişilerin bağımlılığa karşı dirençli olacağını öne sürdüler.
1996 yılında OxyContin'in piyasaya sürülmesine, ağrı kesici için opioidlerin kullanımını teşvik eden agresif bir pazarlama kampanyası eşlik etti. Opioidlerin reçetelenmesinin artması, eroin için büyüyen bir karaborsayı körükledi. 2000 ve 2014 yılları arasında "ülke genelinde eroin kullanımında endişe verici bir artış ve aşırı dozda uyuşturucu ölümleri salgını" yaşandı. 224
Sonuç olarak, sağlık kuruluşları ve Sorumlu Opioid Reçeteleme Hekimleri gibi halk sağlığı grupları, opioidlerin reçetelenmesinde azalma çağrısında bulunmuştur. 2016 yılında, Hastalık Kontrol ve Önleme Merkezleri (CDC), opioidlerin "aktif kanser tedavisi, palyatif bakım ve yaşam sonu bakımı dışındaki kronik ağrı için" reçetelenmesi ve opioid sivrilmesinin artması için yeni bir dizi kılavuz yayınladı.
Kaynakça
- ^ Ogura, Takahiro; Egan, Talmage D. (2013). "Chapter 15 – Opioid Agonists and Antagonists". Pharmacology and physiology for anesthesia : foundations and clinical application. Philadelphia, PA: Elsevier/Saunders. ISBN 978-1-4377-1679-5.
- ^ Hemmings, Hugh C.; Egan, Talmage D. (2013). Pharmacology and Physiology for Anesthesia: Foundations and Clinical Application: Expert Consult – Online and Print. Elsevier Health Sciences. s. 253. ISBN 978-1437716795.
Opiate is the older term classically used in pharmacology to mean a drug derived from opium. Opioid, a more modern term, is used to designate all substances, both natural and synthetic, that bind to opioid receptors (including antagonists).
- ^ a b Stromgaard, Kristian; Krogsgaard-Larsen, Povl; Madsen, Ulf (2009). Textbook of Drug Design and Discovery, Fourth Edition. CRC Press. ISBN 9781439882405.
- ^ Walzer C (2014). "52 Nondomestic Equids". West G, Heard D, Caulkett N (Ed.). Zoo Animal and Wildlife Immobilization and Anesthesia. The Canadian Veterinary Journal. 51 (2nd bas.). Ames, USA: John Wiley & Sons. ss. 723, 727. doi:10.1002/9781118792919. ISBN 9781118792919. PMC 2871358 $2. Erişim tarihi: 8 Temmuz 2019.
- ^ "Carfentanil". www.drugbank.ca. Erişim tarihi: 8 Temmuz 2019.
- ^ Sterken J, Troubleyn J, Gasthuys F, Maes V, Diltoer M, Verborgh C (October 2004). "Intentional overdose of Large Animal Immobilon". European Journal of Emergency Medicine. 11 (5): 298-301. doi:10.1097/00063110-200410000-00013. PMID 15359207.
- ^ Lembke, Anna (2016). Drug Dealer, MD: How Doctors Were Duped, Patients Got Hooked, and Why It's So Hard to Stop. Johns Hopkins University Press. ISBN 978-1421421407.
- ^ "Drug Facts: Prescription Opioids". NIDA. June 2019. 12 Haziran 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Temmuz 2019.
- ^ "FDA requires strong warnings for opioid analgesics, prescription opioid cough products, and benzodiazepine labeling related to serious risks and death from combined use". FDA. 31 Ağustos 2016. Erişim tarihi: 1 Eylül 2016.
- ^ "Status and Trend Analysis of Illict [sic] Drug Markets". World Drug Report 2015 (PDF). Erişim tarihi: 26 Haziran 2015.
- ^ "Report III: FDA Approved Medications for the Treatment of Opiate Dependence: Literature Reviews on Effectiveness & Cost- Effectiveness, Treatment Research Institute". Advancing Access to Addiction Medications: Implications for Opioid Addiction Treatment. s. 41. 24 Şubat 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Şubat 2016.
- ^ Tetrault JM, Butner JL (September 2015). "Non-Medical Prescription Opioid Use and Prescription Opioid Use Disorder: A Review". The Yale Journal of Biology and Medicine. 88 (3): 227-33. PMC 4553642 $2. PMID 26339205.
- ^ Tarabar AF, Nelson LS (April 2003). "The resurgence and abuse of heroin by children in the United States". Current Opinion in Pediatrics. 15 (2): 210-5. doi:10.1097/00008480-200304000-00013. PMID 12640281.
- ^ Gray, Eliza (4 Şubat 2014). "Heroin Gains Popularity as Cheap Doses Flood the U.S". TIME.com. Erişim tarihi: 12 Şubat 2016.
- ^ Maltoni M (January 2008). "Opioids, pain, and fear". Annals of Oncology. 19 (1): 5-7. doi:10.1093/annonc/mdm555. PMID 18073220.
[A] number of studies, however, have also reported inadequate pain control in 40%–70% of patients, resulting in the emergence of a new type of epidemiology, that of 'failed pain control', caused by a series of obstacles preventing adequate cancer pain management.... The cancer patient runs the risk of becoming an innocent victim of a war waged against opioid abuse and addiction if the norms regarding the two kinds of use (therapeutic or nontherapeutic) are not clearly distinct. Furthermore, health professionals may be worried about regulatory scrutiny and may opt not to use opioid therapy for this reason.
- ^ McCarberg BH (March 2011). "Pain management in primary care: strategies to mitigate opioid misuse, abuse, and diversion". Postgraduate Medicine. 123 (2): 119-30. doi:10.3810/pgm.2011.03.2270. PMID 21474900.
- ^ a b Offermanns, Stefan (2008). Encyclopedia of Molecular Pharmacology. 1 (2 bas.). Springer Science & Business Media. s. 903. ISBN 9783540389163.
In the strict sense, opiates are drugs derived from opium and include the natural products morphine, codeine, thebaine and many semi-synthetic congeners derived from them. In the wider sense, opiates are morphine-like drugs with non-peptidic structures. The older term opiates is now more and more replaced by the term opioids which applies to any substance, whether endogenous or synthetic, peptidic or non-peptidic, that produces morphine-like effects through action on opioid receptors.
- ^ Freye, Enno (2008). "Part II. Mechanism of action of opioids and clinical effects". Opioids in Medicine: A Comprehensive Review on the Mode of Action and the Use of Analgesics in Different Clinical Pain States. Springer Science & Business Media. s. 85. ISBN 9781402059476.
Opiate is a specific term that is used to describe drugs (natural and semi-synthetic) derived from the juice of the opium poppy. For example morphine is an opiate but methadone (a completely synthetic drug) is not. Opioid is a general term that includes naturally occurring, semi-synthetic, and synthetic drugs, which produce their effects by combining with opioid receptors and are competitively antagonized by nalaxone. In this context the term opioid refers to opioid agonists, opioid antagonists, opioid peptides, and opioid receptors.
- ^ Davies, Pamela Stitzlein; D'Arcy, Yvonne M. (26 Eylül 2012). Compact Clinical Guide to Cancer Pain Management: An Evidence-Based Approach for Nurses. Springer Publishing Company. ISBN 9780826109743.
- ^ "21 U.S. Code § 802 – Definitions". LII / Legal Information Institute. Erişim tarihi: 12 Şubat 2016.
- ^ "Definition of NARCOTIC". www.merriam-webster.com. Erişim tarihi: 12 Şubat 2016.
- ^ Satoskar RS, Rege N, Bhandarkar SD (2015). Pharmacology and Pharmacotherapeutics. Elsevier Health Sciences. ISBN 9788131243718.
- ^ Ebert, Michael H.; Kerns, Robert D. (2010). Behavioral and Psychopharmacologic Pain Management. Cambridge University Press. ISBN 9781139493543.
- ^ Moore RA, Wiffen PJ, Derry S, Maguire T, Roy YM, Tyrrell L (November 2015). "Non-prescription (OTC) oral analgesics for acute pain - an overview of Cochrane reviews". The Cochrane Database of Systematic Reviews. 11 (11): CD010794. doi:10.1002/14651858.CD010794.pub2. PMC 6485506 $2. PMID 26544675.
- ^ a b Fleisher, Gary R.; Ludwig, Stephen (2010). Textbook of Pediatric Emergency Medicine. Lippincott Williams & Wilkins. s. 61. ISBN 9781605471594.
- ^ "Codeine". Drugs.com. 15 Mayıs 2022. Erişim tarihi: 31 Ocak 2023.
- ^ Alexander GC, Kruszewski SP, Webster DW (November 2012). "Rethinking opioid prescribing to protect patient safety and public health". JAMA. 308 (18): 1865-6. doi:10.1001/jama.2012.14282. PMID 23150006.
- ^ Mohamadi A, Chan JJ, Lian J, Wright CL, Marin AM, Rodriguez EK, von Keudell A, Nazarian A (August 2018). "Risk Factors and Pooled Rate of Prolonged Opioid Use Following Trauma or Surgery: A Systematic Review and Meta-(Regression) Analysis". The Journal of Bone and Joint Surgery. American Volume. 100 (15): 1332-1340. doi:10.2106/JBJS.17.01239. PMID 30063596.
- ^ Davis, Corey S.; Lieberman, Amy Judd; Hernandez-Delgado, Hector; Suba, Carli (1 Ocak 2019). "Laws limiting the prescribing or dispensing of opioids for acute pain in the United States: A national systematic legal review". Drug and Alcohol Dependence. 194: 166-172. doi:10.1016/j.drugalcdep.2018.09.022. ISSN 1879-0046. PMID 30445274.
- ^ Franklin GM (September 2014). "Opioids for chronic noncancer pain: a position paper of the American Academy of Neurology". Neurology. 83 (14): 1277-84. doi:10.1212/WNL.0000000000000839. PMID 25267983.
- ^ a b Okie S (November 2010). "A flood of opioids, a rising tide of deaths". The New England Journal of Medicine. 363 (21): 1981-5. doi:10.1056/NEJMp1011512. PMID 21083382.Responses to Okie's perspective: Rich JD, Green TC, McKenzie MS (February 2011). "Opioids and deaths". The New England Journal of Medicine. 364 (7): 686-687. doi:10.1056/NEJMc1014490. PMID 21323559.
- ^ Dowell D, Haegerich TM, Chou R (April 2016). "CDC Guideline for Prescribing Opioids for Chronic Pain--United States, 2016". JAMA. 315 (15): 1624-45. doi:10.1001/jama.2016.1464. PMC 6390846 $2. PMID 26977696.
- ^ McNicol E, Strassels SA, Goudas L, Lau J, Carr DB (January 2005). McNicol ED (Ed.). "NSAIDS or paracetamol, alone or combined with opioids, for cancer pain". The Cochrane Database of Systematic Reviews (1): CD005180. doi:10.1002/14651858.CD005180. PMID 15654708.
- ^ a b For information on the use and overuse of opioids to treat migraines, see American Academy of Neurology (February 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Academy of Neurology, erişim tarihi: 1 Ağustos 2013, which cites
- Silberstein SD (September 2000). "Practice parameter: evidence-based guidelines for migraine headache (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology. 55 (6): 754-62. doi:10.1212/WNL.55.6.754. PMID 10993991.
- Evers S, Afra J, Frese A, Goadsby PJ, Linde M, May A, Sándor PS (September 2009). "EFNS guideline on the drug treatment of migraine--revised report of an EFNS task force". European Journal of Neurology. 16 (9): 968-81. doi:10.1111/j.1468-1331.2009.02748.x. PMID 19708964.
- Institute for Clinical Systems Improvement (2011), Headache, Diagnosis and Treatment of, Institute for Clinical Systems Improvement, 29 Ekim 2013 tarihinde kaynağından arşivlendi, erişim tarihi: 18 Aralık 2013
- ^ Painter JT, Crofford LJ (March 2013). "Chronic opioid use in fibromyalgia syndrome: a clinical review". Journal of Clinical Rheumatology. 19 (2): 72-7. doi:10.1097/RHU.0b013e3182863447. PMID 23364665.
- ^ McNicol ED, Midbari A, Eisenberg E (August 2013). "Opioids for neuropathic pain". The Cochrane Database of Systematic Reviews. 8 (8): CD006146. doi:10.1002/14651858.CD006146.pub2. PMC 6353125 $2. PMID 23986501.
- ^ a b c American Headache Society (September 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Headache Society, 3 Aralık 2013 tarihinde kaynağından arşivlendi, erişim tarihi: 10 Aralık 2013, which cites
- Bigal ME, Lipton RB (April 2009). "Excessive opioid use and the development of chronic migraine". Pain. 142 (3): 179-82. doi:10.1016/j.pain.2009.01.013. PMID 19232469.
- Bigal ME, Serrano D, Buse D, Scher A, Stewart WF, Lipton RB (September 2008). "Acute migraine medications and evolution from episodic to chronic migraine: a longitudinal population-based study". Headache. 48 (8): 1157-68. doi:10.1111/j.1526-4610.2008.01217.x. PMID 18808500.
- Scher AI, Stewart WF, Ricci JA, Lipton RB (November 2003). "Factors associated with the onset and remission of chronic daily headache in a population-based study". Pain. 106 (1–2): 81-9. doi:10.1016/S0304-3959(03)00293-8. PMID 14581114.
- Katsarava Z, Schneeweiss S, Kurth T, Kroener U, Fritsche G, Eikermann A, Diener HC, Limmroth V (March 2004). "Incidence and predictors for chronicity of headache in patients with episodic migraine". Neurology. 62 (5): 788-90. doi:10.1212/01.WNL.0000113747.18760.D2. PMID 15007133.
- ^ Manchikanti L, Helm S, Fellows B, Janata JW, Pampati V, Grider JS, Boswell MV (July 2012). "Opioid epidemic in the United States". Pain Physician. 15 (3 Suppl): ES9-38. doi:10.36076/ppj.2012/15/ES9. PMID 22786464.
- ^ Chou R, Ballantyne JC, Fanciullo GJ, Fine PG, Miaskowski C (February 2009). "Research gaps on use of opioids for chronic noncancer pain: findings from a review of the evidence for an American Pain Society and American Academy of Pain Medicine clinical practice guideline". The Journal of Pain. 10 (2): 147-59. doi:10.1016/j.jpain.2008.10.007. PMID 19187891.
- ^ "PAIN". Painjournalonline.com. 1 Eylül 2015. Erişim tarihi: 7 Ocak 2016.
- ^ Kissin I (28 Eylül 2015). "Long-term opioid treatment of chronic nonmalignant pain: unproven efficacy and neglected safety?". Journal of Pain Research. 6: 513-29. doi:10.2147/JPR.S47182. PMC 3712997 $2. PMID 23874119.
- ^ Dhalla IA, Gomes T, Mamdani MM, Juurlink DN (January 2012). "Opioids versus nonsteroidal anti-inflammatory drugs in noncancer pain". Canadian Family Physician. 58 (1): 30. PMC 3264005 $2. PMID 22267615.
- ^ Marret E, Beloeil H, Lejus C (March 2009). "[What are the benefits and risk of non-opioid analgesics combined with postoperative opioids?]". Annales Françaises d'Anesthésie et de Réanimation. 28 (3): e135-51. doi:10.1016/j.annfar.2009.01.006. PMID 19304445.
- ^ Franceschi F, Iacomini P, Marsiliani D, Cordischi C, Antonini EF, Alesi A, Giacobelli D, Zuccalà G (August 2013). "Safety and efficacy of the combination acetaminophen-codeine in the treatment of pain of different origin" (PDF). European Review for Medical and Pharmacological Sciences. 17 (16): 2129-35. PMID 23893177.
- ^ Chung, K. Fan; Widdicombe, John (2008). Pharmacology and therapeutics of cough. Berlin: Springer. s. 248. ISBN 9783540798422.
- ^ Bolser DC, Davenport PW (February 2007). "Codeine and cough: an ineffective gold standard". Current Opinion in Allergy and Clinical Immunology. 7 (1): 32-6. doi:10.1097/ACI.0b013e3280115145. PMC 2921574 $2. PMID 17218808.
- ^ a b Goldman RD (December 2010). "Codeine for acute cough in children". Canadian Family Physician. 56 (12): 1293-4. PMC 3001921 $2. PMID 21156892.
- ^ Paul IM (February 2012). "Therapeutic options for acute cough due to upper respiratory infections in children". Lung. 190 (1): 41-4. doi:10.1007/s00408-011-9319-y. PMID 21892785.
- ^ Verlee L, Verheij TJ, Hopstaken RM, Prins JM, Salomé PL, Bindels PJ (2012). "[Summary of NHG practice guideline 'Acute cough']". Nederlands Tijdschrift voor Geneeskunde. 156: A4188. PMID 22917039.
- ^ Matthys H, Bleicher B, Bleicher U (1983). "Dextromethorphan and codeine: objective assessment of antitussive activity in patients with chronic cough". The Journal of International Medical Research. 11 (2): 92-100. doi:10.1177/030006058301100206. PMID 6852361.
- ^ Van Amburgh JA. "Do Cough Remedies Work?". Medscape. Erişim tarihi: 10 Nisan 2016.
- ^ Bolser DC (February 2010). "Pharmacologic management of cough". Otolaryngologic Clinics of North America. 43 (1): 147-55, xi. doi:10.1016/j.otc.2009.11.008. PMC 2827356 $2. PMID 20172264.
- ^ Webster LR (October 2015). "Opioid-Induced Constipation". Pain Medicine. 16 Suppl 1: S16-21. doi:10.1111/pme.12911. PMID 26461071.
- ^ "Press Announcements - FDA approves Movantik for opioid-induced constipation". www.fda.gov. Erişim tarihi: 18 Şubat 2016.
- ^ Gallagher R (July 2011). "The use of opioids for dyspnea in advanced disease". CMAJ. 183 (10): 1170. doi:10.1503/cmaj.110024. PMC 3134725 $2. PMID 21746829.
- ^ Wiseman R, Rowett D, Allcroft P, Abernethy A, Currow DC (March 2013). "Chronic refractory dyspnoea--evidence based management". Australian Family Physician. 42 (3): 137-40. PMID 23529525.
- ^ Dy, Sydney M.; Gupta, Arjun; Waldfogel, Julie M.; Sharma, Ritu; Zhang, Allen; Feliciano, Josephine L.; Sedhom, Ramy; Day, Jeff; Gersten, Rebecca A.; Davidson, Patricia M.; Bass, Eric B. (19 Kasım 2020). "Interventions for Breathlessness in Patients With Advanced Cancer". doi:10.23970/ahrqepccer232. PMID 33289989.
- ^ Feliciano JL, Waldfogel JM, Sharma R, Zhang A, Gupta A, Sedhom R, Day J, Bass EB, Dy SM (February 2021). "Pharmacologic Interventions for Breathlessness in Patients With Advanced Cancer: A Systematic Review and Meta-analysis". JAMA Network Open. 4 (2): e2037632. doi:10.1001/jamanetworkopen.2020.37632. PMC 7907959 $2. PMID 33630086.
- ^ Higgins C, Smith BH, Matthews K (June 2019). "Evidence of opioid-induced hyperalgesia in clinical populations after chronic opioid exposure: a systematic review and meta-analysis" (PDF). British Journal of Anaesthesia. 122 (6): e114-e126. doi:10.1016/j.bja.2018.09.019. PMID 30915985.
- ^ Yang, David Z.; Sin, Billy; Beckhusen, Joshua; Xia, Dawei; Khaimova, Rebecca; Iliev, Ilia (May–June 2019). "Opioid-Induced Hyperalgesia in the Nonsurgical Setting: A Systematic Review". American Journal of Therapeutics. 26 (3): e397-e405. doi:10.1097/MJT.0000000000000734. ISSN 1536-3686. PMID 29726847.
- ^ a b c d e f g Furlan AD, Sandoval JA, Mailis-Gagnon A, Tunks E (May 2006). "Opioids for chronic noncancer pain: a meta-analysis of effectiveness and side effects". CMAJ. 174 (11): 1589–94. doi:10.1503/cmaj.051528. PMC 1459894 $2. PMID 16717269.
- ^ Parthvi R, Agrawal A, Khanijo S, Tsegaye A, Talwar A (May–June 2019). "Acute Opiate Overdose: An Update on Management Strategies in Emergency Department and Critical Care Unit". American Journal of Therapeutics. 26 (3): e380-e387. doi:10.1097/MJT.0000000000000681. PMID 28952972.
- ^ Baumann S (2009). "A nursing approach to pain in older adults". Medsurg Nursing. 18 (2): 77-82; quiz 83. PMID 19489204.
- ^ Buckeridge D, Huang A, Hanley J, Kelome A, Reidel K, Verma A, Winslade N, Tamblyn R (September 2010). "Risk of injury associated with opioid use in older adults". Journal of the American Geriatrics Society. 58 (9): 1664-70. doi:10.1111/j.1532-5415.2010.03015.x. PMID 20863326.
- ^ Schneider JP (2010). "Rational use of opioid analgesics in chronic musculoskeletal pain". J Musculoskel Med. 27: 142-148.
- ^ Sanger N, Bhatt M, Singhal N, Ramsden K, Baptist-Mohseni N, Panesar B, Shahid H, Hillmer A, D Elia A, Luo C, Rogers V, Arunan A, Baker-Beal L, Haber S, Henni J, Puckering M, Sun S, Ng K, Sanger S, Mouravaska N, Samaan MC, de Souza R, Thabane L, Samaan Z (March 2019). "Adverse Outcomes Associated with Prescription Opioids for Acute Low Back Pain: A Systematic Review and Meta-Analysis". Pain Physician. 22 (2): 119-138. PMID 30921976.
- ^ Fuggle N, Curtis E, Shaw S, Spooner L, Bruyère O, Ntani G, Parsons C, Conaghan PG, Corp N, Honvo G, Uebelhart D, Baird J, Dennison E, Reginster JY, Cooper C (April 2019). "Safety of Opioids in Osteoarthritis: Outcomes of a Systematic Review and Meta-Analysis". Drugs & Aging. 36 (Suppl 1): 129-143. doi:10.1007/s40266-019-00666-9. PMC 6509215 $2. PMID 31073926.
- ^ Stephens, Everett (23 Kasım 2015). "Opioid Toxicity". Medscape. Erişim tarihi: 24 Şubat 2016.
The CDC reported that methadone contributed to 31.4% of opioid-related deaths in the United States from 1999–2010. Methadone also accounted for 39.8% of all single-drug opioid-related deaths. The overdose death rate associated with methadone was significantly higher than that associated with other opioid-related deaths among multidrug and single-drug deaths.
- ^ a b c d e Noble M, Treadwell JR, Tregear SJ, Coates VH, Wiffen PJ, Akafomo C, Schoelles KM (January 2010). Noble M (Ed.). "Long-term opioid management for chronic noncancer pain". The Cochrane Database of Systematic Reviews. 2018 (1): CD006605. doi:10.1002/14651858.CD006605.pub2. PMC 6494200 $2. PMID 20091598.
- ^ "Drug Overdose Deaths in the United States, 1999–2016" (PDF). CDC. Erişim tarihi: 23 Aralık 2017.
- ^ a b c d Abuse, National Institute on Drug (2023-02-09). "Drug Overdose Death Rates". National Institute on Drug Abuse (İngilizce). Erişim tarihi: 2023-02-23.
- ^ Pradhan AA, Walwyn W, Nozaki C, Filliol D, Erbs E, Matifas A, ve diğerleri. (December 2010). "Ligand-directed trafficking of the δ-opioid receptor in vivo: two paths toward analgesic tolerance". The Journal of Neuroscience. 30 (49): 16459–68. doi:10.1523/JNEUROSCI.3748-10.2010. PMC 3086517 $2. PMID 21147985.
- ^ Kollars JP, Larson MD (March 2005). "Tolerance to miotic effects of opioids". Anesthesiology. 102 (3): 701. doi:10.1097/00000542-200503000-00047. PMID 15731628.
- ^ Santillán R, Hurlé MA, Armijo JA, de los Mozos R, Flórez J (May 1998). "Nimodipine-enhanced opiate analgesia in cancer patients requiring morphine dose escalation: a double-blind, placebo-controlled study". Pain. 76 (1–2): 17–26. doi:10.1016/S0304-3959(98)00019-0. PMID 9696455.
- ^ Smith FL, Dombrowski DS, Dewey WL (February 1999). "Involvement of intracellular calcium in morphine tolerance in mice". Pharmacology, Biochemistry, and Behavior. 62 (2): 381–8. doi:10.1016/S0091-3057(98)00168-3. PMID 9972707.
- ^ Santillán R, Maestre JM, Hurlé MA, Flórez J (July 1994). "Enhancement of opiate analgesia by nimodipine in cancer patients chronically treated with morphine: a preliminary report". Pain. 58 (1): 129–32. doi:10.1016/0304-3959(94)90192-9. PMID 7970835.
- ^ McCarthy RJ, Kroin JS, Tuman KJ, Penn RD, Ivankovich AD (April 1998). "Antinociceptive potentiation and attenuation of tolerance by intrathecal co-infusion of magnesium sulfate and morphine in rats". Anesthesia and Analgesia. 86 (4): 830–6. doi:10.1097/00000539-199804000-00028. PMID 9539610.
- ^ Morrison AP, Hunter JM, Halpern SH, Banerjee A (May 2013). "Effect of intrathecal magnesium in the presence or absence of local anaesthetic with and without lipophilic opioids: a systematic review and meta-analysis". British Journal of Anaesthesia. 110 (5): 702–12. doi:10.1093/bja/aet064. PMID 23533255.
- ^ Larson AA, Kovács KJ, Spartz AK (November 2000). "Intrathecal Zn2+ attenuates morphine antinociception and the development of acute tolerance". European Journal of Pharmacology. 407 (3): 267–72. doi:10.1016/S0014-2999(00)00715-9. PMID 11068022.
- ^ Wong CS, Cherng CH, Luk HN, Ho ST, Tung CS (February 1996). "Effects of NMDA receptor antagonists on inhibition of morphine tolerance in rats: binding at mu-opioid receptors". European Journal of Pharmacology. 297 (1–2): 27–33. doi:10.1016/0014-2999(95)00728-8. PMID 8851162.
- ^ Malec D, Mandryk M, Fidecka S (Mar–Apr 2008). "Interaction of memantine and ketamine in morphine- and pentazocine-induced antinociception in mice" (PDF). Pharmacological Reports. 60 (2): 149–55. PMID 18443375.
- ^ Watkins LR, Kinscheck IB, Mayer DJ (April 1984). "Potentiation of opiate analgesia and apparent reversal of morphine tolerance by proglumide". Science. 224 (4647): 395–6. Bibcode:1984Sci...224..395W. doi:10.1126/science.6546809. PMID 6546809.
- ^ Tang J, Chou J, Iadarola M, Yang HY, Costa E (June 1984). "Proglumide prevents and curtails acute tolerance to morphine in rats". Neuropharmacology. 23 (6): 715–8. doi:10.1016/0028-3908(84)90171-0. PMID 6462377.
- ^ McCleane GJ (2003). "The cholecystokinin antagonist proglumide enhances the analgesic effect of dihydrocodeine". The Clinical Journal of Pain. 19 (3): 200–1. doi:10.1097/00002508-200305000-00008. PMID 12792559.
- ^ Ledeboer A, Hutchinson MR, Watkins LR, Johnson KW (July 2007). "Ibudilast (AV-411). A new class therapeutic candidate for neuropathic pain and opioid withdrawal syndromes". Expert Opinion on Investigational Drugs. 16 (7): 935–50. doi:10.1517/13543784.16.7.935. PMID 17594181.
- ^ a b c Doyle D, Hanks G, Cherney I, Calman K, (Ed.) (2004). Oxford Textbook of Palliative Medicine (3rd bas.). Oxford University Press. ISBN 978-0198566984.
- ^ Hermann D, Klages E, Welzel H, Mann K, Croissant B (June 2005). "Low efficacy of non-opioid drugs in opioid withdrawal symptoms". Addiction Biology. 10 (2): 165–9. doi:10.1080/13556210500123514. PMID 16191669.
- ^ Brown TK (March 2013). "Ibogaine in the treatment of substance dependence". Current Drug Abuse Reviews. 6 (1): 3–16. doi:10.2174/15672050113109990001. PMID 23627782.
- ^ Duceppe, Marc-Alexandre; Perreault, Marc M.; Frenette, Anne Julie; Burry, Lisa D.; Rico, Philippe; Lavoie, Annie; Gélinas, Céline; Mehta, Sangeeta; Dagenais, Maryse; Williamson, David R. (April 2019). "Frequency, risk factors and symptomatology of iatrogenic withdrawal from opioids and benzodiazepines in critically Ill neonates, children and adults: A systematic review of clinical studies". Journal of Clinical Pharmacy and Therapeutics. 44 (2): 148–156. doi:10.1111/jcpt.12787. ISSN 1365-2710. PMID 30569508.
- ^ Bannwarth B (September 2012). "Will abuse-deterrent formulations of opioid analgesics be successful in achieving their purpose?". Drugs. 72 (13): 1713–23. doi:10.2165/11635860-000000000-00000. PMID 22931520.
- ^ Schneider JP, Matthews M, Jamison RN (October 2010). "Abuse-deterrent and tamper-resistant opioid formulations: what is their role in addressing prescription opioid abuse?". CNS Drugs. 24 (10): 805–10. doi:10.2165/11584260-000000000-00000. PMID 20839893.
- ^ Xu Y, Johnson A (2013). "Opioid therapy pharmacogenomics for noncancer pain: efficacy, adverse events, and costs". Pain Research and Treatment. 2013: 943014. doi:10.1155/2013/943014. PMC 3791560 $2. PMID 24167729.
- ^ Brush DE (December 2012). "Complications of long-term opioid therapy for management of chronic pain: the paradox of opioid-induced hyperalgesia". Journal of Medical Toxicology. 8 (4): 387–92. doi:10.1007/s13181-012-0260-0. PMC 3550256 $2. PMID 22983894.
- ^ Malik Z, Baik D, Schey R (February 2015). "The role of cannabinoids in regulation of nausea and vomiting, and visceral pain". Current Gastroenterology Reports. 17 (2): 429. doi:10.1007/s11894-015-0429-1. PMID 25715910.
- ^ Abrams DI, Guzman M (June 2015). "Cannabis in cancer care". Clinical Pharmacology and Therapeutics. 97 (6): 575–86. doi:10.1002/cpt.108. PMID 25777363.
- ^ "UCSF Study Finds Medical Marijuana Could Help Patients Reduce Pain with Opiates". UC San Francisco. Erişim tarihi: 4 March 2016.
- ^ Abrams DI, Couey P, Shade SB, Kelly ME, Benowitz NL (December 2011). "Cannabinoid-opioid interaction in chronic pain". Clinical Pharmacology and Therapeutics. 90 (6): 844–51. doi:10.1038/clpt.2011.188. PMID 22048225.
- ^ Frauenknecht J, Kirkham KR, Jacot-Guillarmod A, Albrecht E (May 2019). "Analgesic impact of intra-operative opioids vs. opioid-free anaesthesia: a systematic review and meta-analysis". Anaesthesia. 74 (5): 651–662. doi:10.1111/anae.14582. PMID 30802933.
- ^ Busse, Jason W.; Wang, Li; Kamaleldin, Mostafa; Craigie, Samantha; Riva, John J.; Montoya, Luis; Mulla, Sohail M.; Lopes, Luciane C.; Vogel, Nicole; Chen, Eric; Kirmayr, Karin (2018-12-18). "Opioids for Chronic Noncancer Pain: A Systematic Review and Meta-analysis". JAMA (İngilizce). 320 (23): 2448–2460. doi:10.1001/jama.2018.18472. ISSN 0098-7484. PMC 6583638 $2. PMID 30561481.
- ^ Reissig JE, Rybarczyk AM (April 2005). "Pharmacologic treatment of opioid-induced sedation in chronic pain". The Annals of Pharmacotherapy. 39 (4): 727–31. doi:10.1345/aph.1E309. PMID 15755795.
- ^ Corey PJ, Heck AM, Weathermon RA (December 1999). "Amphetamines to counteract opioid-induced sedation". The Annals of Pharmacotherapy. 33 (12): 1362–6. doi:10.1345/aph.19024. PMID 10630837.