Sürü bağışıklığı

Sürü bağışıklığı (sürü etkisi, topluluk bağışıklığı, nüfus bağışıklığı veya kitle bağışıklığı olarak da adlandırılır), yalnızca bulaşıcı hastalıklar için geçerli olan bir dolaylı koruma şeklidir. Bir popülasyonun yeterli bir yüzdesi, önceki enfeksiyonlar veya aşılama yoluyla bir enfeksiyona karşı bağışıklık kazandığında ortaya çıkar[1] ve böylece bağışıklığı olmayan bireyler için enfeksiyon olasılığını azaltır.[2][3][4]
Sürü bağışıklığına ulaşıldığında, hastalık bir popülasyondan kademeli olarak kaybolur ve dünya çapında başarılırsa eradikasyon veya enfeksiyonların kalıcı olarak sıfıra indirilmesi ile sonuçlanabilir.[5][6] Aşılama yoluyla oluşturulan sürü bağışıklığı birçok hastalığın azalmasına katkıda bulunmuştur.[7]
Etkileri[değiştir | kaynağı değiştir]
Bağışıklığı olmayanların korunması[değiştir | kaynağı değiştir]

Bazı bireyler aşılandıktan sonra bağışıklık geliştiremez veya tıbbi nedenlerle aşılanamaz.[8][9][10] Yenidoğan bebekler, güvenlik nedenleriyle ya da pasif bağışıklık aşıyı etkisiz hale getirdiği için birçok aşıyı almak için çok küçüktür.[11] HIV/AIDS, lenfoma, lösemi, kemik iliği kanseri, dalak bozukluğu, kemoterapi veya radyoterapi nedeniyle bağışıklık sistemi yetersiz olan kişiler daha önce sahip oldukları bağışıklığı kaybetmiş olabilirler ve bağışıklık yetersizlikleri nedeniyle aşılar bu kişiler için herhangi bir fayda sağlamayabilir.[9][10][11][12]
Aşılananların bir kısmı uzun süreli bağışıklık geliştirmeyebilir.[2][13][14] Aşı kontrendikasyonları bazı bireylerin aşılanmasını engelleyebilir.[10] Bağışık sahibi olmamanın yanı sıra, bu gruplardan birinde yer alan bireyler, tıbbi durumları nedeniyle enfeksiyondan kaynaklanan komplikasyonlar geliştirme açısından daha büyük bir risk altında olabilirler, ancak nüfusun yeterince büyük bir yüzdesi bağışıksa yine de korunabilirler.[9][10][14][15]
Bir yaş grubunda yüksek düzeyde bağışıklık, diğer yaş grupları için sürü bağışıklığı oluşturabilir.[7] Yetişkinlerin boğmacaya karşı aşılanması, aşılanamayacak kadar küçük olan ve hastalıktan kaynaklanan komplikasyonlar açısından en büyük risk altında bulunan bebeklerde boğmaca görülme sıklığını azaltır.[16][17] Bu, özellikle küçük bebeklere bulaşmaların çoğundan sorumlu olan yakın aile üyeleri için önemlidir.[7][14] Aynı şekilde, çocuklara pnömokok aşısı yapılması, aşılanmamış küçük kardeşler arasında pnömokok hastalığı görülme sıklığını azaltır.[18] Çocukları pnömokok ve rotavirüse karşı aşılamak, normalde bu aşıları almayan daha büyük çocuklar ve yetişkinler için pnömokok ve rotavirüse bağlı hastaneye yatışları azaltma etkisine sahiptir.[18][19][20] İnfluenza (grip) yaşlılarda daha genç yaş gruplarına göre daha ağır seyretmektedir, ancak yaşla birlikte bağışıklık sisteminin zayıflaması nedeniyle influenza aşıları bu demografik grupta etkili değildir.[7][21] Yaşlıları aşılamaktan daha etkili olan mevsimsel grip aşılaması için okul çağındaki çocuklara öncelik verilmesinin, yaşlılar için belirli bir koruma derecesi yarattığı gösterilmiştir.[7][21]
Cinsel yolla bulaşan enfeksiyonlar (CYBE) için, bir cinsiyetteki heteroseksüellerde yüksek düzeyde bağışıklık, her iki cinsiyetteki heteroseksüeller için sürü bağışıklığına neden olur.[22][23][24] Bir cinsiyetteki heteroseksüelleri hedef alan CYBE'lere karşı aşılar, hedef cinsiyette aşı alımının yüksek olması durumunda her iki cinsiyetteki heteroseksüellerde CYBE'lerde önemli oranda düşüş sağlar.[23][24][25] Ancak kadınların aşılanmasından kaynaklanan sürü bağışıklığı, erkeklerle cinsel ilişkiye giren erkekleri kapsamamaktadır.[24] Yüksek riskli davranışlar CYBE'lerin ortadan kaldırılmasını zorlaştırmaktadır, çünkü enfeksiyonların çoğu orta derecede riskli bireyler arasında meydana gelse de bulaşmaların çoğu yüksek riskli davranışlarda bulunan bireyler nedeniyle meydana gelmektedir.[22] Bu nedenle, belirli popülasyonlarda yüksek riskli bireylerin cinsiyete bakılmaksızın aşılanması gerekebilir.[22][24]
Evrimsel baskı ve serotip değişimi[değiştir | kaynağı değiştir]
Sürü bağışıklığının kendisi patojenler üzerinde evrimsel bir baskı görevi görerek, sürü bağışıklığından kaçabilen ve daha önce bağışıklığı olan bireyleri enfekte edebilen, kaçış mutantları olarak adlandırılan yeni suşların üretimini teşvik ederek viral evrimi etkiler.[26][27] Yeni suşların evrimi, yüksek bağışıklık seviyeleri nedeniyle belirli bir serotipin yaygınlığı azaldıkça, diğer serotiplerin onun yerini almasına izin verdiği için serotip değişimi veya serotip kayması olarak bilinir.[28][29]
Moleküler düzeyde, virüsler antijenik kayma yoluyla sürü bağışıklığından kaçar; bu, mutasyonların viral genomun virüsün yüzey antijenini kodlayan kısmında, tipik olarak virüs kapsidinin bir proteininde birikmesi ve viral epitopta bir değişiklik meydana getirmesidir.[30][31] Alternatif olarak, dolaşımda daha fazla suş olduğunda daha yaygın olan ayrı viral genom segmentlerinin yeniden birleşmesi veya antijenik kayma da yeni serotipler üretebilir.[26][32] Bunlardan herhangi biri meydana geldiğinde, bellek T hücreleri artık virüsü tanımaz, bu nedenle insanlar dolaşımdaki baskın suşa karşı bağışık değildir.[31][32] Hem influenza hem de norovirüs için salgınlar, yeni bir baskın tür ortaya çıkana kadar geçici olarak sürü bağışıklığını tetikler ve birbirini izleyen salgın dalgalarına neden olur.[30][32] Bu evrim, sürü bağışıklığı için bir zorluk teşkil ettiğinden, geniş nötralize edici antikorlar ve belirli bir serotipin ötesinde koruma sağlayabilen "evrensel" aşılar geliştirilmektedir.[27][33][34]
Streptococcus pneumoniae'ye karşı ilk aşılar, antibiyotiğe dirençli tipler de dahil olmak üzere aşı serotiplerinin (VT'ler) nazofarengeal taşınmasını önemli ölçüde azaltmış,[18][35] ancak aşı olmayan serotiplerin (NVT'ler) taşınmasının artmasıyla tamamen dengelenmiştir.[18][28][29] Ancak NVT'ler VT'lerden daha az invaziv olduğundan, bu durum hastalık insidansında orantılı bir artışa yol açmamıştır.[28] O zamandan bu yana, ortaya çıkan serotiplere karşı koruma sağlayan pnömokok aşıları piyasaya sürülmüş ve bu serotiplerin ortaya çıkışını başarıyla engellemiştir.[18] Gelecekte kayma olasılığı devam etmektedir, bu nedenle bununla başa çıkmak için VT kapsamının genişletilmesi ve daha fazla yüzey antijenine sahip öldürülmüş bütün hücreler veya birden fazla serotipte bulunan proteinler kullanan aşıların geliştirilmesi gibi başka stratejiler de bulunmaktadır.[18][36]
Hastalıkların yok edilmesi[değiştir | kaynağı değiştir]
Bir popülasyonda sürü bağışıklığı oluşturulmuş ve yeterli bir süre boyunca sürdürülmüşse hastalık kaçınılmaz olarak ortadan kaldırılır - artık endemik bulaşmalar meydana gelmez.[5] Dünya çapında eliminasyon sağlanır ve vaka sayısı kalıcı olarak sıfıra indirilirse o zaman bir hastalığın eradike edildiği ilan edilebilir.[6] Bu nedenle eradikasyon, bulaşıcı hastalığın yayılmasını kontrol altına almaya yönelik halk sağlığı girişimlerinin nihai etkisi veya nihai sonucu olarak kabul edilebilir.[6][7] Sürü bağışıklığının tehlikeye girdiği durumlarda ise, tam tersine, aşılanmamış nüfus arasında hastalık salgınlarının ortaya çıkması muhtemeldir.[37]
Eradikasyonun faydaları arasında hastalığın neden olduğu tüm morbidite ve mortalitenin sona erdirilmesi, bireyler, sağlık hizmeti sağlayıcıları ve hükümetler için mali tasarruf ve hastalığı kontrol etmek için kullanılan kaynakların başka yerlerde kullanılmasına olanak sağlanması yer almaktadır.[6] Bugüne kadar, sürü bağışıklığı ve aşılama kullanılarak iki hastalık ortadan kaldırılmıştır: rinderpest ve çiçek hastalığı.[2][7][38] Sürü bağışıklığına dayanan eradikasyon çabaları şu anda çocuk felci için devam etmektedir, ancak sivil huzursuzluk ve modern tıbba güvensizlik bunu zorlaştırmıştır.[2][39] Yeterli sayıda insanın aşı olmayı tercih etmemesi durumunda zorunlu aşılama eradikasyon çabaları için faydalı olabilir.[40][41][42][43]
Bedavacılık[değiştir | kaynağı değiştir]
Sürü bağışıklığı bedavacılık sorununa karşı savunmasızdır.[44] Aşı yaptırmamayı tercih edenler de dahil olmak üzere bağışıklığı olmayan bireyler, bağışıklığı olanların yarattığı sürü bağışıklığından ücretsiz yararlanırlar.[44] Bir popülasyondaki bedavacıların sayısı arttıkça, sürü bağışıklığının kaybı nedeniyle önlenebilir hastalık salgınları daha yaygın ve daha şiddetli hale gelir.[41][43][45][46][47] Bireyler, aşıların etkisiz olduğu[48] veya aşılarla ilişkili risklerin enfeksiyonla ilişkili risklerden daha büyük olduğu inancı,[2][46][47][48] aşılara veya halk sağlığı yetkililerine güvensizlik,[49] sürü psikolojisi veya grup düşüncesi,[41][50] sosyal normlar veya akran baskısı[48] ve dini inançlar[46] da dahil olmak üzere çeşitli nedenlerle aşı yaptırmakta tereddüt edebilirler. Aşılama oranlarının bir kişiyi aşı olmasına gerek olmadığına ikna edecek kadar yüksek olması durumunda, bazı bireylerin aşı olmamayı tercih etme olasılığı daha yüksektir, çünkü diğerlerinin yeterli bir yüzdesi zaten bağışıklıdır.[2][43]
Mekanizma[değiştir | kaynağı değiştir]
Bir hastalığa karşı bağışıklığı olan bireyler, hastalığın yayılmasında bir bariyer görevi görerek hastalığın başkalarına bulaşmasını yavaşlatır veya önler.[51] Bir bireyin bağışıklığı doğal bir enfeksiyon yoluyla veya aşılama gibi yapay yollarla kazanılabilir.[51] Sürü bağışıklık eşiği (SBE) veya sürü bağışıklık seviyesi (SBS) olarak adlandırılan, nüfusun kritik bir oranı bağışıklık kazandığında, hastalık artık popülasyonda devam etmeyebilir ve endemik olmaktan çıkabilir.[5][26]
Sürü bağışıklığının teorik temeli genellikle aşıların katı bağışıklığa neden olduğunu, popülasyonların rastgele karıştığını, patojenin bağışıklık yanıtından kaçmak için evrimleşmediğini ve hastalık için insan dışı bir vektör olmadığını varsayar.[2]
Teorik temel[değiştir | kaynağı değiştir]
Belirli bir popülasyonda kritik değer veya eşik, hastalığın endemik bir kararlı duruma ulaştığı noktadır; bu da enfeksiyon seviyesinin üstel olarak ne arttığı ne de azaldığı anlamına gelir. Bu eşik, temel çoğalma sayısı R0, homojen veya iyi karışmış, yani her bir bireyin popülasyondaki diğer duyarlı bireylerle temas etme olasılığının eşit olduğu, tamamen duyarlı bir popülasyonda her vakanın neden olduğu ortalama yeni enfeksiyon sayısı S,[22][26][40] popülasyonun enfeksiyona duyarlı oranı çarpımının alınması ve bu çarpımın 1'e eşit olarak ayarlanmasıyla elde edilen etkin üreme sayısı Re'den hesaplanabilir:[kaynak belirtilmeli]
S, (1 - p) olarak yeniden yazılabilir; burada p, p + S'nin bire eşit olması için bağışık olan nüfusun oranıdır. Daha sonra denklem, p'yi kendi başına yerleştirecek şekilde aşağıdaki gibi yeniden düzenlenebilir:[kaynak belirtilmeli]
p denklemin sol tarafında tek başına yer aldığından, hastalığın bulaşmasını durdurmak için bağışık olması gereken kritik nüfus oranını temsil eden pc olarak yeniden adlandırılabilir, bu da "sürü bağışıklık eşiği" (SBE) ile aynıdır.[22] R0 bulaşıcılığın bir ölçüsü olarak işlev görür, bu nedenle düşük R0 değerleri daha düşük SBE'lerle ilişkilendirilirken, daha yüksek R0'lar daha yüksek SBE'lerle sonuçlanır.[26][40] Örneğin, R0 değeri 2 olan bir hastalık için SBE teorik olarak sadece %50 iken, R0 değeri 10 olan bir hastalık için teorik SBE %90'dır.[26]
Bulaşıcı bir hastalığın etkin çoğalma sayısı Re, enfeksiyon başına 1 yeni bireye düşürüldüğünde ve bunun altında tutulduğunda, popülasyonda meydana gelen vaka sayısı hastalık ortadan kalkana kadar kademeli olarak azalır.[22][26][52] Eğer bir popülasyon, bir hastalığa karşı o hastalığın SBE'sinden daha fazla bağışıklığa sahipse vaka sayısı daha hızlı bir şekilde azalır, salgınların meydana gelme olasılığı daha da düşüktür ve meydana gelen salgınlar aksi takdirde olacağından daha küçüktür.[2][22] Etkili üreme sayısı 1'in üzerine çıkarsa hastalık ne sabit bir durumdadır ne de görülme sıklığı azalmaktadır, ancak nüfus içinde aktif olarak yayılmakta ve normalden daha fazla sayıda insanı enfekte etmektedir.[41][52]
Bu hesaplamalardaki bir varsayım, popülasyonların homojen veya iyi karışmış olduğu, yani her bireyin diğer herhangi bir bireyle temas etme olasılığının eşit olduğu, gerçekte popülasyonların daha çok sosyal ağlar olarak tanımlandığı, bireylerin sınırlı sayıda başka bireyle nispeten yakın temas halinde kalarak bir araya gelme eğiliminde olduğudur. Bu ağlarda bulaşma yalnızca coğrafi veya fiziksel olarak birbirine yakın olanlar arasında gerçekleşir.[2][40][41] Bir ağın şekli ve boyutu, bir hastalığın SBE'sini değiştirerek görülme sıklığını daha fazla veya daha az yaygın hale getirebilir.[26][40] Matematiksel modeller, karşılaşma ve dolayısıyla bulaşma olasılığını tahmin etmek için temas matrislerini kullanabilir.[53]
Heterojen popülasyonlarda R0, bir ağ içindeki bireylerin birbirleriyle nasıl etkileşime girdiğine bağlı olan "tipik" bulaşıcı bir kişi tarafından üretilen vaka sayısının bir ölçüsü olarak kabul edilir.[2] Ağlar içindeki etkileşimler, ağlar arasındaki etkileşimlerden daha yaygındır; bu durumda, en yüksek düzeyde bağlantılı ağlar hastalığı daha kolay bulaştırır ve daha az bağlantılı bir ağda gerekenden daha yüksek bir R0 ve daha yüksek bir SBE ile sonuçlanır.[2] Bağışıklık kazanmamayı tercih eden ya da yeterince bağışıklık kazanmamış ağlarda, hastalıklar daha iyi bağışıklık kazanmış ağlarda mevcut olmamasına rağmen devam edebilir.[41]

Aşım[değiştir | kaynağı değiştir]
Bir hastalık salgını sırasında enfekte olan bireylerin kümülatif oranı SBE'yi aşabilir. Bunun nedeni, SBE'nin hastalığın yayılmasının durduğu noktayı değil, enfekte olan her bir kişinin ortalama olarak birden daha az kişiyi enfekte ettiği noktayı temsil etmesidir. SBE'ye ulaşıldığında, ek enfeksiyonların sayısı hemen sıfıra düşmez. Enfekte bireylerin kümülatif oranının teorik SBE'nin üzerindeki fazlalığı aşım olarak bilinir.[54][55][56]
Takviyeler[değiştir | kaynağı değiştir]
Aşılama[değiştir | kaynağı değiştir]
Bir toplumda bağışıklık düzeyini artırmanın birincil yolu aşılamadır.[2][57] Aşılama ilk olarak inek çiçeğine maruz kalan sütçü kızların çiçek hastalığına karşı bağışıklık kazandıkları gözlemine dayanmaktadır, bu nedenle çiçek hastalığını önlemenin bir yolu olarak insanlara inek çiçeği virüsü inokülasyon uygulaması başlamıştır.[39] İyi geliştirilmiş aşılar, doğal enfeksiyonlardan çok daha güvenli bir şekilde koruma sağlar, çünkü aşılar genellikle korudukları hastalıklara neden olmaz ve ciddi yan etkiler doğal enfeksiyonlardan kaynaklanan komplikasyonlardan önemli ölçüde daha az yaygındır.[58][59]
Bağışıklık sistemi doğal enfeksiyonlar ve aşılar arasında ayrım yapmaz, her ikisine de aktif bir yanıt oluşturur, bu nedenle aşılama yoluyla indüklenen bağışıklık, hastalığa yakalanma ve iyileşme ile oluşacak olana benzer.[60] Aşılama yoluyla sürü bağışıklığı elde etmek için aşı üreticileri düşük başarısızlık oranlarına sahip aşılar üretmeyi ve politika yapıcılar da bunların kullanımını teşvik etmeyi amaçlamaktadır.[57] Bir aşının başarılı bir şekilde piyasaya sürülmesinden ve yaygın olarak kullanılmasından sonra, koruduğu hastalıkların görülme sıklığında keskin düşüşler gözlemlenebilir, bu da bu tür hastalıkların neden olduğu hastaneye yatış ve ölüm sayısını azaltır.[61][62][63]
Bir aşının %100 etkili olduğu varsayıldığında, sürü bağışıklığı eşiğini hesaplamak için kullanılan denklem, Vc olarak yazılan bir hastalığı ortadan kaldırmak için gereken aşılama düzeyini hesaplamak için kullanılabilir.[2] Ancak aşılar genellikle kusurludur, bu nedenle bir aşının etkinliği, E, hesaba katılmalıdır:
Bu denklemden, E'nin (1 - 1/R0)'dan küçük olması durumunda, tüm nüfus aşılansa bile bir hastalığı ortadan kaldırmanın imkansız olduğu gözlemlenebilir.[2] Benzer şekilde, aselüler boğmaca aşılarında olduğu gibi aşı kaynaklı bağışıklığın azalması, sürü bağışıklığını sürdürmek için daha yüksek seviyelerde takviye aşılama gerektirir.[2][16] Bir hastalık bir popülasyonda endemik olmaktan çıkmışsa, doğal enfeksiyonlar artık popülasyonun duyarlı olan kısmının azalmasına katkıda bulunmaz. Bu azalmaya sadece aşılama katkıda bulunur.[22] Aşı kapsamı ve etkinliği ile hastalık insidansı arasındaki ilişki, bir aşının etkinliği ile aşılanan nüfusun oranı olan pv'nin çarpımının sürü bağışıklığı eşik denkleminden çıkarılmasıyla aşağıdaki gibi gösterilebilir:
Bu denklemden görülebileceği üzere, diğer her şey eşit olduğunda ("ceteris paribus"), bir hastalığın SBE'sini aşan herhangi bir artış da dahil olmak üzere, aşı kapsamındaki veya aşı etkinliğindeki herhangi bir artış, bir hastalığın vaka sayısını daha da azaltmaktadır.[22] Vakalardaki düşüş oranı, bir hastalığın R0 değerine bağlıdır ve daha düşük R0 değerlerine sahip hastalıklarda daha keskin düşüşler yaşanır.[22]
Aşıların genellikle tıbbi nedenlerle belirli bir popülasyon için en az bir kontrendikasyonu vardır, ancak hem etkinlik hem de kapsam yeterince yüksekse sürü bağışıklığı bu bireyleri koruyabilir.[8][12][15] Aşı etkinliği genellikle, ancak her zaman değil, pasif bağışıklıktan olumsuz etkilenir,[64][65] bu nedenle bazı aşılar için ek dozlar önerilirken, diğerleri bir birey pasif bağışıklığını kaybedene kadar uygulanmaz.[11][15]
Pasif bağışıklık[değiştir | kaynağı değiştir]
Bireysel bağışıklık, bir patojene karşı antikorlar bir bireyden diğerine aktarıldığında pasif olarak da kazanılabilir. Bu doğal yollarla gerçekleşebilir; anneye ait antikorlar, özellikle de immünoglobulin G antikorları, plasenta ve kolostrum yoluyla fetüse ve yeni doğana aktarılır.[66][67] Pasif bağışıklık, duyarlı bir kişiye bağışık bir kişinin serumundan veya plazmasından alınan antikorlar enjekte edildiğinde yapay olarak da kazanılabilir.[60][68]
Pasif bağışıklıktan kaynaklanan koruma hemen gerçekleşir, ancak haftalar veya aylar içinde azalır, bu nedenle sürü bağışıklığına herhangi bir katkı geçicidir.[5][60][69] İnfluenza ve tetanos gibi fetüsler ve yeni doğanlar arasında özellikle ağır seyreden hastalıklarda, antikorların çocuğa aktarılması için hamile kadınlar aşılanabilir.[8][70][71] Aynı şekilde, enfeksiyon geçirme olasılığı daha yüksek olan ya da enfeksiyondan kaynaklanan komplikasyonlar geliştirme olasılığı daha yüksek olan yüksek riskli gruplar, bu enfeksiyonları önlemek ya da semptomların şiddetini azaltmak için antikor preparatları alabilirler.[68]
Maliyet-fayda analizi[değiştir | kaynağı değiştir]
Sürü bağışıklığı, aşılama programlarının fayda-maliyet analizleri yapılırken sıklıkla hesaba katılmaktadır. Yüksek düzeyde bağışıklığın pozitif bir dışsallığı olarak kabul edilir ve popülasyonda sürü bağışıklığı oluşmamış olsaydı ortaya çıkmayacak olan hastalıkların azaltılmasında ek bir fayda sağlar.[72][73] Bu nedenle, sürü bağışıklığının maliyet-fayda analizlerine dahil edilmesi, hem daha uygun maliyet-etkinlik veya maliyet-fayda oranlarıyla hem de aşılama ile önlenen hastalık vakalarının sayısında bir artışla sonuçlanır.[73] Sürü bağışıklığının faydasını tahmin etmek için yapılan çalışma tasarımları arasında, aşılanmış bir üyesi olan hanelerde hastalık insidansının kaydedilmesi, tek bir coğrafi bölgedeki bir popülasyonun aşılanmak veya aşılanmamak üzere rastgele seçilmesi ve bir aşılama programına başlamadan önce ve sonra hastalık insidansının gözlemlenmesi yer almaktadır.[74] Bunlardan, hastalık insidansının yalnızca doğrudan korumadan tahmin edilebilecek düzeyin ötesine düşebileceği gözlemlenebilir, bu da sürü bağışıklığının azaltmaya katkıda bulunduğunu gösterir.[74] Serotip değişimi hesaba katıldığında, aşılamanın öngörülen faydalarını azaltmaktadır.[73]
Tarihçe[değiştir | kaynağı değiştir]

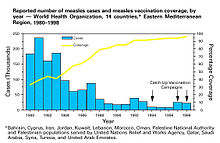
Sürü bağışıklığı, 1930'larda önemli sayıda çocuğun kızamığa karşı bağışıklık kazanmasının ardından yeni enfeksiyonların sayısının geçici olarak azaldığı gözlemlendiğinde doğal olarak ortaya çıkan bir olgu olarak kabul edilmiştir.[75] Sürü bağışıklığını teşvik etmek için toplu aşılama o zamandan beri yaygın hale gelmiş ve birçok bulaşıcı hastalığın yayılmasını önlemede başarılı olduğu kanıtlanmıştır.[22] Aşılamaya karşı çıkılması, önlenebilir hastalıkların yetersiz aşılama oranlarına sahip popülasyonlarda devam etmesine veya geri dönmesine izin vererek sürü bağışıklığına karşı bir meydan okuma oluşturmuştur.[45][46][47]
Kesin sürü bağışıklık eşiği (SBE) hastalığın temel üreme sayısına bağlı olarak değişir. Yüksek eşiğe sahip bir hastalık örneği, %95'i aşan bir SBE ile kızamıktır.[76]
"Sürü bağışıklığı" terimi ilk kez 1894 yılında Amerikalı veteriner bilimci ve daha sonra ABD Tarım Bakanlığı Hayvan Endüstrisi Bürosu Şefi Daniel Elmer Salmon tarafından iyi beslenen domuz sürülerinin sağlıklı canlılığını ve hastalıklara karşı direncini tanımlamak için kullanılmıştır. 1916 yılında aynı Hayvan Endüstrisi Bürosundaki veteriner bilimciler bu terimi, "bulaşıcı düşük" olarak da bilinen bruselloz hastalığına yakalanmış sığırlarda iyileşmenin ardından ortaya çıkan bağışıklığı ifade etmek için kullandılar. 1923 yılına gelindiğinde İngiliz bakteriyologlar tarafından, insan salgın hastalıklarını modelleme çabalarının bir parçası olarak farelerle yapılan deneysel salgınları tanımlamak için kullanılmaya başlandı. 1920'lerin sonuna gelindiğinde bu kavram, özellikle İngiliz bilim insanları arasında difteri, kızıl ve grip gibi hastalıklara karşı popülasyonlarda bağışıklık oluşumunu tanımlamak için yaygın olarak kullanılmaya başlandı.[77]
Sürü bağışıklığı, 1930'larda A. W. Hedrich'in Baltimore'da kızamık epidemiyolojisi üzerine bir araştırma yayınlaması ve birçok çocuğun kızamığa karşı bağışıklık kazandıktan sonra, duyarlı çocuklar da dahil olmak üzere yeni enfeksiyonların sayısının geçici olarak azaldığını fark etmesiyle doğal olarak ortaya çıkan bir olgu olarak kabul edildi.[75][78] Bu bilgiye rağmen, kızamığı kontrol altına alma ve ortadan kaldırma çabaları, 1960'larda kızamık aşısı kullanılarak kitlesel aşılama başlayana kadar başarısız oldu.[75] Kitlesel aşılama, hastalığın ortadan kaldırılması tartışmaları ve aşılamanın maliyet-fayda analizleri daha sonra sürü bağışıklığı teriminin daha yaygın olarak kullanılmasını sağlamıştır.[2] 1970'lerde, bir hastalığın sürü bağışıklığı eşiğini hesaplamak için kullanılan teorem geliştirildi.[2] 1960'lar ve 1970'lerdeki çiçek hastalığı eradikasyon kampanyası sırasında, sürü bağışıklığının ayrılmaz bir parçası olduğu halka aşılama uygulaması, salgınların yayılmasını önlemek için enfekte bir bireyin etrafındaki bir "halka"daki her kişiyi aşılamanın bir yolu olarak başladı.[79]
Kitlesel ve halka aşılamanın benimsenmesinden bu yana, sürü bağışıklığına ilişkin karmaşıklıklar ve zorluklar ortaya çıkmıştır.[2][57] Bulaşıcı hastalıkların yayılmasının modellenmesinde başlangıçta, tüm popülasyonların duyarlı ve iyi karışmış olduğu gibi bir dizi varsayım yapılmıştır, ancak gerçekte durum böyle değildir, bu nedenle daha kesin denklemler geliştirilmiştir.[2] Son yıllarda, dolaşımdaki bir mikroorganizmanın baskın türünün, ya sürü bağışıklığının evrimsel bir baskı olarak hareket etmesi ya da bir türe karşı sürü bağışıklığının zaten var olan başka bir türün yayılmasına izin vermesi nedeniyle değişebileceği kabul edilmiştir.[29][30] Aşılama ile ilgili ortaya çıkan veya devam eden korkular ve tartışmalar, bazı topluluklarda sürü bağışıklığını azaltmış veya ortadan kaldırmış, önlenebilir hastalıkların bu topluluklarda devam etmesine veya bu topluluklara geri dönmesine izin vermiştir.[45][46][47]
Ayrıca bakınız[değiştir | kaynağı değiştir]
Kaynakça[değiştir | kaynağı değiştir]
- ^ "Herd immunity | immunology". Encyclopedia Britannica (İngilizce). 1 Nisan 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Haziran 2021.
- ^ a b c d e f g h i j k l m n o p q r s Fine P, Eames K, Heymann DL (April 2011). ""Herd immunity": a rough guide". Clinical Infectious Diseases. 52 (7): 911-6. doi:10.1093/cid/cir007. PMID 21427399.
- ^ Gordis L (2013). Epidemiology. Elsevier Health Sciences. ss. 26-27. ISBN 978-1455742516. 1 Temmuz 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Mart 2015.
- ^ "Cold-Causing Coronaviruses Don't Seem to Confer Lasting Immunity". The Scientist Magazine® (İngilizce). 7 Ocak 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Ocak 2021.
- ^ a b c d Somerville M, Kumaran K, Anderson R (2012). Public Health and Epidemiology at a Glance. John Wiley & Sons. ss. 58-59. ISBN 978-1118308646. 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Mart 2015.
- ^ a b c d Cliff, Smallman-Raynor M (2013). Oxford Textbook of Infectious Disease Control: A Geographical Analysis from Medieval Quarantine to Global Eradication. Oxford University Press. ss. 125-36. ISBN 978-0199596614. 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Mart 2015.
- ^ a b c d e f g Kim TH, Johnstone J, Loeb M (September 2011). "Vaccine herd effect". Scandinavian Journal of Infectious Diseases. 43 (9): 683-9. doi:10.3109/00365548.2011.582247. PMC 3171704 $2. PMID 21604922.
- ^ a b c Munoz FM (August 2013). "Maternal immunization: an update for pediatricians". Pediatric Annals. 42 (8): 153-8. doi:10.3928/00904481-20130723-09. PMID 23910028.
- ^ a b c "Herd Immunity". Oxford Vaccine Group, University of Oxford. 2 Ağustos 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Aralık 2017.
- ^ a b c d Cesaro S, Giacchino M, Fioredda F, Barone A, Battisti L, Bezzio S, Frenos S, De Santis R, Livadiotti S, Marinello S, Zanazzo AG, Caselli D (2014). "Guidelines on vaccinations in paediatric haematology and oncology patients". BioMed Research International. 2014: 707691. doi:10.1155/2014/707691. PMC 4020520 $2. PMID 24868544.
- ^ a b c National Center for Immunization Respiratory Diseases (January 2011). "General recommendations on immunization --- recommendations of the Advisory Committee on Immunization Practices (ACIP)". MMWR. Recommendations and Reports. 60 (2): 1-64. PMID 21293327.
- ^ a b Wolfe RM (2012). "Update on adult immunizations". Journal of the American Board of Family Medicine. 25 (4): 496-510. doi:10.3122/jabfm.2012.04.100274. PMID 22773718.
- ^ Esposito S, Bosis S, Morlacchi L, Baggi E, Sabatini C, Principi N (October 2012). "Can infants be protected by means of maternal vaccination?". Clinical Microbiology and Infection. 18 (Suppl 5): 85-92. doi:10.1111/j.1469-0691.2012.03936.x. PMID 22862749.
- ^ a b c Rakel D, Rakel RE (2015). Textbook of Family Medicine. Elsevier Health Sciences. ss. 99, 187. ISBN 978-0323313087. 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Mart 2015.
- ^ a b c Tulchinsky TH, Varavikova EA (2014). The New Public Health: An Introduction for the 21st Century. Academic Press. ss. 163-82. ISBN 978-0124157675. 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Mart 2015.
- ^ a b McGirr A, Fisman DN (February 2015). "Duration of pertussis immunity after DTaP immunization: a meta-analysis" (PDF). Pediatrics. 135 (2): 331-43. doi:10.1542/peds.2014-1729. PMID 25560446. 3 Mart 2019 tarihinde kaynağından (PDF) arşivlendi.
- ^ Zepp F, Heininger U, Mertsola J, Bernatowska E, Guiso N, Roord J, Tozzi AE, Van Damme P (July 2011). "Rationale for pertussis booster vaccination throughout life in Europe". The Lancet. Infectious Diseases. 11 (7): 557-70. doi:10.1016/S1473-3099(11)70007-X. PMID 21600850.
- ^ a b c d e f Pittet LF, Posfay-Barbe KM (October 2012). "Pneumococcal vaccines for children: a global public health priority". Clinical Microbiology and Infection. 18 (Suppl 5): 25-36. doi:10.1111/j.1469-0691.2012.03938.x. PMID 22862432.
- ^ Nakagomi O, Iturriza-Gomara M, Nakagomi T, Cunliffe NA (November 2013). "Incorporation of a rotavirus vaccine into the national immunisation schedule in the United Kingdom: a review". Expert Opinion on Biological Therapy. 13 (11): 1613-21. doi:10.1517/14712598.2013.840285. PMID 24088009.
- ^ Lopman BA, Payne DC, Tate JE, Patel MM, Cortese MM, Parashar UD (August 2012). "Post-licensure experience with rotavirus vaccination in high and middle income countries; 2006 to 2011". Current Opinion in Virology. 2 (4): 434-42. doi:10.1016/j.coviro.2012.05.002. PMID 22749491. 16 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Temmuz 2019.
- ^ a b Kim TH (July 2014). "Seasonal influenza and vaccine herd effect". Clinical and Experimental Vaccine Research. 3 (2): 128-32. doi:10.7774/cevr.2014.3.2.128. PMC 4083064 $2. PMID 25003085.
- ^ a b c d e f g h i j k Garnett GP (February 2005). "Role of herd immunity in determining the effect of vaccines against sexually transmitted disease". The Journal of Infectious Diseases. 191 (Suppl 1): S97-106. doi:10.1086/425271. PMID 15627236.
- ^ a b Lowy DR, Schiller JT (January 2012). "Reducing HPV-associated cancer globally". Cancer Prevention Research. 5 (1): 18-23. doi:10.1158/1940-6207.CAPR-11-0542. PMC 3285475 $2. PMID 22219162.
- ^ a b c d Lenzi A, Mirone V, Gentile V, Bartoletti R, Ficarra V, Foresta C, Mariani L, Mazzoli S, Parisi SG, Perino A, Picardo M, Zotti CM (February 2013). "Rome Consensus Conference - statement; human papilloma virus diseases in males". BMC Public Health. 13: 117. doi:10.1186/1471-2458-13-117. PMC 3642007 $2. PMID 23391351.
- ^ Garland SM, Skinner SR, Brotherton JM (October 2011). "Adolescent and young adult HPV vaccination in Australia: achievements and challenges". Preventive Medicine. 53 (Suppl 1): S29-35. doi:10.1016/j.ypmed.2011.08.015. PMID 21962468.
- ^ a b c d e f g h Rodpothong, P; Auewarakul, P (2012). "Viral evolution and transmission effectiveness". World Journal of Virology. 1 (5): 131-34. doi:10.5501/wjv.v1.i5.131. PMC 3782273 $2. PMID 24175217.
- ^ a b Corti, D; Lanzavecchia, A (2013). "Broadly neutralizing antiviral antibodies". Annual Review of Immunology. 31: 705-42. doi:10.1146/annurev-immunol-032712-095916. PMID 23330954.
- ^ a b c Weinberger, D. M.; Malley, R; Lipsitch, M (2011). "Serotype replacement in disease after pneumococcal vaccination". The Lancet. 378 (9807): 1962-73. doi:10.1016/S0140-6736(10)62225-8. PMC 3256741 $2. PMID 21492929.
- ^ a b c McEllistrem, M. C.; Nahm, M. H. (2012). "Novel pneumococcal serotypes 6C and 6D: Anomaly or harbinger". Clinical Infectious Diseases. 55 (10): 1379-86. doi:10.1093/cid/cis691. PMC 3478140 $2. PMID 22903767.
- ^ a b c Bull RA, White PA (May 2011). "Mechanisms of GII.4 norovirus evolution". Trends in Microbiology. 19 (5): 233-40. doi:10.1016/j.tim.2011.01.002. PMID 21310617.
- ^ a b Ramani S, Atmar RL, Estes MK (January 2014). "Epidemiology of human noroviruses and updates on vaccine development". Current Opinion in Gastroenterology. 30 (1): 25-33. doi:10.1097/MOG.0000000000000022. PMC 3955997 $2. PMID 24232370.
- ^ a b c Pleschka S (2013). "Overview of Influenza Viruses". Swine Influenza. Current Topics in Microbiology and Immunology. 370. ss. 1-20. doi:10.1007/82_2012_272. ISBN 978-3642368707. PMID 23124938.
- ^ Han T, Marasco WA (January 2011). "Structural basis of influenza virus neutralization". Annals of the New York Academy of Sciences. 1217 (1): 178-90. Bibcode:2011NYASA1217..178H. doi:10.1111/j.1749-6632.2010.05829.x. PMC 3062959 $2. PMID 21251008.
- ^ Reperant LA, Rimmelzwaan GF, Osterhaus AD (2014). "Advances in influenza vaccination". F1000Prime Reports. 6: 47. doi:10.12703/p6-47. PMC 4047948 $2. PMID 24991424.
- ^ Dagan R (April 2009). "Impact of pneumococcal conjugate vaccine on infections caused by antibiotic-resistant Streptococcus pneumoniae". Clinical Microbiology and Infection. 15 (Suppl 3): 16-20. doi:10.1111/j.1469-0691.2009.02726.x. PMID 19366365.
- ^ Lynch JP, Zhanel GG (May 2010). "Streptococcus pneumoniae: epidemiology and risk factors, evolution of antimicrobial resistance, and impact of vaccines". Current Opinion in Pulmonary Medicine. 16 (3): 217-25. doi:10.1097/MCP.0b013e3283385653. PMID 20375783.
- ^ Alhumaid, Saad; Al Mutair, Abbas; Al Alawi, Zainab; Rabaan, Ali A.; Tirupathi, Raghavendra; Alomari, Mohammed A.; Alshakhes, Aqeel S.; Alshawi, Abeer M.; Ahmed, Gasmelseed Y.; Almusabeh, Hassan M.; Alghareeb, Tariq T.; Alghuwainem, Abdulaziz A.; Alsulaiman, Zainab A.; Alabdulmuhsin, Mohammed A.; AlBuwaidi, Emad A.; Dukhi, Amjad K. Bu; Mufti, Hani N.; Al-Qahtani, Manaf; Dhama, Kuldeep; Al-Tawfiq, Jaffar A.; Al-Omari, Awad (December 2021). "Anaphylactic and nonanaphylactic reactions to SARS-CoV-2 vaccines: a systematic review and meta-analysis". Allergy, Asthma & Clinical Immunology. 17 (1): 109. doi:10.1186/s13223-021-00613-7. PMC 8520206 $2. PMID 34656181.
- ^ Njeumi F, Taylor W, Diallo A, Miyagishima K, Pastoret PP, Vallat B, Traore M (December 2012). "The long journey: a brief review of the eradication of rinderpest". Revue Scientifique et Technique. 31 (3): 729-46. doi:10.20506/rst.31.3.2157. PMID 23520729.
- ^ a b Smith KA (May 2013). "Smallpox: can we still learn from the journey to eradication?". The Indian Journal of Medical Research. 137 (5): 895-9. PMC 3734679 $2. PMID 23760373.
- ^ a b c d e Perisic A, Bauch CT (February 2009). "Social contact networks and disease eradicability under voluntary vaccination". PLOS Computational Biology. 5 (2): e1000280. Bibcode:2009PLSCB...5E0280P. doi:10.1371/journal.pcbi.1000280. PMC 2625434 $2. PMID 19197342.
- ^ a b c d e f Fu F, Rosenbloom DI, Wang L, Nowak MA (January 2011). "Imitation dynamics of vaccination behaviour on social networks" (PDF). Proceedings. Biological Sciences. 278 (1702): 42-9. doi:10.1098/rspb.2010.1107. PMC 2992723 $2. PMID 20667876. 4 Kasım 2018 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 4 Kasım 2018.
- ^ Wicker S, Maltezou HC (August 2014). "Vaccine-preventable diseases in Europe: where do we stand?". Expert Review of Vaccines. 13 (8): 979-87. doi:10.1586/14760584.2014.933077. PMID 24958075.
- ^ a b c Fukuda E, Tanimoto J (2014). Impact of Stubborn Individuals on a Spread of Infectious Disease under Voluntary Vaccination Policy. Springer. ss. 1-10. ISBN 978-3319133591. 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Mart 2015.
- ^ a b Barrett S (2014). "Global Public Goods and International Development". J. Warren Evans, Robin Davies (Ed.). Too Global To Fail: The World Bank at the Intersection of National and Global Public Policy in 2025. World Bank Publications. ss. 13-18. ISBN 978-1464803109.
- ^ a b c Quadri-Sheriff M, Hendrix KS, Downs SM, Sturm LA, Zimet GD, Finnell SM (September 2012). "The role of herd immunity in parents' decision to vaccinate children: a systematic review". Pediatrics. 130 (3): 522-30. doi:10.1542/peds.2012-0140. PMID 22926181.
- ^ a b c d e Dubé E, Laberge C, Guay M, Bramadat P, Roy R, Bettinger J (August 2013). "Vaccine hesitancy: an overview". Human Vaccines & Immunotherapeutics. 9 (8): 1763-73. doi:10.4161/hv.24657. PMC 3906279 $2. PMID 23584253.
- ^ a b c d Ropeik D (August 2013). "How society should respond to the risk of vaccine rejection". Human Vaccines & Immunotherapeutics. 9 (8): 1815-8. doi:10.4161/hv.25250. PMC 3906287 $2. PMID 23807359.
- ^ a b c Gowda C, Dempsey AF (August 2013). "The rise (and fall?) of parental vaccine hesitancy". Human Vaccines & Immunotherapeutics. 9 (8): 1755-62. doi:10.4161/hv.25085. PMC 3906278 $2. PMID 23744504.
- ^ Ozawa S, Stack ML (August 2013). "Public trust and vaccine acceptance--international perspectives". Human Vaccines & Immunotherapeutics. 9 (8): 1774-8. doi:10.4161/hv.24961. PMC 3906280 $2. PMID 23733039.
- ^ Parker AM, Vardavas R, Marcum CS, Gidengil CA (July 2013). "Conscious consideration of herd immunity in influenza vaccination decisions". American Journal of Preventive Medicine. 45 (1): 118-121. doi:10.1016/j.amepre.2013.02.016. PMC 3694502 $2. PMID 23790997.
- ^ a b Merrill RM (2013). Introduction to Epidemiology. Jones & Bartlett Publishers. ss. 68-71. ISBN 978-1449645175. 12 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Mart 2015.
- ^ a b Dabbaghian V, Mago VK (2013). Theories and Simulations of Complex Social Systems. Springer. ss. 134-35. ISBN 978-3642391491. 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Mart 2015.
- ^ von Csefalvay, Chris (2023), "Host factors", Computational Modeling of Infectious Disease (İngilizce), Elsevier, ss. 93-119, doi:10.1016/b978-0-32-395389-4.00012-8, ISBN 978-0-323-95389-4, 1 Temmuz 2023 tarihinde kaynağından arşivlendi, erişim tarihi: 2 Mart 2023
- ^ Handel A, Longini IM, Antia R (March 2007). "What is the best control strategy for multiple infectious disease outbreaks?". Proceedings. Biological Sciences. 274 (1611): 833-7. doi:10.1098/rspb.2006.0015. PMC 2093965 $2. PMID 17251095.
In general, the number of infecteds grows until the number of susceptibles has fallen to Sth. At this point, the average number of secondary infections created by an infected person drops below 1 and therefore the number of infecteds starts to decrease. However, right at this inflection point, the maximum number of infecteds is present. These infecteds will create on average less than 1, but still more than zero further infections, leading to additional depletion of susceptibles and therefore causing an overshoot.
- ^ Fung IC, Antia R, Handel A (11 Haziran 2012). "How to minimize the attack rate during multiple influenza outbreaks in a heterogeneous population". PLOS ONE. 7 (6): e36573. Bibcode:2012PLoSO...736573F. doi:10.1371/journal.pone.0036573. PMC 3372524 $2. PMID 22701558.
- ^ Bergstrom CT, Dean N (1 Mayıs 2020). "Opinion: What the Proponents of 'Natural' Herd Immunity Don't Say". The New York Times (İngilizce). 3 Haziran 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Mayıs 2020.
- ^ a b c Rashid H, Khandaker G, Booy R (June 2012). "Vaccination and herd immunity: what more do we know?". Current Opinion in Infectious Diseases. 25 (3): 243-9. doi:10.1097/QCO.0b013e328352f727. PMID 22561998.
- ^ Maglione MA, Das L, Raaen L, Smith A, Chari R, Newberry S, Shanman R, Perry T, Goetz MB, Gidengil C (August 2014). "Safety of vaccines used for routine immunization of U.S. children: a systematic review". Pediatrics. 134 (2): 325-37. doi:10.1542/peds.2014-1079. PMID 25086160. 30 Ocak 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Temmuz 2019.
- ^ Di Pietrantonj, Carlo; Rivetti, Alessandro; Marchione, Pasquale; Debalini, Maria Grazia; Demicheli, Vittorio (22 Kasım 2021). "Vaccines for measles, mumps, rubella, and varicella in children". The Cochrane Database of Systematic Reviews. 2021 (11): CD004407. doi:10.1002/14651858.CD004407.pub5. ISSN 1469-493X. PMC 8607336 $2. PMID 34806766.
- ^ a b c Pommerville JC (2014). Fundamentals of Microbiology: Body Systems Edition. Jones & Bartlett Publishers. ss. 559-63. ISBN 978-1284057102. 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Mart 2015.
- ^ Papaloukas O, Giannouli G, Papaevangelou V (March 2014). "Successes and challenges in varicella vaccine". Therapeutic Advances in Vaccines. 2 (2): 39-55. doi:10.1177/2051013613515621. PMC 3991154 $2. PMID 24757524.
- ^ Shann F (February 2013). "Nonspecific effects of vaccines and the reduction of mortality in children". Clinical Therapeutics. 35 (2): 109-14. doi:10.1016/j.clinthera.2013.01.007. PMID 23375475.
- ^ Visser A, Hoosen A (September 2012). "Haemophilus influenzae type b conjugate vaccines - a South African perspective". Vaccine. 30 (Suppl 3): C52-7. doi:10.1016/j.vaccine.2012.06.022. hdl:2263/20792. PMID 22939022.
- ^ Leuridan E, Sabbe M, Van Damme P (September 2012). "Measles outbreak in Europe: susceptibility of infants too young to be immunized". Vaccine. 30 (41): 5905-13. doi:10.1016/j.vaccine.2012.07.035. PMID 22841972.
- ^ Hodgins DC, Shewen PE (February 2012). "Vaccination of neonates: problem and issues". Vaccine. 30 (9): 1541-59. doi:10.1016/j.vaccine.2011.12.047. PMID 22189699.
- ^ Chucri TM, Monteiro JM, Lima AR, Salvadori ML, Kfoury JR, Miglino MA (December 2010). "A review of immune transfer by the placenta". Journal of Reproductive Immunology. 87 (1–2): 14-20. doi:10.1016/j.jri.2010.08.062. PMID 20956021.
- ^ Palmeira P, Quinello C, Silveira-Lessa AL, Zago CA, Carneiro-Sampaio M (2012). "IgG placental transfer in healthy and pathological pregnancies". Clinical & Developmental Immunology. 2012: 985646. doi:10.1155/2012/985646. PMC 3251916 $2. PMID 22235228.
- ^ a b Parija SC (2014). Textbook of Microbiology & Immunology. Elsevier Health Sciences. ss. 88-89. ISBN 978-8131236246. 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Mart 2015.
- ^ Detels R, Gulliford M, Karim QA, Tan CC (2015). Oxford Textbook of Global Public Health. Oxford University Press. s. 1490. ISBN 978-0199661756. 1 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Mart 2015.
- ^ Demicheli V, Barale A, Rivetti A (July 2015). "Vaccines for women for preventing neonatal tetanus". The Cochrane Database of Systematic Reviews. 2015 (7): CD002959. doi:10.1002/14651858.CD002959.pub4. PMC 7138051 $2. PMID 26144877.
- ^ Swamy GK, Garcia-Putnam R (February 2013). "Vaccine-preventable diseases in pregnancy". American Journal of Perinatology. 30 (2): 89-97. doi:10.1055/s-0032-1331032. PMID 23271378.
- ^ Bärnighausen T, Bloom DE, Cafiero-Fonseca ET, O'Brien JC (August 2014). "Valuing vaccination". Proceedings of the National Academy of Sciences of the United States of America. 111 (34): 12313-9. Bibcode:2014PNAS..11112313B. doi:10.1073/pnas.1400475111. PMC 4151736 $2. PMID 25136129.
- ^ a b c Deogaonkar R, Hutubessy R, van der Putten I, Evers S, Jit M (October 2012). "Systematic review of studies evaluating the broader economic impact of vaccination in low and middle income countries". BMC Public Health. 12: 878. doi:10.1186/1471-2458-12-878. PMC 3532196 $2. PMID 23072714.
- ^ a b Jit M, Newall AT, Beutels P (April 2013). "Key issues for estimating the impact and cost-effectiveness of seasonal influenza vaccination strategies". Human Vaccines & Immunotherapeutics. 9 (4): 834-40. doi:10.4161/hv.23637. PMC 3903903 $2. PMID 23357859.
- ^ a b c Hinman AR, Orenstein WA, Papania MJ (May 2004). "Evolution of measles elimination strategies in the United States". The Journal of Infectious Diseases. 189 (Suppl 1): S17-22. doi:10.1086/377694. PMID 15106084.*Sencer DJ, Dull HB, Langmuir AD (March 1967). "Epidemiologic basis for eradication of measles in 1967". Public Health Reports. 82 (3): 253-6. doi:10.2307/4592985. JSTOR 4592985. PMC 1919891 $2. PMID 4960501.
- ^ van Boven M, Kretzschmar M, Wallinga J, O'Neill PD, Wichmann O, Hahné S (November 2010). "Estimation of measles vaccine efficacy and critical vaccination coverage in a highly vaccinated population". Journal of the Royal Society, Interface. 7 (52): 1537-44. doi:10.1098/rsif.2010.0086. PMC 2988255 $2. PMID 20392713.
- ^ Robertson, David (10 Haziran 2021). "Of Mice and Schoolchildren: A Conceptual History of Herd Immunity". American Journal of Public Health. 111 (8): e1-e8. doi:10.2105/AJPH.2021.306264. PMC 8489650 $2. PMID 34111938.
- ^ Hedrich AW (1933). "Monthly Estimates of the Child Population Susceptible to Measles, 1900–1931, Baltimore, Md". American Journal of Epidemiology. 17 (3): 613-636. doi:10.1093/oxfordjournals.aje.a117929.
- ^ Strassburg MA (May 1982). "The global eradication of smallpox". American Journal of Infection Control. 10 (2): 53-9. doi:10.1016/0196-6553(82)90003-7. PMID 7044193.
Dış bağlantılar[değiştir | kaynağı değiştir]
| Wikimedia Commons'ta Sürü bağışıklığı ile ilgili ortam dosyaları bulunmaktadır. |
- Topley WW, Wilson GS (May 1923). "The Spread of Bacterial Infection. The Problem of Herd-Immunity". The Journal of Hygiene. 21 (3): 243-9. doi:10.1017/s0022172400031478. PMC 2167341 $2. PMID 20474777.
- Shane Killian tarafından yazılan ve Robert Webb tarafından modifiye edilen görsel bir sürü bağışıklığı simülasyonu (İngilizce)
- Sürü bağışıklığı simülasyonu (İngilizce)






