Etki mekanizması
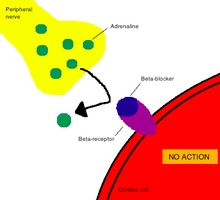
Farmakolojide etki mekanizması (İngilizce: mechanism of action, MOA) terimi, bir ilaç maddesinin farmakolojik etkisini ürettiği spesifik biyokimyasal etkileşimi ifade eder.[2] Bir etki mekanizması genellikle bir enzim veya reseptör gibi ilacın bağlandığı spesifik moleküler hedeflerden bahsetmeyi içerir.[3] Reseptör bölgeleri, ilacın kimyasal yapısına ve orada meydana gelen spesifik etkiye dayalı olarak ilaçlar için spesifik afinitelere sahiptir.
Reseptörlere bağlanmayan ilaçlar, vücuttaki kimyasal veya fiziksel özelliklerle basitçe etkileşime girerek karşılık gelen terapötik etkilerini üretirler. Bu şekilde çalışan ilaçların yaygın örnekleri antiasitler ve laksatiflerdir.[2]
Buna karşılık, bir etki modu (MoA), canlı bir organizmanın bir maddeye maruz kalmasından kaynaklanan hücresel düzeyde işlevsel veya anatomik değişiklikleri tanımlar.
Önem[değiştir | kaynağı değiştir]
Yeni ilaçların etki mekanizmasının aydınlatılması çeşitli nedenlerle önemlidir:
- Antienfektif ilaç geliştirme söz konusu olduğunda, bu bilgiler klinik güvenliğe ilişkin sorunların önceden tahmin edilmesini sağlar. Örneğin sitoplazmik membranı veya elektron taşıma zincirini bozan ilaçların, insan hücrelerinde bulunmayan hücre duvarı bileşenlerini (peptidoglikan veya β-glukanlar) veya 70S ribozomunu hedef alan ilaçlara göre toksisite sorunlarına yol açma olasılığı daha yüksektir.[4][5]
- Bir ilacın belirli bir bölgesi ile bir reseptör arasındaki etkileşim bilinerek, diğer ilaçlar bu etkileşimi kopyalayacak şekilde formüle edilebilir ve böylece aynı terapötik etkiler üretilebilir. Bu yöntem yeni ilaçlar üretmek için kullanılmaktadır.
- Hangi hastaların tedaviye yanıt verme olasılığının daha yüksek olduğunu belirlemeye yardımcı olabilir. Örneğin, meme kanseri ilacı trastuzumabın HER2 proteinini hedef aldığı bilindiğinden, hastanın trastuzumab tedavisinden fayda görüp görmeyeceğini belirlemek için tümörler bu molekülün varlığı açısından taranabilir.[6][7]
- İlacın hedef yol üzerindeki etkileri hastada izlenebildiği için daha iyi dozlama yapılmasını sağlayabilir. Örneğin statin dozajı genellikle hastanın kan kolesterol seviyeleri ölçülerek belirlenir.[6]
- İlaçların, ilaç direncinin ortaya çıkma olasılığını azaltacak şekilde kombine edilmesini sağlar. Bir antiinfektif veya antikanser ilacın hangi hücresel yapı üzerinde etkili olduğunu bilerek, aynı anda birden fazla hedefi inhibe eden bir kokteyl uygulamak mümkündür, böylece mikrobiyal veya tümör DNA'sındaki tek bir mutasyonun ilaç direncine ve tedavi başarısızlığına yol açma riski azalır.[4][8][9][10]
- Bu da ilacın başka endikasyonlarının belirlenmesine olanak sağlayabilir. Örneğin sildenafilin fosfodiesteraz-5 (PDE-5) proteinlerini inhibe ettiğinin keşfedilmesi, PDE-5'in pulmoner hipertansif akciğerlerde eksprese edilmesi nedeniyle bu ilacın pulmoner arteriyel hipertansiyon tedavisi için yeniden konumlandırılmasını sağlamıştır.[11][12]
Belirleme[değiştir | kaynağı değiştir]
Mikroskopi tabanlı yöntemler[değiştir | kaynağı değiştir]

Biyoaktif bileşikler, hedef hücrelerde mikroskobi ile gözlemlenebilen ve bileşiğin etki mekanizması hakkında fikir verebilen fenotipik değişikliklere neden olur.[13]
Antibakteriyel ajanlarla, hedef hücrelerin sferoplastlara dönüşmesi peptidoglikan sentezinin inhibe edildiğinin bir göstergesi olabilir ve hedef hücrelerin filamentasyonu PBP3, FtsZ veya DNA sentezinin inhibe edildiğinin bir göstergesi olabilir. Antibakteriyel ajanın neden olduğu diğer değişiklikler arasında ovoid hücre oluşumu, psödomultisellüler formlar, lokalize şişme, şişkinlik oluşumu, kanama ve peptidoglikan kalınlaşması yer alır.[4] Antikanser ajanlar söz konusu olduğunda, bleb oluşumu bileşiğin plazma membranını bozduğunun bir göstergesi olabilir.[14]
Bu yaklaşımın mevcut bir sınırlaması, verileri manuel olarak oluşturmak ve yorumlamak için gereken zamandır, ancak otomatik mikroskopi ve görüntü analiz yazılımındaki gelişmeler bunu çözmeye yardımcı olabilir.[4][13]
Doğrudan biyokimyasal yöntemler[değiştir | kaynağı değiştir]
Doğrudan biyokimyasal yöntemler, bir proteinin veya ilaç adayı gibi küçük bir molekülün etiketlendiği ve vücut boyunca izlendiği yöntemleri içerir.[15] Bu, ilacın farmakoforunu tanımlamak için bir ilaç taslağının temel bir temsili gibi ilgilenilen küçük hedeflere bağlanacak hedef proteini bulmak için en doğrudan yaklaşım olduğunu kanıtlamaktadır. İşaretli molekül ile bir protein arasındaki fiziksel etkileşimler nedeniyle, ilacın toksisitesini, etkinliğini ve etki mekanizmasını belirlemek için biyokimyasal yöntemler kullanılabilir.
Hesaplama çıkarım yöntemleri[değiştir | kaynağı değiştir]
Tipik olarak, hesaplama çıkarım yöntemleri öncelikle bilgisayar tabanlı örüntü tanımaya dayalı küçük moleküllü ilaçlar için protein hedeflerini tahmin etmek için kullanılır.[15] Ancak, bu yöntem mevcut veya yeni geliştirilen ilaçlar için yeni hedefler bulmak için de kullanılabilir. İlaç molekülünün farmakoforunu tanımlayarak, yeni bir hedefin belirlendiği örüntü tanıma profilleme yöntemi gerçekleştirilebilir.[15] Bu, ilacın belirli işlevsel bileşenlerinin bir protein üzerindeki belirli bir alanla etkileşime girdiğinde nelerden sorumlu olduğu bilindiğinden, olası bir etki mekanizması hakkında bir fikir verir ve böylece terapötik bir etkiye yol açar.
Omik tabanlı yöntemler[değiştir | kaynağı değiştir]
Omik tabanlı yöntemler, ilgilenilen bileşiğin potansiyel hedeflerini belirlemek için kemoproteomik, tersine genetik ve genomik, transkriptomik ve proteomik gibi omik teknolojilerini kullanır.[16] Örneğin tersine genetik ve genomik yaklaşımlar, bileşiğin farmakolojik etkisini ortadan kaldıran veya nakavt edilen genleri tanımlamak için bileşikle birlikte genetik pertürbasyon (örneğin CRISPR-Cas9 veya siRNA) kullanır. Öte yandan, bileşiğin transkriptomik ve proteomik profilleri, bilinen hedeflere sahip bileşiklerin profilleri ile karşılaştırmak için kullanılabilir. Hesaplama çıkarımı sayesinde, daha sonra test edilebilecek olan bileşiğin etki mekanizması hakkında hipotezler oluşturmak mümkündür.[16]
MOA'sı bilinen ilaçlar[değiştir | kaynağı değiştir]
Etki mekanizması bilinen birçok ilaç vardır. Aspirin buna bir örnektir.
Aspirin[değiştir | kaynağı değiştir]
Aspirinin etki mekanizması siklooksijenaz enziminin geri dönüşümsüz inhibisyonunu içerir;[17] bu nedenle prostaglandin ve tromboksan üretimini baskılayarak ağrı ve inflamasyonu azaltır. Bu etki mekanizması aspirine özgüdür ve tüm nonsteroid antiinflamatuar ilaçlar (NSAİİ'ler) için sabit değildir. Aksine, aspirin COX-1'i geri dönüşümsüz olarak inhibe eden tek NSAİİ'dir.[18]
MOA'sı bilinmeyen ilaçlar[değiştir | kaynağı değiştir]
Bazı ilaçların etki mekanizmaları hala bilinmemektedir. Bununla birlikte, belirli bir ilacın etki mekanizması bilinmese bile, ilaç hala işlev görmektedir; sadece ilacın reseptörlerle nasıl etkileşime girdiği ve terapötik etkisini nasıl ürettiği bilinmemektedir veya belirsizdir.
Etki modu[değiştir | kaynağı değiştir]
Bazı literatür makalelerinde, "etki mekanizması" ve "etki modu" terimleri birbirinin yerine kullanılmakta ve tipik olarak ilacın etkileşime girme ve tıbbi bir etki üretme şekline atıfta bulunmaktadır. Bununla birlikte, gerçekte, bir etki modu, canlı bir organizmanın bir maddeye maruz kalmasından kaynaklanan hücresel düzeyde fonksiyonel veya anatomik değişiklikleri tanımlar.[19] Bu, ilacın kendisi ile bir enzim veya reseptör arasındaki etkileşime ve inhibisyon, aktivasyon, agonizm veya antagonizm yoluyla belirli etkileşim biçimine odaklanan daha spesifik bir terim olduğu için etki mekanizmasından farklıdır. Ayrıca, "etki mekanizması" terimi öncelikle farmakolojide kullanılan ana terimdir, oysa "etki modu" daha çok mikrobiyoloji alanında veya biyolojinin belirli yönlerinde ortaya çıkacaktır.
Ayrıca bakınız[değiştir | kaynağı değiştir]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Ogrodowczyk, M.; Dettlaff, K.; Jelinska, A. (2016). "Beta-blockers: Current state of knowledge and perspectives". Mini Reviews in Medicinal Chemistry. 16 (1). ss. 40-54. doi:10.2174/1389557515666151016125948. PMID 26471965.
- ^ a b Spratto, G.R.; Woods, A.L. (2010). Delmar Nurse's Drug Handbook. Cengage Learning. ISBN 978-1-4390-5616-5.
- ^ Grant, R.L.; Combs, A.B.; Acosta, D. (2010) "Experimental Models for the Investigation of Toxicological Mechanisms". In McQueen, C.A. Comprehensive Toxicology (2nd ed.). Oxford: Elsevier. p. 204. 978-0-08-046884-6.
- ^ a b c d e Cushnie, T.P.; O’Driscoll, N.H.; Lamb, A.J. (2016). "Morphological and ultrastructural changes in bacterial cells as an indicator of antibacterial mechanism of action". Cellular and Molecular Life Sciences. 73 (23). ss. 4471-4492. doi:10.1007/s00018-016-2302-2. hdl:10059/2129. PMID 27392605. 7 Ekim 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Ekim 2017.
- ^ Chang, C.C.; Slavin, M.A.; Chen, S.C. (2017). "New developments and directions in the clinical application of the echinocandins". Archives of Toxicology. 91 (4). ss. 1613-1621. doi:10.1007/s00204-016-1916-3. PMID 28180946.
- ^ a b No authors listed (2010). "Mechanism matters". Nature Medicine. 16 (4). s. 347. doi:10.1038/nm0410-347. PMID 20376007.
- ^ Joensuu, H. (2017). "Escalating and de-escalating treatment in HER2-positive early breast cancer". Cancer Treatment Reviews. Cilt 52. ss. 1-11. doi:10.1016/j.ctrv.2016.11.002. PMID 27866067. 5 Ağustos 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Ekim 2017.
- ^ Cihlar, T.; Fordyce, M. (2016). "Current status and prospects of HIV treatment". Current Opinion in Virology. Cilt 18. ss. 50-56. doi:10.1016/j.coviro.2016.03.004. PMID 27023283.
- ^ Antony, H.A.; Parija, S.C. (2016). "Antimalarial drug resistance: An overview". Tropical Parasitology. 6 (1). ss. 30-41. doi:10.4103/2229-5070.175081. PMC 4778180 $2. PMID 26998432.
- ^ Bozic, I.; Reiter, J.G.; Allen, B.; Antal, T.; Chatterjee, K.; Shah, P.; Moon, Y.S.; Yaqubie, A.; Kelly, N.; Le, D.T.; Lipson, E.J.; Chapman, P.B.; Diaz, L.A.; Vogelstein, B.; Nowak, M.A. (2013). "Evolutionary dynamics of cancer in response to targeted combination therapy". eLife. Cilt 2. ss. Article ID e00747. doi:10.7554/eLife.00747. PMC 3691570 $2. PMID 23805382.
- ^ Tari, L.; Vo, N.; Liang, S.; Patel, J.; Baral, C.; Cai, J. (2012). "Identifying novel drug indications through automated reasoning". PLOS ONE. 7 (7). ss. Article e40946. Bibcode:2012PLoSO...740946T. doi:10.1371/journal.pone.0040946. PMC 3402456 $2. PMID 22911721.
- ^ Hayardeny, L. (2014). Why is it important to know the mode of action of drugs? (Conference presentation) (İngilizce). New Frontiers in Neuroscience and Methods of Transdisciplinary Education Workshop, Tel Aviv University, Israel: Tel Aviv University. 18 Mart 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Mart 2017.
- ^ a b Fetz, V.; Prochnow, H.; Brönstrup, M.; Sasse, F. (2016). "Target identification by image analysis" (PDF). Natural Product Reports. 33 (5). ss. 655-667. doi:10.1039/c5np00113g. hdl:10033/621283. PMID 26777141. 2 Haziran 2020 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 26 Eylül 2019.
- ^ Dubovskii, P.V.; Vassilevski, A.A.; Kozlov, S.A.; Feofanov, A.V.; Grishin, E.V.; Efremov, R.G. (2015). "Latarcins: versatile spider venom peptides". Cellular and Molecular Life Sciences. 72 (23). ss. 4501-4522. doi:10.1007/s00018-015-2016-x. PMID 26286896.
- ^ a b c Schenone, M.; Dančík, V.; Wagner, B.K.; Clemons, P.A. (2013). "Target identification and mechanism of action in chemical biology and drug discovery". Nature Chemical Biology. 9 (4). ss. 232-240. doi:10.1038/nchembio.1199. ISSN 1552-4450. PMC 5543995 $2. PMID 23508189.
- ^ a b Wecke, T.; Mascher, T. (2011). "Antibiotic research in the age of omics: from expression profiles to interspecies communication". Journal of Antimicrobial Chemotherapy. 66 (12). ss. 2689-2704. doi:10.1093/jac/dkr373. PMID 21930574.
- ^ Tóth, L.; Muszbek, L.; Komaromi, I. (2013). "Mechanism of the irreversible inhibition of human cyclooxygenase-1 by aspirin as predicted by QM/MM calculations". Journal of Molecular Graphics and Modelling. Cilt 40. ss. 99-109. doi:10.1016/j.jmgm.2012.12.013. PMID 23384979.
- ^ Sharma, S.; Sharma, S. C. (1997). "An update on eicosanoids and inhibitors of cyclooxygenase enzyme systems". Indian Journal of Experimental Biology. 35 (10). ss. 1025-1031. ISSN 0019-5189. PMID 9475035.
- ^ "Mechanisms and mode of dioxin action" (PDF). U.S. Environmental Protection Agency. 28 Aralık 2016 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 11 Haziran 2012.
