Beta-laktamaz
Bu madde çoğu okuyucunun anlayamayacağı kadar teknik olabilir. (Ocak 2024) |
| Serin beta-laktamaz | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Streptomyces albus beta-laktamazın yapısı | |||||||||||
| Tanımlayıcılar | |||||||||||
| β-laktamaz alanı | |||||||||||
| Pfam | PF00144 | ||||||||||
| Pfam klanı | CL0013 | ||||||||||
| InterPro | IPR001466 | ||||||||||
| PROSITE | PS00146 | ||||||||||
| SCOP2 | 56601 / SCOPe / SUPFAM | ||||||||||
| |||||||||||
| Metallo-beta-laktamaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Metallo-beta-laktamaz L1 homotetramer, Stenotrophomonas | |||||||||
| Tanımlayıcılar | |||||||||
| ? | |||||||||
| Pfam | PF00753 | ||||||||
| Pfam klanı | CL0381 | ||||||||
| InterPro | IPR001279 | ||||||||
| |||||||||
| Beta-laktamaz | |||||||
|---|---|---|---|---|---|---|---|
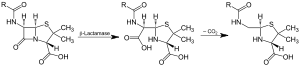
| |||||||
| β-laktamazın etkisi ve ara maddenin dekarboksilasyonu | |||||||
| Tanımlayıcılar | |||||||
| EC numarası | 3.5.2.6 | ||||||
| CAS numarası | 9073-60-3 | ||||||
| Veritabanları | |||||||
| IntEnz | IntEnz view | ||||||
| BRENDA | BRENDA entry | ||||||
| ExPASy | NiceZyme view | ||||||
| KEGG | KEGG entry | ||||||
| MetaCyc | metabolic pathway | ||||||
| PRIAM | profile | ||||||
| PDB structures | RCSB PDB PDBj PDBe PDBsum | ||||||
| Gene Ontology | AmiGO / EGO | ||||||
| |||||||


Beta-laktamazlar (β-laktamazlar) bakteriler tarafından üretilen ve penisilinler, sefalosporinler, sefamisinler, monobaktamlar ve karbapenemler (ertapenem) gibi beta-laktam antibiyotiklere karşı çoklu direnç sağlayan enzimlerdir (EC 3.5.2.6), ancak karbapenemler beta-laktamaza karşı nispeten dirençlidir. Beta-laktamaz, antibiyotiklerin yapısını bozarak antibiyotik direnci sağlar. Bu antibiyotiklerin hepsinin moleküler yapılarında ortak bir unsur vardır: beta-laktam (β-laktam) halkası olarak bilinen dört atomlu bir halka. Laktamaz enzimi hidroliz yoluyla β-laktam halkasını kırarak molekülün antibakteriyel özelliklerini devre dışı bırakır.
Gram-negatif bakteriler tarafından üretilen beta-laktamazlar, özellikle ortamda antibiyotik bulunduğunda genellikle salgılanır.[1]
Yapı[değiştir | kaynağı değiştir]
Bir Streptomyces serin β-laktamazının (SBLs) yapısı 1BSG ile verilmiştir. Alfa-beta kıvrımı (InterPro: IPR012338), enzimin evrimleştiği düşünülen bir DD-transpeptidazınkine benzemektedir. β-laktam antibiyotikler DD-transpeptidazlara bağlanarak bakteriyel hücre duvarı biyosentezini inhibe eder. Serin β-laktamazlar, sekans benzerliğine göre A, C ve D tipleri olarak gruplandırılır.
Diğer beta-laktamaz türü ise metallo tipidir ("B tipi"). Metallo-beta-laktamazlar (MBL'ler) katalitik aktiviteleri için aktif bölgelerinde metal iyon(lar)ına (1 veya 2 Zn2+ iyonu[2]) ihtiyaç duyarlar.[3] Yeni Delhi metallo-beta-laktamaz 1'in yapısı 6C89 ile verilmiştir. Kendisinden evrimleştiği düşünülen Ribonükleaz Z'ye benzemektedir.
Etki mekanizması[değiştir | kaynağı değiştir]
İki tip beta-laktamaz, β-laktam halkasını açmaya yönelik iki temel mekanizma temelinde çalışır.[2]
SBL'ler yapı ve mekanik olarak hücre duvarı inşası ve modifikasyonu için gerekli olan β-laktam hedefli penisilin bağlayıcı proteinlere (PBP'ler) benzer. SBL'ler ve PBP'lerin her ikisi de aktif bölgedeki bir Serin kalıntısını kovalent olarak değiştirir. PBP'ler ve SBL'ler arasındaki fark, ikincisinin asil-enzim ara ürününün çok hızlı hidrolizi ile serbest enzim ve inaktif antibiyotik üretmesidir.[kaynak belirtilmeli]
MBL'ler, β-laktam halkasının hidrolizi için bir bağlanma bölgesi su molekülünü aktive etmek üzere Zn2+ iyonlarını kullanır. Çinko şelatörler, genellikle karbapenem duyarlılığını geri kazandırabildikleri için son zamanlarda metallo-β-laktamaz inhibitörleri olarak araştırılmaktadır.[4]
Penisilinaz[değiştir | kaynağı değiştir]
Penisilinaz, yine β-laktam halkasını hidrolize ederek penisilinler için özgüllük gösteren spesifik bir β-laktamaz türüdür. Çeşitli penisilinazların moleküler ağırlıkları 50 kilodalton civarında kümelenme eğilimindedir.
Penisilinaz tanımlanan ilk β-laktamazdır. İlk olarak 1940 yılında Abraham ve Chain tarafından penisilin klinik kullanıma girmeden önce Gram-negatif E. coli'den izole edilmiştir,[5] ancak penisilinaz üretimi daha önce üretmeyen veya nadiren üreten bakterilere hızla yayılmıştır. Metisilin gibi penisilinaza dirençli beta-laktamlar geliştirilmiştir, ancak artık bunlara karşı bile yaygın bir direnç vardır.
Gram-negatif bakterilerde direnç[değiştir | kaynağı değiştir]
Gram-negatif bakteriler arasında, genişlemiş spektrumlu sefalosporinlere karşı direncin ortaya çıkması büyük bir endişe kaynağı olmuştur. Başlangıçta, kromozomal C sınıfı β-laktamazlarını aşırı üretmek için mutasyona uğrayabilen sınırlı sayıda bakteri türünde (E. cloacae, C. freundii, S. marcescens ve P. aeruginosa) ortaya çıkmıştır. Birkaç yıl sonra, doğal olarak AmpC enzimleri üretmeyen bakteri türlerinde (K. pneumoniae, Salmonella spp., P. mirabilis) TEM veya SHV tipi ESBL'lerin (genişlemiş spektrumlu beta laktamazlar) üretimi nedeniyle direnç ortaya çıkmıştır.
Karakteristik olarak, bu tür direnç oksimino- (örneğin seftizoksim, sefotaksim, seftriakson ve seftazidimin yanı sıra oksimino-monobaktam aztreonam), ancak 7-alfa-metoksi-sefalosporinleri (sefamisinler; diğer bir deyişle sefoksitin ve sefotetan); klavulanat, sulbaktam veya tazobaktam gibi inhibitörler tarafından bloke edilmiş ve karbapenemler ve temosilini içermemiştir. Kromozomal aracılı AmpC β-laktamazlar, sefoksitin veya sefotetan gibi 7-alfa-metoksi-sefalosporinlere (sefamisinler) direnç sağladıkları, ancak piyasada bulunan β-laktamaz inhibitörlerinden etkilenmedikleri ve dış membran porin kaybı olan suşlarda karbapenemlere direnç sağlayabildikleri için yeni bir tehdit oluşturmaktadır.[6]
Geniş spektrumlu beta-laktamaz (GSBL)[değiştir | kaynağı değiştir]
Bu ailenin üyeleri genellikle geniş spektrumlu (genişletilmiş spektrumlu) sefalosporinlere direnç kazandıran β-laktamazları (örneğin TEM-3, TEM-4[7] ve SHV-2[8]) ifade eder. 1980'lerin ortalarında, bu yeni enzim grubu, geniş spektrumlu β-laktamazlar (ESBL'ler) tespit edilmiştir (ilk olarak 1979'da tespit edilmiştir).[9]
GSBL üreten bakterilerin prevalansı akut bakım hastanelerinde giderek artmaktadır.[10] Genel popülasyondaki prevalans ülkeler arasında farklılık göstermektedir; örneğin Almanya[11] ve Fransa'da[12] yaklaşık %6, Suudi Arabistan'da %13[13] ve Mısır'da %63'tür.[14]
GSBL'ler, oksimino yan zincirine sahip geniş spektrumlu sefalosporinleri hidrolize eden beta-laktamazlardır. Bu sefalosporinler arasında sefotaksim, seftriakson ve seftazidimin yanı sıra oksiimino-monobaktam aztreonam da bulunmaktadır. Dolayısıyla GSBL'ler bu antibiyotiklere ve ilgili oksimino-beta laktamlara karşı çoklu direnç sağlamaktadır. Tipik durumlarda, bu β-laktamazların aktif bölgesi etrafındaki amino asit konfigürasyonunu değiştiren mutasyonlar yoluyla TEM-1, TEM-2 veya SHV-1 genlerinden türerler. Daha geniş bir β-laktam antibiyotik grubu bu enzimler tarafından hidrolize edilebilir. Son zamanlarda TEM veya SHV soyundan olmayan artan sayıda ESBL tanımlanmıştır.[15]
GSBL'ler sıklıkla plazmid kodludur. GSBL üretiminden sorumlu plazmidler sıklıkla diğer ilaç sınıflarına (örneğin aminoglikozidler) karşı direnci kodlayan genler taşır. Bu nedenle, GSBL üreten organizmaların tedavisinde antibiyotik seçenekleri son derece sınırlıdır. Karbapenemler, GSBL üreten organizmalara bağlı ciddi enfeksiyonlar için tercih edilen tedavidir, ancak son zamanlarda karbapeneme dirençli (öncelikle ertapeneme dirençli) izolatlar bildirilmiştir.[16] GSBL üreten organizmalar bazı genişlemiş spektrumlu sefalosporinlere karşı duyarlı görünebilir. Ancak, bu tür antibiyotiklerle tedavi yüksek başarısızlık oranları ile ilişkilendirilmiştir.[kaynak belirtilmeli]
Türler[değiştir | kaynağı değiştir]
TEM beta-laktamazlar (sınıf A)[değiştir | kaynağı değiştir]
TEM-1, Gram-negatif bakterilerde en sık karşılaşılan beta-laktamazdır. E. coli'deki ampisilin direncinin %90'a varan kısmı TEM-1 üretiminden kaynaklanmaktadır.[17] Ayrıca H. influenzae ve N. gonorrhoeae'de giderek artan sayıda görülen ampisilin ve penisilin direncinden de sorumludur. TEM tipi beta-laktamazlar en sık E. coli ve K. pneumoniae'de bulunmasına rağmen, diğer Gram-negatif bakteri türlerinde de artan sıklıkta bulunurlar.
Geniş spektrumlu beta-laktamaz (GSBL) fenotipinden sorumlu amino asit sübstitüsyonları enzimin aktif bölgesi etrafında kümelenir ve konfigürasyonunu değiştirerek oksimino-beta-laktam substratlarına erişim sağlar. Aktif bölgenin beta-laktam substratlara açılması da tipik olarak enzimin klavulanik asit gibi β-laktamaz inhibitörlerine karşı duyarlılığını artırır.
104, 164, 238 ve 240 pozisyonlarındaki tek amino asit değişimleri GSBL fenotipini üretir, ancak en geniş spektruma sahip GSBL'ler genellikle tek bir amino asit değişiminden daha fazlasına sahiptir. Değişikliklerin farklı kombinasyonlarına dayalı olarak, şu anda 140 TEM tipi enzim tanımlanmıştır. TEM-10, TEM-12 ve TEM-26 Amerika Birleşik Devletleri'nde en yaygın olanlarıdır.[18][19][20] TEM terimi, 1963 yılında izolatın elde edildiği Atinalı hastanın (Temoniera) adından gelmektedir.[21]
SHV beta-laktamazlar (sınıf A)[değiştir | kaynağı değiştir]
SHV-1, amino asitlerinin yüzde 68'ini TEM-1 ile paylaşır ve benzer bir genel yapıya sahiptir. SHV-1 beta-laktamaz en yaygın olarak K. pneumoniae'de bulunur ve bu türdeki plazmid aracılı ampisilin direncinin %20'sinden sorumludur. Bu ailedeki GSBL'ler aktif bölge çevresinde, en sık 238 veya 238 ve 240 pozisyonlarında olmak üzere amino asit değişikliklerine sahiptir. 60'tan fazla SHV çeşidi bilinmektedir. SHV-5 ve SHV-12 en yaygın olanları arasındadır.[18] Baş harfleri "sülfhidril reaktif değişkeni" (İngilizce: sulfhydryl reagent variable) anlamına gelmektedir.[22]
CTX-M beta-laktamazlar (sınıf A)[değiştir | kaynağı değiştir]
Bu enzimler sefotaksime karşı diğer oksimino-beta-laktam substratlarına (örn. seftazidim, seftriakson veya sefepim) kıyasla daha yüksek aktiviteye sahip olmaları nedeniyle adlandırılmıştır. Mutasyonla ortaya çıkmak yerine, nadiren patojenik kommensal organizmalar grubu olan Kluyvera türlerinin kromozomunda normal olarak bulunan beta-laktamaz genlerinin plazmid ediniminin örneklerini temsil ederler. Bu enzimler TEM veya SHV beta-laktamazları ile çok yakından ilişkili değildir, çünkü yaygın olarak izole edilen bu iki beta-laktamaz ile sadece yaklaşık %40 özdeşlik gösterirler. Şu anda 172'den fazla CTX-M enzimi bilinmektedir.[23]
Adlarına rağmen, birkaçı seftazidim üzerinde sefotaksimden daha aktiftir. Esas olarak Salmonella enterica serovar Typhimurium ve E. coli suşlarında bulunmuşlardır, ancak diğer Enterobacteriaceae türlerinde de tanımlanmışlardır ve Güney Amerika'nın bazı bölgelerinde baskın GSBL türüdürler. (Doğu Avrupa'da da görülürler) CTX-M-14, CTX-M-3 ve CTX-M-2 en yaygın olanlarıdır. CTX-M-15 şu anda (2006) İngiltere'de E. coli'de en yaygın türdür ve toplumda yaygın olarak görülmektedir.[24]
Beta-laktamaz CTX-M-15'in bir örneğinin ISEcp1 ile birlikte yakın zamanda Klebsiella pneumoniae ATCC BAA-2146'nın kromozomuna aktarıldığı tespit edilmiştir.[25] Baş harfleri "Sefotaksim-Münih" (İngilizce: Cefotaxime-Munich) anlamına gelmektedir.[26]
OXA beta-laktamazlar (sınıf D)[değiştir | kaynağı değiştir]
OXA beta-laktamazlar uzun zamandır oksasilin ve ilgili anti-stafilokokal penisilinleri hidrolize edebilen daha az yaygın ama aynı zamanda plazmid aracılı bir beta-laktamaz çeşidi olarak tanınmaktadır. Bu beta-laktamazlar TEM ve SHV enzimlerinden moleküler sınıf D ve fonksiyonel grup 2d'ye ait olmaları bakımından farklılık göstermektedir. OXA tipi beta-laktamazlar ampisilin ve sefalotine direnç kazandırır ve oksasilin ve kloksasiline karşı yüksek hidrolitik aktiviteleri ve klavulanik asit tarafından zayıf bir şekilde inhibe edilmeleri ile karakterize edilirler. OXA enzimlerindeki amino asit sübstitüsyonları da GSBL fenotipini verebilir. Çoğu ESBL E. coli, K. pneumoniae ve diğer Enterobacteriaceae'de bulunurken, OXA tipi GSBL'ler çoğunlukla P. aeruginosa'da bulunmuştur.
OXA-tipi GSBL'ler özellikle Türkiye ve Fransa'dan izole edilen Pseudomonas aeruginosa izolatlarında bulunmuştur. OXA beta-laktamaz ailesi, başlangıçta spesifik bir hidroliz profiline sahip birkaç beta-laktamaz için genotipik bir gruptan ziyade fenotipik bir grup olarak oluşturulmuştur. Bu nedenle, bu ailenin bazı üyeleri arasında %20 kadar az bir dizi homolojisi vardır. Bununla birlikte, bu aileye yeni eklenenler, OXA beta-laktamaz ailesinin mevcut üyelerinden bir veya daha fazlasıyla bir dereceye kadar homoloji göstermektedir. Bazıları ağırlıklı olarak seftazidime direnç gösterirken, OXA-17 sefotaksim ve sefepime seftazidime gösterdiğinden daha fazla direnç gösterir.
Diğerleri[değiştir | kaynağı değiştir]
PER, VEB, GES ve IBC beta-laktamazlar gibi diğer plazmid aracılı GSBL'ler tanımlanmıştır, ancak nadirdir ve çoğunlukla P. aeruginosa'da ve sınırlı sayıda coğrafi bölgede bulunmuştur. PER-1 Türkiye, Fransa ve İtalya'daki izolatlarda; VEB-1 ve VEB-2 Güneydoğu Asya'daki suşlarda; GES-1, GES-2 ve IBC-2 ise Güney Afrika, Fransa ve Yunanistan'daki izolatlarda bulunmaktadır. PER-1 ayrıca Kore ve Türkiye'deki çoklu dirençli acinetobacter türlerinde de yaygındır. Bu enzimlerin bazıları Enterobacteriaceae'de de bulunurken, diğer yaygın olmayan ESBL'ler (BES-1, IBC-1, SFO-1 ve TLA-1 gibi) sadece Enterobacteriaceae'de bulunmuştur.
Tedavi[değiştir | kaynağı değiştir]
GSBL üreten organizmalar daha önce hastaneler ve kurumsal bakım ile ilişkilendirilirken, bu organizmalara artık toplumda giderek daha fazla rastlanmaktadır. CTX-M-15-pozitif E. coli, Birleşik Krallık'ta toplum kaynaklı üriner enfeksiyonların bir nedenidir[24] ve tüm oral β-laktam antibiyotiklerin yanı sıra kinolonlar ve sülfonamidlere karşı dirençli olma eğilimindedir. Tedavi seçenekleri arasında nitrofurantoin, fosfomisin, mesillinam ve kloramfenikol yer alabilir. Çaresizlik durumunda, günde bir kez ertapenem veya gentamisin enjeksiyonları da kullanılabilir.
İnhibitörlere dirençli β-laktamazlar[değiştir | kaynağı değiştir]
İnhibitöre dirençli β-laktamazlar GSBL olmamakla birlikte, klasik TEM veya SHV tipi enzimlerin türevleri oldukları için sıklıkla GSBL'lerle birlikte ele alınmaktadırlar. Bu enzimlere ilk başta inhibitöre dirençli TEM β-laktamaz için IRT adı verilmiştir; ancak daha sonra hepsi sayısal TEM adlarıyla yeniden adlandırılmıştır. En az 19 farklı inhibitöre dirençli TEM β-laktamaz vardır. İnhibitöre dirençli TEM β-laktamazlar çoğunlukla E. coli'nin klinik izolatlarında, aynı zamanda bazı K. pneumoniae, Klebsiella oxytoca, P. mirabilis ve Citrobacter freundii suşlarında bulunmuştur.
İnhibitöre dirençli TEM varyantları klavulanik asit ve sulbaktam inhibisyonuna dirençli olmakla birlikte, amoksisilin-klavulanat (ko-amoksiklav) beta-laktam-laktamaz inhibitör kombinasyonlarına karşı klinik direnç göstermektedir, tikarsilin-klavulanat (ko-tikarklav) ve ampisilin/sulbaktam, normalde tazobaktam ve daha sonra piperasilin/tazobaktam kombinasyonu ile inhibisyona duyarlı kalırlar,[kaynak belirtilmeli] ancak direnç tanımlanmıştır. Bu artık öncelikli olarak Avrupa epidemiyolojisi değildir, Amerika'nın kuzey bölgelerinde sıklıkla bulunur ve karmaşık İYE'lerde test edilmelidir.[19]
AmpC tipi β-laktamazlar (sınıf C)[değiştir | kaynağı değiştir]
AmpC tipi β-laktamazlar genellikle geniş spektrumlu sefalosporinlere dirençli Gram-negatif bakterilerden izole edilir. AmpC β-laktamazlar (sınıf C veya grup 1 olarak da adlandırılır) tipik olarak Citrobacter, Serratia ve Enterobacter türleri dahil olmak üzere birçok Gram-negatif bakterinin kromozomunda kodlanır ve ekspresyonu genellikle indüklenebilirdir; Escherichia coli'de de görülebilir, ancak hipereksprese edilebilmesine rağmen genellikle indüklenebilir değildir. AmpC tipi β-laktamazlar plazmidler üzerinde de taşınabilir.[6] AmpC β-laktamazlar, GSBL'lerin aksine, dar ve geniş spektrumlu sefalosporinleri (sefamisinlerin yanı sıra oksimino-β-laktamlara) hidrolize eder, ancak tipik olarak β-laktamaz inhibitörleri klavulanik asit ve tazobaktam tarafından inhibe edilmezken, avibaktam bu β-laktamaz sınıfına karşı inhibitör aktiviteyi koruyabilir.[27] AmpC tipi β-laktamaz organizmaları genellikle klinik olarak "SPACE" kısaltması ile gruplandırılır: Serratia, Pseudomonas veya Proteus, Acinetobacter, Citrobacter ve Enterobacter.
Karbapenemazlar[değiştir | kaynağı değiştir]
Karbapenemler AmpC β-laktamazlara ve genişlemiş spektrumlu β-laktamazlara karşı oldukça stabildir. Karbapenemazlar, sadece oksimino-sefalosporinlere ve sefamisinlere karşı değil aynı zamanda karbapenemlere karşı da aktif olan çeşitli bir β-laktamaz grubudur. Aztreonam metallo-β-laktamazlara karşı stabildir, ancak birçok IMP ve VIM üreticisi diğer mekanizmalar nedeniyle dirençlidir. Karbapenemazların eskiden sadece A, B ve D sınıflarından türediğine inanılırdı, ancak bir C sınıfı karbapenemaz tanımlanmıştır.
IMP tipi karbapenemazlar (metallo-β-laktamazlar) (sınıf B)[değiştir | kaynağı değiştir]
Şu anda 19 çeşidi bilinen plazmid aracılı IMP tipi karbapenemazlar (IMP, aktif-on-imipenem anlamına gelmektedir), 1990'larda Japonya'da hem enterik Gram-negatif organizmalarda hem de Pseudomonas ve Acinetobacter türlerinde yerleşmiştir. IMP enzimleri yavaş yavaş Uzak Doğu'daki diğer ülkelere yayılmış, 1997'de Avrupa'dan rapor edilmiş ve Kanada ve Brezilya'da bulunmuştur.
VIM (Verona integron kodlu metallo-β-laktamaz) (Sınıf B)[değiştir | kaynağı değiştir]
Büyüyen ikinci bir karbapenemaz ailesi olan VIM ailesi 1999 yılında İtalya'dan bildirilmiştir ve şu anda Avrupa, Güney Amerika ve Uzak Doğu'da geniş bir coğrafi dağılıma sahip olan ve Amerika Birleşik Devletleri'nde bulunan 10 üyeyi içermektedir. VIM-1, 1996 yılında İtalya'da P. aeruginosa'da keşfedilmiştir; o zamandan beri, şu anda baskın varyant olan VIM-2, Avrupa ve Uzak Doğu'da tekrar tekrar bulunmuştur; VIM-3 ve -4, sırasıyla VIM-2 ve -1'in küçük varyantlarıdır.
Amino asit dizisi çeşitliliği VIM ailesinde %10'a, IMP ailesinde %15'e ve VIM ile IMP arasında %70'e kadar çıkmaktadır. Bununla birlikte, her iki ailenin enzimleri benzerdir. Her ikisi de integronla ilişkilidir, bazen plazmidler içinde bulunur. Her ikisi de monobaktamlar hariç tüm β-laktamları hidrolize eder ve tüm β-laktam inhibitörlerinden kaçınır. VIM enzimleri en yaygın dağılıma sahip MBL'ler arasındadır ve 40'tan fazla VIM varyantı rapor edilmiştir. Biyokimyasal ve biyofiziksel çalışmalar, VIM varyantlarının kinetik parametrelerinde sadece küçük farklılıklar olduğunu, ancak termal stabilitelerinde ve inhibisyon profillerinde önemli farklılıklar olduğunu ortaya koymuştur.[28]
β-laktamazların OXA (oksasilinaz) grubu (sınıf D)[değiştir | kaynağı değiştir]
OXA grubu β-laktamazlar esas olarak Acinetobacter türlerinde görülür ve iki kümeye ayrılır. OXA karbapenemazlar karbapenemleri in vitro ortamda çok yavaş hidrolize eder ve bazı Acinetobacter konaklarında görülen yüksek MİK değerleri (>64 mg/L) ikincil mekanizmaları yansıtıyor olabilir. Bazen klinik izolatlarda geçirimsizlik veya efluks gibi ek direnç mekanizmalarıyla artırılırlar. OXA karbapenemazlar ayrıca penisilinlere ve sefalosporinlere karşı hidrolitik etkinliği azaltma eğilimindedir.[29]
KPC (K. pneumoniae karbapenemaz) (sınıf A)[değiştir | kaynağı değiştir]
Çoğu plazmid aracılı KPC enzimleri olmak üzere birkaç A sınıfı enzim de etkili karbapenemazlardır. KPC-2'den KPC-11'e kadar on varyant bilinmektedir ve bunlar bir ya da iki amino asit değişimiyle ayırt edilmektedir (KPC-1 2008 yılında yeniden dizilenmiş ve KPC-2'nin yayınlanmış dizileriyle %100 homolog olduğu bulunmuştur). KPC-1 Kuzey Carolina'da, KPC-2 Baltimore'da ve KPC-3 New York'ta bulunmuştur. SME ve NMC/IMI enzimleriyle yalnızca %45 homolojiye sahiptirler ve onlardan farklı olarak kendi kendine bulaşabilen plazmidler tarafından kodlanabilirler.
Şubat 2009 itibarıyla, A sınıfı Klebsiella pneumoniae karbapenemazı (KPC) küresel olarak en yaygın karbapenemaz olmuştur ve ilk kez 1996 yılında Kuzey Karolina, ABD'de tespit edilmiştir.[30] 2010 yılında yayınlanan bir yayında, KPC üreten Enterobacteriaceae'nin Amerika Birleşik Devletleri'nde yaygınlaştığı belirtilmiştir.[31]
CMY (C sınıfı)[değiştir | kaynağı değiştir]
İlk C sınıfı karbapenemaz 2006 yılında tanımlanmış ve Enterobacter aerogenes'in virülan bir suşundan izole edilmiştir.[32] Bir plazmid olan pYMG-1 üzerinde taşınır ve bu nedenle diğer bakteri suşlarına bulaşabilir.[33]
SME (Serratia marcescens enzimleri), IMI (IMIpenem-hydrolysing β-lactamase), NMC ve CcrA[değiştir | kaynağı değiştir]
Genel olarak bunların klinik önemi çok azdır.
CcrA (CfiA). Geni B. fragilis izolatlarının yaklaşık %1-3'ünde bulunur, ancak ekspresyon bir ekleme dizisinin uygun şekilde taşınmasını gerektirdiğinden daha azı enzimi üretir. CcrA, imipenem ortaya çıkmadan önce biliniyordu ve üreticiler daha sonra çok az artış göstermiştir.
NDM-1 (Yeni Delhi metallo-β-laktamaz) (sınıf B)[değiştir | kaynağı değiştir]
İlk olarak 2009 yılında Yeni Delhi'de tanımlanan bu gen, şu anda Hindistan ve Pakistan'daki Escherichia coli ve Klebsiella pneumoniae'de yaygındır. 2010 yılının ortalarından itibaren NDM-1 taşıyan bakteriler diğer ülkelere de (Amerika Birleşik Devletleri ve İngiltere dahil) yayılmıştır; bunun nedeni büyük olasılıkla dünyayı gezen çok sayıda turisttir ve NDM-1 genini içeren suşlar Hindistan'daki çevresel örneklerde bulunduğundan bu suşu çevreden almış olabilirler.[34] NDM'nin farklı özellikleri paylaşan çeşitli varyantları vardır.[28]
GSBL/AmpC/karbapenemazların tedavisi[değiştir | kaynağı değiştir]
Genel bakış[değiştir | kaynağı değiştir]
Genel olarak, bir izolat sefamisinlere (sefoksitin, sefotetan) karşı in vitro duyarlılık gösterirken üçüncü nesil sefalosporinlere ve aztreonama karşı direnç gösteriyorsa GSBL üreticisi olduğundan şüphelenilir. Ayrıca, in vitro duyarlılık rapor edilmesine rağmen Gram-negatif enfeksiyonlar için bu ajanlarla tedavi başarısız olduğunda bu suşlardan şüphelenilmelidir. GSBL üreten bir suş tespit edildiğinde, laboratuvar bu suşu (in vitro) duyarlı olarak test edilse bile tüm penisilinler, sefalosporinler ve aztreonama karşı "dirençli" olarak rapor etmelidir.[kaynak belirtilmeli]
Aminoglikozitlere ve trimetoprim-sülfametoksazole karşı ilişkili direnç ve florokinolon direncinin yüksek sıklıkta bir arada bulunması sorun yaratmaktadır. Klavulanat, sulbaktam ve tazobaktam gibi beta-laktamaz inhibitörleri in vitro olarak çoğu GSBL'yi inhibe eder, ancak beta-laktam/beta-laktamaz inhibitörü kombinasyonlarının klinik etkinliği tedavi için tutarlı bir şekilde güvenilemez. Sefamisinler (sefoksitin ve sefotetan) GSBL'lerin çoğu tarafından hidrolize edilmez, ancak ilişkili AmpC tipi β-laktamaz tarafından hidrolize edilir. Ayrıca, β-laktam/β-laktamaz inhibitör kombinasyonları AmpC-tipi β-laktamaz üreten organizmalara karşı etkili olmayabilir. Bazen bu suşlar dış membran proteinlerinin ekspresyonunu azaltarak onları sefamisinlere dirençli hale getirir. İn vivo çalışmalar GSBL üreten K. pneumoniae'ye karşı karışık sonuçlar vermiştir. (Dördüncü nesil bir sefalosporin olan sefepim, birçok ESBL/AmpC suşunun varlığında in vitro stabilite göstermiştir).
Günümüzde karbapenemler, genel olarak, GSBL üreten organizmalara bağlı enfeksiyonların tedavisinde tercih edilen ajan olarak kabul edilmektedir. Karbapenemler GSBL aracılı hidrolize dirençlidir ve GSBL eksprese eden Enterobacteriaceae suşlarına karşı mükemmel in vitro aktivite sergiler.
Genlere göre[değiştir | kaynağı değiştir]
GSBLs[değiştir | kaynağı değiştir]
Sadece GSBL üreten suşlar in vitro olarak sefamisinlere ve karbapenemlere duyarlıdır ve bu ajanlarla çok az inokulum etkisi gösterirler.
TEM ve SHV tipi GSBL üreten organizmalar için sefepim ve piperasilin/tazobaktama karşı belirgin in vitro duyarlılık yaygındır, ancak her iki ilaç da bir inokulum etkisi gösterir ve inokulum boyutu 105'ten 107 organizmaya yükseldikçe duyarlılık azalır.
Bazı CTX-M tipi ve OXA tipi GSBL'lere sahip suşlar, standart bir inokulum kullanılmasına rağmen test sırasında sefepime dirençlidir.
İnhibitörlere dirençli β-laktamazlar[değiştir | kaynağı değiştir]
İnhibitöre dirençli TEM varyantları klavulanik asit ve sulbaktam tarafından inhibisyona dirençli olmalarına ve böylece amoksisilin-klavulanat (Ko-amoksiklav), tikarsilin-klavulanat ve ampisilin/sulbaktam beta-laktam-beta laktamaz inhibitör kombinasyonlarına klinik direnç göstermelerine rağmen, tazobaktam ve ardından piperasilin/tazobaktam kombinasyonu tarafından inhibisyona duyarlı kalmaktadırlar.
AmpC[değiştir | kaynağı değiştir]
AmpC üreten suşlar tipik olarak oksimino-beta laktamlara ve sefamisinlere dirençlidir ve karbapenemlere duyarlıdır; ancak porin ekspresyonunun azalması böyle bir suşu karbapeneme de dirençli hale getirebilir.
Karbapenemazlar[değiştir | kaynağı değiştir]
IMP-, VIM- ve OXA-tipi karbapenemazlara sahip suşlar genellikle duyarlı kalmaktadır. Bu enzimlerden herhangi birini üreten suşlarda beta-laktam dışı antibiyotiklere direnç yaygındır, bu nedenle beta-laktam dışı tedavi için alternatif seçeneklerin doğrudan duyarlılık testi ile belirlenmesi gerekir. Florokinolonlara ve aminoglikozitlere karşı direnç özellikle yüksektir.
Türlere göre[değiştir | kaynağı değiştir]
Escherichia coli veya Klebsiella[değiştir | kaynağı değiştir]
GSBL üreten Escherichia coli veya Klebsiella türlerinin neden olduğu enfeksiyonlar için, imipenem veya meropenem ile tedavi, sağkalım ve bakteriyolojik klirens açısından en iyi sonuçlarla ilişkilendirilmiştir. Sefepim ve piperasilin/tazobaktam daha az başarılı olmuştur. Seftriakson, sefotaksim ve seftazidim, organizmanın antibiyotiğe karşı in vitro duyarlılığına rağmen daha da sık başarısız olmuştur. Porin kaybına bağlı direncin bir sonucu olarak sefamisin tedavisinin başarısız olduğu birkaç raporda belgelenmiştir. Bazı hastalar aminoglikozit veya kinolon tedavisine yanıt vermiştir, ancak yakın zamanda GSBL üreten bir K. pneumoniae içeren bakteriyemi için siprofloksasin ve imipenem karşılaştırmasında, imipenem daha iyi sonuç vermiştir
Pseudomonas aeruginosa[değiştir | kaynağı değiştir]
GSBL üreten Pseudomonas aeruginosa suşlarının neden olduğu enfeksiyonlar için en uygun tedaviyi tanımlayan çok az klinik çalışma yapılmıştır.
Farmasötik olarak kullanım[değiştir | kaynağı değiştir]
1957 yılında, penisilin içeren antibiyotiklere karşı alerjik reaksiyonlardan duyulan endişe nedeniyle, bir beta-laktamaz neutrapen markası altında antidot olarak satıldı.[35] Penisilinin enzim tarafından parçalanmasının alerjik reaksiyonu tedavi edeceği teorisi ortaya atılmıştır.[36] Akut anafilaktik şokta yararlı olmamakla birlikte, penisilin alerjisinden kaynaklandığından şüphelenilen ürtiker ve eklem ağrısı vakalarında olumlu sonuçlar gösterdi.[37][38] Penisilinin koruyucu olarak kullanıldığı çocuk felci aşısının uygulanması üzerine penisilin alerjisinin keşfedildiği pediatrik vakalarda kullanımı önerilmiştir.[39] Ancak bazı hastalarda nötrapene karşı alerji gelişmiştir.[40][41] Albany Hastanesi, ilacı ekledikten sadece iki yıl sonra, kullanım yetersizliğini gerekçe göstererek 1960 yılında formülerinden çıkarmıştır.[42] Bazı araştırmacılar 1972'ye kadar penisilin direnci üzerine deneylerde kullanmaya devam etti.[43] 1997'de 3M Pharmaceuticals tarafından gönüllü olarak Amerikan pazarından çekilmiştir.[44]
Tespit[değiştir | kaynağı değiştir]
Beta-laktamaz enzimatik aktivitesi, beta-laktamaz aracılı hidroliz üzerine sarıdan kırmızıya renk değiştiren kromojenik bir sefalosporin substratı olan nitrosefin kullanılarak tespit edilebilir.[45]
Evrim[değiştir | kaynağı değiştir]
Beta-laktamazlar eski bakteriyel enzimlerdir. Metalo β-laktamazların ("B sınıfı") hepsi yapısal olarak RNaz Z'ye benzer ve ondan evrimleşmiş olabilir. Üç alt sınıf olan B1, B2 ve B3'ten B1 ve B2'nin yaklaşık bir milyar yıl önce evrimleştiği, B3'ün ise muhtemelen Gram-pozitif ve Gram-negatif öbakterilerin yaklaşık iki milyar yıl önce ayrışmasından önce bağımsız olarak ortaya çıktığı düşünülmektedir.[46] PNGM-1 (Papua Yeni Gine Metallo-β-laktamaz-1) hem metallo-β-laktamaz (MBL) hem de tRNaz Z aktivitelerine sahiptir, bu da PNGM-1'in bir tRNaz Z'den evrimleştiğini ve PNGM-1'in B3 MBL aktivitesinin karışık bir aktivite olduğunu ve alt sınıf B3 MBL'lerin PNGM-1 aktivitesi yoluyla evrimleştiğini düşündürmektedir.[47] B1 ve B3 alt sınıfları daha da alt bölümlere ayrılmıştır.[48]
Serin beta-laktamazlar (A, C ve D sınıfları), hücre duvarı biyosentezinde yer alan penisilin bağlayıcı proteinler olan DD-transpeptidazlardan evrimleşmiş gibi görünmektedir ve bu nedenle beta-laktam antibiyotiklerin ana hedeflerinden biridir.[49] Bu üç sınıf birbirleriyle tespit edilemeyen sekans benzerliği gösterir, ancak yine de yapısal homoloji kullanılarak karşılaştırılabilir. A ve D grupları kardeş taksonlardır ve C grubu A ve D'den önce ayrışmıştır.[50] B grubu betalaktamazlar gibi bu serin bazlı enzimler antik kökenlidir ve yaklaşık iki milyar yıl önce evrimleştikleri teorisi vardır.[51]
Özellikle OXA grubunun (D sınıfında) kromozomlar üzerinde evrimleştiği ve en az iki ayrı durumda plazmidlere geçtiği tahmin edilmektedir.[52]
Etimoloji[değiştir | kaynağı değiştir]
"β" (beta), nitrojenin halkadaki ikinci karbon üzerindeki konumunu ifade eder. Laktam, lakton (Latince lactis, süt, laktik asit ekşitilmiş sütten izole edildiği için) ve amidin bir karışımıdır. Bir enzimi belirten -az eki, 1833 yılında Payen ve Persoz tarafından keşfedilen ilk enzim olan diastazdan (Yunanca diastasis, "ayrılma") türetilmiştir.[53]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Neu HC (June 1969). "Effect of beta-lactamase location in Escherichia coli on penicillin synergy". Applied Microbiology. 17 (6). ss. 783-6. doi:10.1128/AEM.17.6.783-786.1969. PMC 377810 $2. PMID 4894721.
- ^ a b Rotondo CM, Wright GD (October 2017). "Inhibitors of metallo-β-lactamases". Current Opinion in Microbiology. Cilt 39. ss. 96-105. doi:10.1016/j.mib.2017.10.026. PMID 29154026.
- ^ Shi C, Chen J, Kang X, Shen X, Lao X, Zheng H (August 2019). "Approaches for the discovery of metallo-β-lactamase inhibitors: A review". Chemical Biology & Drug Design. 94 (2). ss. 1427-1440. doi:10.1111/cbdd.13526. PMID 30925023.
- ^ Principe, Luigi; Vecchio, Graziella; Sheehan, Gerard; Kavanagh, Kevin; Morroni, Gianluca; Viaggi, Valentina; di Masi, Alessandra; Giacobbe, Daniele Roberto; Luzzaro, Francesco; Luzzati, Roberto; Di Bella, Stefano (1 Ekim 2020). "Zinc Chelators as Carbapenem Adjuvants for Metallo-β-Lactamase-Producing Bacteria: In Vitro and In Vivo Evaluation". Microbial Drug Resistance (İngilizce). 26 (10). ss. 1133-1143. doi:10.1089/mdr.2020.0037. ISSN 1076-6294. PMID 32364820.
- ^ Abraham EP, Chain E (1940). "An enzyme from bacteria able to destroy penicillin". Nature. 46 (3713). s. 837. Bibcode:1940Natur.146..837A. doi:10.1038/146837a0.
- ^ a b Philippon A, Arlet G, Jacoby GA (January 2002). "Plasmid-determined AmpC-type beta-lactamases". Antimicrobial Agents and Chemotherapy. 46 (1). ss. 1-11. doi:10.1128/AAC.46.1.1-11.2002. PMC 126993 $2. PMID 11751104.
- ^ "Ambler class A beta-lactamases: TEM". Beta-Lactamase DataBase (BLDB. 11 Şubat 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Şubat 2022.
- ^ "Ambler class A beta-lactamases: SHV". Beta-Lactamase DataBase (BLDB). 11 Şubat 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Şubat 2022.
- ^ Sanders CC, Sanders WE (June 1979). "Emergence of resistance to cefamandole: possible role of cefoxitin-inducible beta-lactamases". Antimicrobial Agents and Chemotherapy. 15 (6). ss. 792-797. doi:10.1128/AAC.15.6.792. PMC 352760 $2. PMID 314270.
- ^ Spadafino JT, Cohen B, Liu J, Larson E (2014). "Temporal trends and risk factors for extended-spectrum beta-lactamase-producing Escherichia coli in adults with catheter-associated urinary tract infections". Antimicrobial Resistance and Infection Control. 3 (1). s. 39. doi:10.1186/s13756-014-0039-y. PMC 4306238 $2. PMID 25625011.
- ^ Symanzik C, Hillenbrand J, Stasielowicz L, Greie JC, Friedrich AW, Pulz M, ve diğerleri. (December 2021). "Novel insights into pivotal risk factors for rectal carriage of extended-spectrum-β-lactamase-producing enterobacterales within the general population in Lower Saxony, Germany". Journal of Applied Microbiology. 132 (4). ss. 3256-3264. doi:10.1111/jam.15399. PMID 34856042.
- ^ Nicolas-Chanoine MH, Gruson C, Bialek-Davenet S, Bertrand X, Thomas-Jean F, Bert F, ve diğerleri. (March 2013). "10-Fold increase (2006-11) in the rate of healthy subjects with extended-spectrum β-lactamase-producing Escherichia coli faecal carriage in a Parisian check-up centre". The Journal of Antimicrobial Chemotherapy. 68 (3). ss. 562-568. doi:10.1093/jac/dks429. PMID 23143897.
- ^ Kader AA, Kamath KA (2009). "Faecal carriage of extended-spectrum beta-lactamase-producing bacteria in the community". Eastern Mediterranean Health Journal. 15 (6). ss. 1365-1370. PMID 20218126.
- ^ Valverde A, Grill F, Coque TM, Pintado V, Baquero F, Cantón R, Cobo J (August 2008). "High rate of intestinal colonization with extended-spectrum-beta-lactamase-producing organisms in household contacts of infected community patients". Journal of Clinical Microbiology. 46 (8). ss. 2796-2799. doi:10.1128/JCM.01008-08. PMC 2519510 $2. PMID 18562591.
- ^ Emery CL, Weymouth LA (August 1997). "Detection and clinical significance of extended-spectrum beta-lactamases in a tertiary-care medical center". Journal of Clinical Microbiology. 35 (8). ss. 2061-2067. doi:10.1128/JCM.35.8.2061-2067.1997. PMC 229903 $2. PMID 9230382.
- ^ Grundmann H, Livermore DM, Giske CG, Canton R, Rossolini GM, Campos J, ve diğerleri. (November 2010). "Carbapenem-non-susceptible Enterobacteriaceae in Europe: conclusions from a meeting of national experts". Euro Surveillance. 15 (46). doi:10.2807/ese.15.46.19711-en. hdl:10400.18/206. PMID 21144429.
- ^ Cooksey R, Swenson J, Clark N, Gay E, Thornsberry C (May 1990). "Patterns and mechanisms of beta-lactam resistance among isolates of Escherichia coli from hospitals in the United States". Antimicrobial Agents and Chemotherapy. 34 (5). ss. 739-45. doi:10.1128/AAC.34.5.739. PMC 171683 $2. PMID 2193616.
- ^ a b Paterson DL, Hujer KM, Hujer AM, Yeiser B, Bonomo MD, Rice LB, Bonomo RA (November 2003). "Extended-spectrum beta-lactamases in Klebsiella pneumoniae bloodstream isolates from seven countries: dominance and widespread prevalence of SHV- and CTX-M-type beta-lactamases". Antimicrobial Agents and Chemotherapy. 47 (11). ss. 3554-60. doi:10.1128/AAC.47.11.3554-3560.2003. PMC 253771 $2. PMID 14576117.
- ^ a b Bradford PA (October 2001). "Extended-spectrum beta-lactamases in the 21st century: characterization, epidemiology, and detection of this important resistance threat". Clinical Microbiology Reviews. 14 (4). ss. 933-51, table of contents. doi:10.1128/CMR.14.4.933-951.2001. PMC 89009 $2. PMID 11585791.
- ^ Jacoby GA, Munoz-Price LS (January 2005). "The new beta-lactamases". The New England Journal of Medicine. 352 (4). ss. 380-91. doi:10.1056/NEJMra041359. PMID 15673804.
- ^ Ruiz J (2018). "Etymologia: TEM". Emerging Infectious Diseases. 24 (4). s. 709. doi:10.3201/eid2404.et2404. PMC 5875283 $2.
- ^ Liakopoulos A, Mevius D, Ceccarelli D (5 Eylül 2016). "A Review of SHV Extended-Spectrum β-Lactamases: Neglected Yet Ubiquitous". Frontiers in Microbiology. Cilt 7. s. 1374. doi:10.3389/fmicb.2016.01374. PMC 5011133 $2. PMID 27656166.
- ^ Ramadan AA, Abdelaziz NA, Amin MA, Aziz RK (March 2019). "Novel blaCTX-M variants and genotype-phenotype correlations among clinical isolates of extended spectrum beta lactamase-producing Escherichia coli". Scientific Reports. 9 (1). s. 4224. Bibcode:2019NatSR...9.4224R. doi:10.1038/s41598-019-39730-0. PMC 6414621 $2. PMID 30862858.
- ^ a b Woodford N, Ward E, Kaufmann ME, ve diğerleri. "Molecular characterisation of Escherichia coli isolates producing CTX-M-15 extended-spectrum β-lactamase (ESBL) in the United Kingdom" (PDF). Health Protection Agency. 15 Haziran 2007 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 19 Kasım 2006.
- ^ Hudson CM, Bent ZW, Meagher RJ, Williams KP (7 Haziran 2014). "Resistance determinants and mobile genetic elements of an NDM-1-encoding Klebsiella pneumoniae strain". PLOS ONE. 9 (6). ss. e99209. Bibcode:2014PLoSO...999209H. doi:10.1371/journal.pone.0099209. PMC 4048246 $2. PMID 24905728.
- ^ Cantón R, González-Alba JM, Galán JC (2012). "CTX-M Enzymes: Origin and Diffusion". Frontiers in Microbiology. Cilt 3. s. 110. doi:10.3389/fmicb.2012.00110. ISSN 1664-302X. PMC 3316993 $2. PMID 22485109.
- ^ "Clinical Review, NDA 206494, Ceftazidime-avibactam" (PDF). Food and Drug Administration (FDA). 18 Şubat 2015. 28 Şubat 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 14 Kasım 2023.
- ^ a b Makena A, Düzgün AÖ, Brem J, McDonough MA, Rydzik AM, Abboud MI, ve diğerleri. (December 2015). "Comparison of Verona Integron-Borne Metallo-β-Lactamase (VIM) Variants Reveals Differences in Stability and Inhibition Profiles". Antimicrobial Agents and Chemotherapy. 60 (3). ss. 1377-84. doi:10.1128/AAC.01768-15. PMC 4775916 $2. PMID 26666919.
- ^ Santillana E, Beceiro A, Bou G, Romero A (March 2007). "Crystal structure of the carbapenemase OXA-24 reveals insights into the mechanism of carbapenem hydrolysis". Proceedings of the National Academy of Sciences of the United States of America. 104 (13). ss. 5354-9. Bibcode:2007PNAS..104.5354S. doi:10.1073/pnas.0607557104. PMC 1838445 $2. PMID 17374723.
- ^ Nordmann P, Cuzon G, Naas T (April 2009). "The real threat of Klebsiella pneumoniae carbapenemase-producing bacteria". The Lancet. Infectious Diseases. 9 (4). ss. 228-36. doi:10.1016/S1473-3099(09)70054-4. PMID 19324295.
- ^ Cuzon G, Naas T, Nordmann P (February 2010). "[KPC carbapenemases: what is at stake in clinical microbiology?]". Pathologie-Biologie (Fransızca). 58 (1). ss. 39-45. doi:10.1016/j.patbio.2009.07.026. PMID 19854586.
- ^ Kim JY, Jung HI, An YJ, Lee JH, Kim SJ, Jeong SH, ve diğerleri. (May 2006). "Structural basis for the extended substrate spectrum of CMY-10, a plasmid-encoded class C beta-lactamase". Molecular Microbiology. 60 (4). ss. 907-16. doi:10.1111/j.1365-2958.2006.05146.x. PMID 16677302.
- ^ Lee JH, Jung HI, Jung JH, Park JS, Ahn JB, Jeong SH, ve diğerleri. (2004). "Dissemination of transferable AmpC-type beta-lactamase (CMY-10) in a Korean hospital". Microbial Drug Resistance. 10 (3). ss. 224-30. doi:10.1089/mdr.2004.10.224. PMID 15383166.
- ^ Walsh TR, Weeks J, Livermore DM, Toleman MA (May 2011). "Dissemination of NDM-1 positive bacteria in the New Delhi environment and its implications for human health: an environmental point prevalence study". The Lancet. Infectious Diseases. 11 (5). ss. 355-62. doi:10.1016/S1473-3099(11)70059-7. PMID 21478057.
- ^ "NEW DRUG FIGHTS ILLS OF PENICILLIN; Antibiotics Expert Finds Neutrapen Effective on Injection Side Effect ALLERGY RISE STUDIED U.S. Aide Reports Increase in Reaction to Penicillin and Like Substances Severe Reactions Few Some Severe Reactions (Published 1957)". The New York Times (İngilizce). 4 Ekim 1957. ISSN 0362-4331. 31 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Aralık 2020.
- ^ Hyman AL (February 1959). "Anaphylactic shock after therapy with penicillinase". Journal of the American Medical Association. 169 (6). ss. 593-4. doi:10.1001/jama.1959.73000230003011a. PMID 13620512.
- ^ Friedlaender S (April 1959). "Penicillinase in the treatment of allergic reactions to penicillin". Journal of Allergy. 30 (2). ss. 181-7. doi:10.1016/0021-8707(59)90087-5. PMID 13630649.
- ^ American Academy of Pediatrics (1 Ekim 1958). "A New Concept in the Treatment of Penicillin Reactions: Use of Penicillinase". Pediatrics (İngilizce). 22 (4). s. 658. doi:10.1542/peds.22.4.658. ISSN 0031-4005. 28 Eylül 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Aralık 2020.
- ^ Zimmerman MC (August 1958). "Penicillinase-proved allergy to penicillin in poliomyelitis vaccine". Journal of the American Medical Association. 167 (15). ss. 1807-9. doi:10.1001/jama.1958.02990320001001. PMID 13563181.
- ^ Weiss RC, Crepea SB (July 1959). "Development of sensitivity to penicillinase following its use in penicillin reaction". Journal of Allergy. 30 (4). ss. 337-41. doi:10.1016/0021-8707(59)90041-3. PMID 13664435.
- ^ United States Congress Senate Committee on the Judiciary (1961). Drug Industry Antitrust Act: Hearings Before the Subcommittee on Antitrust and Monopoly of the Committee on the Judiciary, United States Senate, Eighty-seventh Congress, First [-second] Session, Pursuant to S. Res. 52 on S. 1552, a Bill to Amend and Supplement the Antitrust Laws, with Respect to the Manufacture and Distribution of Drugs, and for Other Purposes (İngilizce). U.S. Government Printing Office.
- ^ United States Congress Senate Committee on the Judiciary Subcommittee on Antitrust and Monopoly (1957). Administered Prices: con't] pt.25. Administered prices in the drug industry, (Antibiotics-Appendix A). 1961. pp. 14201-15329 (İngilizce). U.S. Government Printing Office.
- ^ Lindström EB, Nordström K (February 1972). "Automated method for determination of penicillins, cephalosporins, and penicillinases". Antimicrobial Agents and Chemotherapy. 1 (2). ss. 100-6. doi:10.1128/aac.1.2.100. PMC 444176 $2. PMID 4618452.
- ^ "Federal Register, Volume 62 Issue 229 (Friday, November 28, 1997)". www.govinfo.gov. 23 Ekim 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Aralık 2020.
- ^ O'Callaghan CH, Morris A, Kirby SM, Shingler AH (April 1972). "Novel method for detection of beta-lactamases by using a chromogenic cephalosporin substrate". Antimicrobial Agents and Chemotherapy. 1 (4). ss. 283-8. doi:10.1128/AAC.1.4.283. PMC 444209 $2. PMID 4208895.
- ^ Hall BG, Salipante SJ, Barlow M (July 2004). "Independent origins of subgroup Bl + B2 and subgroup B3 metallo-beta-lactamases". Journal of Molecular Evolution. 59 (1). ss. 133-41. doi:10.1007/s00239-003-2572-9. PMID 15383916.
- ^ Lee JH, Takahashi M, Jeon JH, Kang LW, Seki M, Park KS, ve diğerleri. (2019). "Dual activity of PNGM-1 pinpoints the evolutionary origin of subclass B3 metallo-β-lactamases: a molecular and evolutionary study". Emerging Microbes & Infections. 8 (1). ss. 1688-1700. doi:10.1080/22221751.2019.1692638. PMC 6882493 $2. PMID 31749408.
- ^ Berglund F, Johnning A, Larsson DG, Kristiansson E (January 2021). "An updated phylogeny of the metallo-β-lactamases". The Journal of Antimicrobial Chemotherapy. 76 (1). ss. 117-123. doi:10.1093/jac/dkaa392. PMID 33005957.
- ^ InterPro: IPR012338
- ^ Hall BG, Barlow M (September 2003). "Structure-based phylogenies of the serine beta-lactamases". Journal of Molecular Evolution. 57 (3). ss. 255-60. doi:10.1007/s00239-003-2473-y. PMID 14629035.
- ^ Hall BG, Barlow M (April 2004). "Evolution of the serine beta-lactamases: past, present and future". Drug Resistance Updates. 7 (2). ss. 111-23. doi:10.1016/j.drup.2004.02.003. PMID 15158767.
- ^ Barlow M, Hall BG (September 2002). "Phylogenetic analysis shows that the OXA beta-lactamase genes have been on plasmids for millions of years". Journal of Molecular Evolution. 55 (3). ss. 314-21. Bibcode:2002JMolE..55..314B. doi:10.1007/s00239-002-2328-y. PMID 12187384.
- ^ "Etymologia: β-Lactamase". Emerging Infectious Diseases. 22 (9). 2016. ss. 1689-1631. doi:10.3201/eid2209.ET2209. PMC 4994330 $2.
Konuyla ilgili yayınlar[değiştir | kaynağı değiştir]
- Sawa T, Kooguchi K, Moriyama K (December 2020). "Molecular diversity of extended-spectrum β-lactamases and carbapenemases, and antimicrobial resistance". Journal of Intensive Care. 8 (1). s. 13. doi:10.1186/s40560-020-0429-6. PMC 6988205 $2. PMID 32015881.
- Philippon A, Slama P, Dény P, Labia R (January 2016). "A Structure-Based Classification of Class A β-Lactamases, a Broadly Diverse Family of Enzymes". Clinical Microbiology Reviews. 29 (1). ss. 29-57. doi:10.1128/CMR.00019-15. PMC 4771212 $2. PMID 26511485.
- Yoon EJ, Jeong SH (March 2021). "Class D β-lactamases". The Journal of Antimicrobial Chemotherapy. 76 (4). ss. 836-864. doi:10.1093/jac/dkaa513. PMID 33382875.
Dış bağlantılar[değiştir | kaynağı değiştir]
- Beta-laktamaz veritabanı (İngilizce)
- Medical Subject Headings beta-Lactamases (İngilizce)
