Beta-laktam
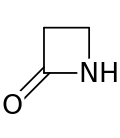
Bir beta-laktam (β-laktam) halkası dört üyeli bir laktamdır.[1] Bir laktam siklik bir amiddir ve beta-laktamlar, azot atomunun karbonile göre β-karbon atomuna bağlı olması nedeniyle bu şekilde adlandırılır. Mümkün olan en basit β-laktam 2-azetidinon'dur. β-laktamlar, birçok β-laktam antibiyotikte görüldüğü gibi ilaçların önemli yapısal birimleridir.[2] 1970'e kadar β-laktam araştırmalarının çoğu penisilin ve sefalosporin gruplarıyla ilgiliydi, ancak o zamandan beri çok çeşitli yapılar tanımlanmıştır.[3][4]
Klinik önem[değiştir | kaynağı değiştir]

β-laktam halkası, başlıcaları penisilinler, sefalosporinler, karbapenemler ve monobaktamlar olmak üzere çeşitli antibiyotik ailelerinin çekirdek yapısının bir parçasıdır ve bu nedenle β-laktam antibiyotikler olarak da adlandırılırlar. Bu antibiyotiklerin neredeyse tamamı bakteriyel hücre duvarı biyosentezini inhibe ederek çalışır. Bunun bakteriler üzerinde öldürücü bir etkisi vardır, ancak herhangi bir bakteri popülasyonu tipik olarak β-laktam antibiyotiklere dirençli bir alt grup içerecektir. Bakteriyel direnç, β-laktam halkasını kıran bir enzim sınıfı olan β-laktamazların üretimi için birçok genden birinin ekspresyonunun bir sonucu olarak ortaya çıkar.[5]
Çeşitli bakteri türlerinde 1.800'den fazla farklı β-laktamaz enzimi belgelenmiştir.[6] Bu enzimler kimyasal yapıları ve katalitik etkinlikleri bakımından büyük farklılıklar göstermektedir. Bakteri popülasyonları bu dirençli alt gruplara sahip olduğunda, β-laktam ile tedavi, dirençli suşun daha yaygın ve dolayısıyla daha virülan hale gelmesine neden olabilir. β-laktam türevi antibiyotikler, en önemli antibiyotik sınıflarından biri olarak kabul edilebilir ancak klinik dirence yatkındır. β-laktam antibiyotik özelliklerini, penisilin bağlayıcı proteinler (PBP) olarak bilinen ve bakterilerin hücre duvarının peptidoglikan kısmını çapraz bağlama işlevine sahip bir grup enzim için doğal olarak oluşan d-Ala-d-Ala substratını taklit ederek gösterir.[7]
β-laktam halkası, kolesterol emilim inhibitörü ilaç Ezetimib gibi diğer bazı ilaçlarda da bulunur.
Sentez[değiştir | kaynağı değiştir]
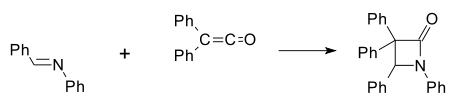
İlk sentetik β-laktam 1907 yılında Hermann Staudinger tarafından anilin ve benzaldehitin Schiff bazının difenilketen ile [2+2] siklokatılma reaksiyonu sonucu hazırlanmıştır[8][9] (Ph fenil fonksiyonel grubunu gösterir):
β-laktamların sentezi için birçok yöntem geliştirilmiştir.[8][10][11]
Breckpot β-laktam sentezi,[12] bir Grignard reaktifi kullanılarak beta amino asit esterlerinin siklizasyonu yoluyla sübstitüe β-laktamlar üretir.[13] Mukaiyama reaktifi modifiye Breckpot sentezinde de kullanılır.[12]
Tepkimeler[değiştir | kaynağı değiştir]
Halka gerginliği nedeniyle, β-laktamlar doğrusal amidlere veya daha büyük laktamlara göre daha kolay hidrolize olur. Bu zorlanma, çoğu β-laktam antibiyotikte bulunduğu gibi, ikinci bir halkaya füzyonla daha da artar. Bu eğilim, β-laktamın amid karakterinin sistemin aplanaritesi tarafından azaltılmasından kaynaklanmaktadır. İdeal bir amidin azot atomu rezonans nedeniyle sp2-hibritleşmiştir ve sp2-hibritleşmiş atomlar trigonal düzlemsel bağ geometrisine sahiptir. Piramidal bir bağ geometrisi, halka gerilmesi tarafından azot atomuna zorlandıkça, amid bağının rezonansı azalır ve karbonil daha keton benzeri hale gelir.
Nobel ödüllü Robert Burns Woodward, azot (tepe noktası olarak) ve üç komşu atomu tarafından tanımlanan trigonal piramidin yüksekliğinin bir ölçüsü olarak bir h parametresi tanımlamıştır. h, β-laktam bağının gücüne karşılık gelir ve daha düşük sayılar (daha düzlemsel; daha ideal amidler gibi) daha güçlü ve daha az reaktiftir.[14] Monobaktamlar 0,05 ile 0,10 angstrom (Å) arasında h değerlerine sahiptir. Cephemler 0.20-0.25 Å arasında h değerlerine sahiptir. Penamlar 0.40-0.50 Å aralığında değerlere sahipken, karbapenemler ve klavamlar 0.50-0.60 Å değerlerine sahiptir ve β-laktamların hidrolize karşı en reaktif olanlarıdır.[15]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Gilchrist T (1987). Heterocyclic Chemistry. Harlow: Longman Scientific. ISBN 978-0-582-01421-3.
- ^ Fisher, J. F.; Meroueh, S. O.; Mobashery, S. (2005). "Bacterial resistance to β-lactam antibiotics: compelling opportunism, compelling opportunity". Chemical Reviews. 105 (2). ss. 395-424. doi:10.1021/cr030102i. PMID 15700950.
- ^ Flynn EH (1972). Cephalosporins and Penicillins : Chemistry and Biology. New York and London: Academic Press.
- ^ Hosseyni S, Jarrahpour A (October 2018). "Recent advances in β-lactam synthesis". Organic & Biomolecular Chemistry. 16 (38). ss. 6840-6852. doi:10.1039/c8ob01833b. PMID 30209477.
- ^ Brandt C, Braun SD, Stein C, Slickers P, Ehricht R, Pletz MW, Makarewicz O (February 2017). "In silico serine β-lactamases analysis reveals a huge potential resistome in environmental and pathogenic species". Scientific Reports. Cilt 7. s. 43232. Bibcode:2017NatSR...743232B. doi:10.1038/srep43232. PMC 5324141 $2. PMID 28233789.
- ^ Ehmann DE, Jahić H, Ross PL, Gu RF, Hu J, Kern G, Walkup GK, Fisher SL (July 2012). "Avibactam is a covalent, reversible, non-β-lactam β-lactamase inhibitor". Proceedings of the National Academy of Sciences of the United States of America. 109 (29). ss. 11663-8. Bibcode:2012PNAS..10911663E. doi:10.1073/pnas.1205073109. PMC 3406822 $2. PMID 22753474.
- ^ Tipper DJ, Strominger JL (October 1965). "Mechanism of action of penicillins: a proposal based on their structural similarity to acyl-D-alanyl-D-alanine". Proceedings of the National Academy of Sciences of the United States of America. 54 (4). ss. 1133-41. Bibcode:1965PNAS...54.1133T. doi:10.1073/pnas.54.4.1133. PMC 219812 $2. PMID 5219821.
- ^ a b Alcaide, Benito; Almendros, Pedro; Aragoncillo, Cristina (2007). "Β-Lactams: Versatile Building Blocks for the Stereoselective Synthesis of Non-β-Lactam Products". Chemical Reviews. 107 (11). ss. 4437-4492. doi:10.1021/cr0307300. PMID 17649981.
- ^ Staudinger H (1907). "Zur Kenntniss der Ketene. Diphenylketen". Justus Liebigs Ann. Chem. 356 (1–2). ss. 51-123. doi:10.1002/jlac.19073560106. 2 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Haziran 2019.
- ^ Hosseyni, Seyedmorteza; Jarrahpour, Aliasghar (2018). "Recent advances in β-lactam synthesis". Organic & Biomolecular Chemistry (İngilizce). 16 (38). ss. 6840-6852. doi:10.1039/C8OB01833B. ISSN 1477-0520. PMID 30209477. 18 Ocak 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Ocak 2024.
- ^ Pitts, Cody Ross; Lectka, Thomas (27 Ağustos 2014). "Chemical Synthesis of β-Lactams: Asymmetric Catalysis and Other Recent Advances". Chemical Reviews (İngilizce). 114 (16). ss. 7930-7953. doi:10.1021/cr4005549. ISSN 0009-2665. PMID 24555548. 21 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Aralık 2020.
- ^ a b "Breckpot β-Lactam Synthesis", Comprehensive Organic Name Reactions and Reagents (İngilizce), Hoboken, NJ, USA: John Wiley & Sons, Inc., ss. conrr115, 15 Eylül 2010, doi:10.1002/9780470638859.conrr115, ISBN 978-0-470-63885-9, 16 Ocak 2024 tarihinde kaynağından arşivlendi, erişim tarihi: 4 Şubat 2021
- ^ Bogdanov B, Zdravkovski Z, Hristovski K. "Breckpot Synthesis". Institute of Chemistry Skopje. 6 Kasım 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Aralık 2014.
- ^ Woodward RB (May 1980). "Penems and related substances". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 289 (1036). ss. 239-50. Bibcode:1980RSPTB.289..239W. doi:10.1098/rstb.1980.0042. PMID 6109320.
- ^ Nangia A, Biradha K, Desiraju GR (1996). "Correlation of biological activity in β-lactam antibiotics with Woodward and Cohen structural parameters: A Cambridge database study". J. Chem. Soc. Perkin Trans. 2 (5). ss. 943-53. doi:10.1039/p29960000943.
Dış bağlantılar[değiştir | kaynağı değiştir]
- β-laktamların sentezi (İngilizce)