Fenoller
Organik kimya'da, fenoller ya da fenolikler, hidroksil grubunun (- O H ) doğrudan bir aromatik hidrokarbon grubuna bağlı olduğu bir grup kimyasal bileşiklerdir. Sınıfın en basiti fenoldür, C6H5OH. Fenolik bileşikler, moleküldeki fenol ünitelerinin sayısına bağlı olarak basit fenoller veya polifenoller olarak sınıflandırılır.
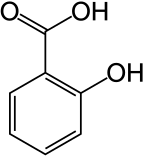
Fenoller endüstriyel olduğu kadar doğal olarak da sentezlenir.[1]
Özellikleri
Asidite
Fenollerin kendine has özellikleri vardır ve genel olarak diğer alkollerden ayırt edilirler. Asitlikleri daha yüksektir . Fenollerin hidroksil grubunun asitliği yaygın olarak alifatik alkoller ve karboksilik asitler arasında değişir (bunların pKa değeri genellikle 10 ve 12 arasındadır). Bir fenolün hidroksil grubundan bir hidrojen katyonunun (H + ) kaybı, karşılık gelen bir negatif fenolat iyonu veya fenoksit iyonu oluşturur ve karşılık gelen tuzlara fenolatlar veya fenoksitler adı verilir, bununla birlikte ariloksitler terimi IUPAC Gold Book'a göre tercih edilir. Fenoller, aynı molekül içindeki aromatik halkalara bağlanmış iki veya daha fazla hidroksil grubuna sahip olabilir. En basit örnekler, her biri bir benzen halkası üzerinde iki hidroksi grubuna sahip olan üç benzendiollerdir .
Oksidasyon
Fenoller oksidasyona karşı reaktif türlerdir. Oksidatif bölünme, örneğin 1,2-dihidroksibenzen'in 2,4 heksadiendioik asidin monomeresterine piridin içindeki bakır klorür ile oksijenle bölünmesi,[2]
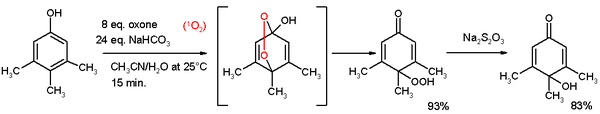
- Kinonlara oksidatif de-aromatizasyonu Teuber reaksiyonu olarak da bilinir. Oksitleyici reaktifler Fremy'nin tuzu[3] ve oksondur.[4] 3,4,5-trimetilfenol, aşağıda gösterilen reaksiyonda, bir asetonitril / su karışımında okson / sodyum karbonattan üretilen singlet oksijeniyle para-peroksikinole reaksiyona girer. Bu hidroperoksit, sodyum tiyosülfat ile kinole indirgenir.
Elektrofilik aromatik yer değiştirme
Fenoller, Elektrofilik aromatik yer değiştirmelere karşı oldukça hassastır. Büyük ölçekli bir elektrofilik aromatik yer değiştirmen örneği, bisfenol A'nın üretimidir, 1 milyon ton ölçeğinde üretilir. Bu bileşik, asetonun yoğunlaştırılması ile sentezlenir.[5]
Diğer reaksiyonlar
Fenoller esterifikasyona uğrarlar. Fenol esterleri aktif esterlerdir ve hidrolize eğilimlidirler.
Bucherer karbazol sentezinde naftol ve hidrazinlerin ve sodyum bisülfitin reaksiyonu.
Sentezi
Fenollerin sentezi için çeşitli laboratuvar yöntemleri:
- Fries düzenlemesinde bir ester yeniden düzenlemesi ile
- Bamberger düzenlemesinde N-fenilhidroksilaminlerin yeniden düzenlenmesi ile
- Fenolik eterlerin dealkilasyonu yoluyla
- Kinonların indirgenmesi ile
- Bucherer tepkimesinde bir aromatik aminin bir hidroksil grubu ile su ve sodyum bisülfit ile değiştirilmesi
- Diazonyum tuzlarının hidrolizi ile, bakınız: Diazonyum tuzunun fenole dönüşümü
- Formaldehit + baz ile katalize edilmiş epiklohidrinin epoksi reçine bileşenlerine oligomerizasyonu ile
- Aseton / ketonlarla reaksiyonu ile örneğin reçineler için önemli bir monomer olan Bisfenol A , örneğin polikarbonat (PC), epoksi reçineleri
- Aril silanların oksidasyonu ile - Fleming-Tamao oksidasyonunun aromatik bir varyasyonu[6]
- Benzen ve propenin H3PO4 içerisinde ilavesiyle kümen oluşturmak üzere, sonrasında H2SO4 ile O2 fenol oluşturmak üzere eklenir (Hock işlemi).
Sınıflandırma
Çeşitli sınıflandırma şemaları vardır.[7] Yaygın olarak kullanılan bir şema karbon sayısına dayanır. Jeffrey Harborne ve Simmonds tarafından 1964'te geliştirilmiş ve 1980'de yayınlanmıştır:[7][8]

| Fenol | dezenfektan olarak ve kimyasal sentez için kullanılan ana bileşik |
| Bisfenol A | ve ketonlardan ve fenol / kresolden üretilen diğer bisfenoller |
| BHT | (bütillenmiş hidroksitolüen) - yağda çözünen bir antioksidan ve gıda katkı maddesi |
| 4-Nonilfenol | Deterjanların ve nonoksinol-9'un bir bozulma ürünü |
| Ortofenil fenol | turunçgillerin cilalanmasında kullanılan bir mantar ilacı |
| Pikrik asit | (trinitrofenol) - patlayıcı madde |
| Fenolftalein | pH göstergesi |
| Ksilenol | antiseptik ve dezenfektanlarda kullanılır |
İlaçlar, şimdi ve geçmişte
| Dietilstilbestrol | stilben yapılı sentetik bir östrojen; artık pazarlanmıyor |
| L-DOPA | Parkinson Hastalığını tedavi etmek için kullanılan bir dopamin ön ilacı |
| propofol | kısa etkili intravenöz anestezik ajan |

Bu bileşiklerin çoğunluğu çözülebilir moleküllerdir, ancak daha küçük moleküller uçucu olabilir. [kaynak belirtilmeli]
Fenoller diğer birçok madde ile kimyasal olarak etkileşime girer. [kaynak belirtilmeli] Aromatikliğe sahip moleküllerin kimyasal bir özelliği olan istifleme , fenolik moleküller arasında meydana gelir. [kaynak belirtilmeli] Kütle spektrometresi ile çalışırken, fenoller kolayca halojen içeren ek iyonlar oluşturur. [kaynak belirtilmeli] Yiyecek matrisleriyle veya farklı silika formlarıyla etkileşime girebilirler (mesoporoz silika, dumanlı silika [9] veya silika bazlı sol jeller [10]).
Kaynakça
- ^ Hättenschwiler, Stephan; Vitousek, Peter M. (2000). "The role of polyphenols in terrestrial ecosystem nutrient cycling". Trends in Ecology & Evolution. 15 (6): 238–243. doi:10.1016/S0169-5347(00)01861-9.
- ^ 2,4-Hexadienedioic acid, monomethyl ester, (Z,Z)- Organic Syntheses, Coll. Vol. 8, p.490 (1993); Vol. 66, p.180 (1988).
- ^ "2,5-Cyclohexadiene-1,4-dione, 2,3,5-trimethyl". Organic Syntheses, Coll. 6: 1010. 1988.; Vol. 52, p.83 (1972).
- ^ Carreño, M. Carmen; González-López, Marcos; Urbano, Antonio (2006). "Oxidative De-aromatization of para-Alkyl Phenols into para-Peroxyquinols and para-Quinols Mediated by Oxone as a Source of Singlet Oxygen". Angewandte Chemie International Edition. 45 (17): 2737–2741. doi:10.1002/anie.200504605. PMID 16548026
- ^ Fiege H; Voges H-W; Hamamoto T; Umemura S; Iwata T; Miki H; Fujita Y; Buysch H-J; Garbe D; Paulus W (2000). "Phenol Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_313. ISBN 978-3527306732.
- ^ Bracegirdle, Sonia; Anderson, Edward A. (2010). "Arylsilane oxidation—new routes to hydroxylated aromatics". Chem. Comm. 46(20): 3454–6. doi:10.1039/b924135c. PMID 20582346
- ^ a b Wilfred Vermerris and Ralph Nicholson. Phenolic Compound Biochemistry Springer, 2008
- ^ Harborne, J. B. (1980). "Plant phenolics". In Bell, E. A.; Charlwood, B. V. (eds.). Encyclopedia of Plant Physiology, volume 8 Secondary Plant Products. Berlin Heidelberg New York: Springer-Verlag. pp. 329–395.
- ^ Kulik, T. V.; Lipkovska, N. A.; Barvinchenko, V. N.; Palyanytsya, B. B.; Kazakova, O. A.; Dovbiy, O. A.; Pogorelyi, V. K. (2009). "Interactions between bioactive ferulic acid and fumed silica by UV–vis spectroscopy, FT-IR, TPD MS investigation and quantum chemical methods". Journal of Colloid and Interface Science. 339 (1): 60–8. Bibcode:2009JCIS..339...60K. doi:10.1016/j.jcis.2009.07.055. PMID 19691966.
- ^ Lacatusu, Ioana; Badea, Nicoleta; Nita, Rodica; Murariu, Alina; Miculescu, Florin; Iosub, Ion; Meghea, Aurelia (2010). "Encapsulation of fluorescence vegetable extracts within a templated sol–gel matrix". Optical Materials. 32 (6): 711–718. Bibcode:2010OptMa..32..711L. doi:10.1016/j.optmat.2009.09.001.