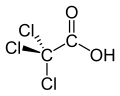
Trikloroasetik asit
| |||

| |||
| Tanımlayıcılar | |||
|---|---|---|---|
3D model (JSmol)
|
|||
| 970119 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.844 | ||
| 2842 | |||
| KEGG | |||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Kimyasal formül | C2HCl3O2 | ||
| Molekül kütlesi | 163,39 g mol−1 | ||
| Görünüm | Beyaza çalan renksiz kristal katı | ||
| Koku | Keskin[1] | ||
| Yoğunluk | 1,63 g/cm3 | ||
| Erime noktası | 57-58 °C (135-136 °F; 330-331 K)[2] | ||
| Kaynama noktası | 196-197 °C (385-387 °F; 469-470 K)[2] | ||
| Çözünürlük (su içinde) | 1000 g/100 mL[2] | ||
| Buhar basıncı | 1 mmHg (51.1 °C)[1] | ||
| Asitlik (pKa) | 0.66[3] | ||
| −73.0·10−6 cm3/mol | |||
| Yapı | |||
| Dipol momenti | 3.23 D | ||
| Tehlikeler | |||
| GHS etiketleme sistemi: | |||
| Piktogramlar |  
| ||
| İşaret sözcüğü | Danger | ||
| Tehlike ifadeleri | H314, H410 | ||
| Önlem ifadeleri | P260, P264, P273, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P391, P405, P501 | ||
| NFPA 704 (yangın karosu) |
|||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
5000 mg/kg orally in rats[2] | ||
| NIOSH ABD maruz kalma limitleri: | |||
| PEL (izin verilen) | Yok[1] | ||
| REL (tavsiye edilen) | TWA 1 ppm (7 mg/m3)[1] | ||
| IDLH (anında tehlike) | N.D.[1] | ||
| Benzeyen bileşikler | |||
Benzeyen kloroasetik asitler
|
Kloroasetik asit Dikloroasetik asit | ||
Benzeyen bileşikler
|
Asetik asit Trifloroasetik asit Tribromoasetik asit | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
| Bilgi kutusu kaynakları | |||
Trikloroasetik asit (TCA; TCAA; aynı zamanda trikloroetanoik asit olarak da bilinir), metil grubundaki üç hidrojen atomunun tamamının klor atomları ile değiştirildiği bir asetik asit analoğudur. Trikloroasetik asitin tuzları ve esterlerine trikloroasetatlar denir.
Üretim[değiştir | kaynağı değiştir]
Trikloroasetik asit, 1830'da Jean-Baptiste Dumas tarafından keşfedildi.[4]
Kırmızı fosfor gibi uygun bir katalizör varlığında klorun asetik asitle reaksiyonuyla hazırlanır. Bu reaksiyon Hell-Volhard-Zelinsky halojenasyonudur.
- CH3COOH + 3 Cl2 → CCl3COOH + 3 HCl
Trikloroasetik asit elde etmenin bir başka yolu da trikloroasetaldehitin oksidasyonudur.
Kullanımları[değiştir | kaynağı değiştir]
Proteinler, DNA ve RNA gibi makromoleküllerin çökeltilmesi için biyokimyada yaygın olarak kullanılır. TCA ve DCA'nın her ikisi de kozmetik tedavilerde (kimyasal peeling ve dövme silme gibi) ve genital siğiller de dâhil olmak üzere siğillerin kemoablasyonu için topikal ilaç olarak kullanılır. Normal hücreleri de öldürebilir. Hamilelik sırasında bu amaçla kullanılması güvenli kabul edilir.[5][6]
Sodyum tuzu (sodyum trikloroasetat) 1950'li yıllardan itibaren herbisit olarak kullanıldı ancak 1980'lerin sonlarında ve 1990'ların başlarında piyasadan kaldırıldı.[7][8][9][10]
Kaynakça[değiştir | kaynağı değiştir]
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards #0626 19 Aralık 2017 tarihinde Wayback Machine sitesinde arşivlendi. National Institute for Occupational Safety and Health (NIOSH)
- ^ a b c d Şablon:Merck12th
- ^ Databog fysik kemi, F&K Forlaget 11. udgave 2009
- ^ Terchloracetic Acid in Gmelin, L., Hand-book of Chemistry: Organic chemistry
- ^ Jones, Kirtly (21 Haziran 2012). Marshall, Sarah (Ed.). "Trichloroacetic Acid or Bichloroacetic Acid for Genital Warts (Human Papillomavirus)". WebMD. HealthWise. 16 Temmuz 2015 tarihinde kaynağından arşivlendi.
- ^ Wiley DJ, Douglas J, Beutner K, Cox T, Fife K, Moscicki AB, Fukumoto L (2002). "External genital warts: Diagnosis, treatment, and prevention". Clinical Infectious Diseases. 35 (Suppl 2). ss. S210-S224. doi:10.1086/342109. PMID 12353208.
- ^ Şablon:PPDB, accessed June 20, 2014
- ^ G. S. Rai and C. L. Hamner. "Persistence of Sodium Trichloroacetate in Different Soil Types." Weeds 2(4) Oct. 1953: 271-279. JSTOR 4040104 20 Temmuz 2020 tarihinde Wayback Machine sitesinde arşivlendi.. DOI 10.2307/4040104.
- ^ United Nations Environment Programme. "Trichloroacetic Acid CAS N°: 76-03-9" (OECD SIDS). Accessed June 20, 2014. Archived from the original on 15 August 2018.
- ^ Heier, Al (December 1991). "Trichloroacetic Acid (TCA)". EPA. Accessed June 20, 2014 — via Cornell PMEP Pesticide Active Ingredient Information database. Archived from the original on 15 Aug 2020.