Βeta-laktamaz inhibitörü
Beta-laktamazlar, beta-laktam antibiyotiklere karşı bakteriyel dirençte rol oynayan bir enzim ailesidir. Beta-laktam antibiyotiklere karşı bakteriyel dirençte, bakteriler beta-laktam halkalarını bozarak antibiyotiği etkisiz hale getiren beta-laktamazlara sahiptir. Ancak beta-laktamaz inhibitörleri ile bakteri üzerindeki bu enzimler inhibe edilerek antibiyotiğin etki göstermesi sağlanır. Bu direnç biçimiyle mücadele stratejileri, bölünmeye karşı daha dirençli yeni beta-laktam antibiyotiklerin geliştirilmesini ve beta-laktamaz inhibitörleri olarak adlandırılan enzim inhibitörleri sınıfının geliştirilmesini içermektedir.[1] β-laktamaz inhibitörlerinin kendi başlarına çok az antibiyotik aktivitesi olmasına rağmen,[2] beta-laktam antibiyotiklerin bakteriyel bozulmasını önlerler ve böylece ilaçların etkili olduğu bakteri yelpazesini genişletirler.
Tıbbi kullanımlar[değiştir | kaynağı değiştir]
Beta-laktamaz inhibitörlerinin en önemli kullanım alanı, gram-negatif bakterilerin neden olduğu bilinen veya inanılan enfeksiyonların tedavisidir, çünkü beta-laktamaz üretimi bu patojenlerde beta-laktam direncine önemli bir katkıda bulunur. Buna karşılık, gram-pozitif bakterilerdeki beta-laktam direncinin çoğu, penisilin bağlayıcı proteinlerde beta-laktama daha az bağlanmaya yol açan varyasyonlardan kaynaklanmaktadır.[3][4] Gram-pozitif patojen Staphylococcus aureus beta-laktamaz üretir, ancak beta-laktamaz inhibitörleri bu enfeksiyonların tedavisinde daha az rol oynar çünkü en dirençli suşlar (metisiline dirençli Staphylococcus aureus) da penisilin bağlayıcı proteinlerin varyantlarını kullanır.[5][6]
Etki mekanizması[değiştir | kaynağı değiştir]
Ambler sınıflandırma sistemi, bilinen beta-laktamaz enzimlerini sekans homolojisine ve varsayılan filogenetik ilişkilere göre dört grupta toplamaktadır. A, C ve D sınıfları beta-laktamları serin proteazların mekanizmasına benzer çok adımlı bir mekanizma ile parçalar. Bağlanma üzerine, beta-laktamaz aktif bölgesindeki bir serin hidroksil grubu beta-laktam halkası karbonil grubuna geçici bir kovalent bağ oluşturur ve bu süreçte beta-laktam halkasını parçalar. İkinci bir adımda, bir su molekülünün nükleofilik saldırısı, enzim ile eski beta-laktamın karbonil grubu arasındaki kovalent bağı koparır. Bu, bozunmuş beta-laktamın uzaklaşmasını sağlar ve enzimi ilave beta-laktam moleküllerini işlemek üzere serbest bırakır.[kaynak belirtilmeli]
Şu anda mevcut olan beta-laktamaz inhibitörleri Ambler Sınıf A beta-laktamazlara (tazobaktam, klavulanat ve sulbaktam) veya Ambler Sınıf A, C ve bazı Sınıf D beta-laktamazlara (avibaktam) karşı etkilidir. Beta-laktam antibiyotikler gibi, başlangıçta kovalent bir ara ürün oluşturmak üzere beta-laktamazlar tarafından işlenirler. Beta-laktam antibiyotiklerin aksine, inhibitörler intihar substratları olarak hareket eder (tazobaktam ve sulbaktam) ve bu da sonuçta beta-laktamazın bozulmasına yol açar.[7] Öte yandan avibaktam bir beta-laktam halkası içermez (beta-laktam olmayan beta-laktamaz inhibitörü) ve bunun yerine geri dönüşümlü olarak bağlanır.[8][9]
Ambler Sınıf B beta-laktamazlar, beta-laktamları metaloproteazlarınkine benzer bir mekanizma ile parçalar. Kovalent ara ürün oluşmadığından, piyasada satılan beta-laktamaz inhibitörlerinin etki mekanizması geçerli değildir. Bu nedenle, Yeni Delhi metallo-beta-laktamaz 1 gibi metallo beta-laktamazları ifade eden bakteri suşlarının yayılması büyük endişe yaratmıştır.[10]
Yaygın olarak kullanılan ajanlar[değiştir | kaynağı değiştir]
Şu anda pazarlanan β-laktamaz inhibitörleri tek başına ilaç olarak satılmamaktadır. Bunun yerine benzer serum yarılanma ömrüne sahip bir β-laktam antibiyotik ile birlikte formüle edilmektedirler. Bu sadece dozaj kolaylığı için değil, aynı zamanda bir veya diğer ilaca değişen maruziyetin bir sonucu olarak ortaya çıkabilecek direnç gelişimini en aza indirmek için yapılır. Gram-negatif bakteriyel enfeksiyonları tedavi etmek için kullanılan β-laktam antibiyotiklerin ana sınıfları (β-laktamazlar tarafından parçalanmaya karşı içsel direncin yaklaşık sırasına göre) penisilinler (özellikle aminopenisilinler ve üreidopenisilinler), 3. nesil sefalosporinler ve karbapenemleri içerir. Bireysel β-laktamaz varyantları bu ilaç sınıflarından birini veya birçoğunu hedefleyebilir ve belirli bir β-laktamaz inhibitörü tarafından yalnızca bir alt küme inhibe edilecektir.[9] β-laktamaz inhibitörleri, bakteriler tarafından üretilen β-laktamaz enzimlerini inhibe ederek bu β-laktam antibiyotiklerin kullanım spektrumunu genişletir ve onları etkisiz hale getirir.[11]
- β-laktam çekirdekli β-laktamaz inhibitörleri:
- Tebipenem, tebipenem-pivoksil formunda oral yoldan uygulanan ilk karbapenemdir. Tebipenemin M. tuberculosis beta-laktamaz (BlaC) ile yapısal ve kinetik çalışmaları mevcuttur.[12]
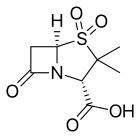
- Klavulanik asit veya klavulanat, genellikle amoksisilin (Augmentin) veya tikarsilin (Timentin) ile birlikte
- Sulbaktam, genellikle ampisilin (Unasyn) veya sefoperazon (Sulperazon) ile birlikte
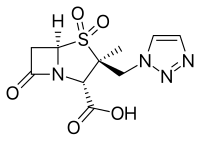
- Tazobaktam, genellikle piperasilin ile kombine (Zosyn, Tazocin)
- Diazabisiklooktan çekirdekli β-laktamaz inhibitörleri:
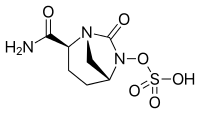
- Avibaktam, seftazidim (Avycaz, Zavicefta) ile kombinasyon halinde onaylanmıştır, şu anda seftarolin ile kombinasyon için klinik çalışmalar devam etmektedir
- Acinetobacter baumannii-calcoaceticus kompleksinin neden olduğu hastane kaynaklı bakteriyel pnömoni ve ventilatör ilişkili bakteriyel pnömoni (HABP/VABP) pnömonisini tedavi etmek için sulbaktam (Xacduro) ile birlikte onaylanan durlobaktam
- Relebaktam, imipenem/silastatin (Recarbrio) ile birlikte kullanılır.[13][14]
- β-laktam olmayan diğer çekirdek türlerine sahip β-laktamaz inhibitörleri:
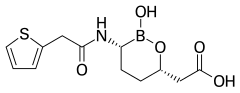
- Vaborbaktam, meropenem (Vabomere) ile birlikte kullanılır. Boronik asit çekirdeğine sahiptir.[15]
Beta-laktamaz üreten bakteriler[değiştir | kaynağı değiştir]
Beta-laktamaz üretebilen bakteriler, bunlarla sınırlı olmamak üzere, şunları içerir:
- Staphylococcus
- MRSA (Metisiline dirençli Staphylococcus aureus)
- Enterobacteriaceae:
- Klebsiella pneumoniae
- Citrobacter
- Proteus vulgaris
- Morganella
- Salmonella
- Shigella
- Escherichia coli
- Haemophilus influenzae
- Moraxella catarrhalis
- Neisseria gonorrhoeae
- Pseudomonas aeruginosa
- Mycobacterium tuberculosis
Araştırma[değiştir | kaynağı değiştir]
Bazı bakteriler, enfeksiyonun tedavisini zorlaştıran ve penisilinlere, sefalosporinlere ve monobaktamlara karşı ek direnç kazandıran geniş spektrumlu β-laktamazlar (GSBL'ler) üretebilir.[16] Boronik asit türevleri şu anda beta-laktamazlar için yeni aktif bölge inhibitörleri olarak geniş ve kapsamlı araştırmalar altındadır çünkü beta-laktamların beta-laktamazlar yoluyla hidrolize uğrarken geçtiği geçiş durumunu taklit eden bir bölge içerirler.
Genel olarak birçok beta-laktamazın aktif bölgesine iyi uyum sağladıkları ve hidrolize edilememe ve dolayısıyla işe yaramaz hale getirilme gibi uygun bir özelliğe sahip oldukları bulunmuştur. Bu, klinik olarak kullanılan birçok rakip ajana göre avantajlı bir ilaç tasarımıdır, çünkü klavulanik asit gibi bunların çoğu hidrolize olur ve bu nedenle sadece sınırlı bir süre için yararlıdır. Bu durum genellikle hidrolize uğramayan bir inhibitörde gerekli olandan daha yüksek konsantrasyonda rekabetçi inhibitör ihtiyacına neden olmaktadır.
Farklı boronik asit türevleri, beta-laktamazların birçok farklı izoformuna göre uyarlanabilme potansiyeline sahiptir ve bu nedenle beta-laktam antibiyotiklerin gücünü yeniden tesis etme potansiyeline sahiptir.[17]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Essack SY (October 2001). "The development of beta-lactam antibiotics in response to the evolution of beta-lactamases". Pharmaceutical Research. 18 (10). ss. 1391-9. doi:10.1023/a:1012272403776. PMID 11697463.
- ^ "Beta-Lactamase Inhibitors". Department of Nursing of the Fort Hays State University College of Health and Life Sciences. October 2000. 27 Eylül 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Ağustos 2007.
- ^ Georgopapadakou NH (October 1993). "Penicillin-binding proteins and bacterial resistance to beta-lactams". Antimicrobial Agents and Chemotherapy. 37 (10). ss. 2045-53. doi:10.1128/aac.37.10.2045. PMC 192226 $2. PMID 8257121.
- ^ Zapun A, Contreras-Martel C, Vernet T (March 2008). "Penicillin-binding proteins and beta-lactam resistance". FEMS Microbiology Reviews. 32 (2). ss. 361-85. doi:10.1111/j.1574-6976.2007.00095.x. PMID 18248419.
- ^ Curello J, MacDougall C (July 2014). "Beyond Susceptible and Resistant, Part II: Treatment of Infections Due to Gram-Negative Organisms Producing Extended-Spectrum β-Lactamases". The Journal of Pediatric Pharmacology and Therapeutics. 19 (3). ss. 156-64. doi:10.5863/1551-6776-19.3.156. PMC 4187532 $2. PMID 25309145.
- ^ Wolter DJ, Lister PD (2013). "Mechanisms of β-lactam resistance among Pseudomonas aeruginosa". Current Pharmaceutical Design. 19 (2). ss. 209-22. doi:10.2174/13816128130203. PMID 22894618.
- ^ Patrick, Graham L. (2017). An introduction to medicinal chemistry. 6th. Oxford, United Kingdom. ISBN 9780198749691. OCLC 987051883.
- ^ Lahiri SD, Mangani S, Durand-Reville T, Benvenuti M, De Luca F, Sanyal G, Docquier JD (June 2013). "Structural insight into potent broad-spectrum inhibition with reversible recyclization mechanism: avibactam in complex with CTX-M-15 and Pseudomonas aeruginosa AmpC β-lactamases". Antimicrobial Agents and Chemotherapy. 57 (6). ss. 2496-505. doi:10.1128/AAC.02247-12. PMC 3716117 $2. PMID 23439634.
- ^ a b Drawz SM, Bonomo RA (January 2010). "Three decades of beta-lactamase inhibitors". Clinical Microbiology Reviews. 23 (1). ss. 160-201. doi:10.1128/CMR.00037-09. PMC 2806661 $2. PMID 20065329.
- ^ Biedenbach D, Bouchillon S, Hackel M, Hoban D, Kazmierczak K, Hawser S, Badal R (February 2015). "Dissemination of NDM metallo-β-lactamase genes among clinical isolates of Enterobacteriaceae collected during the SMART global surveillance study from 2008 to 2012". Antimicrobial Agents and Chemotherapy. 59 (2). ss. 826-30. doi:10.1128/AAC.03938-14. PMC 4335866 $2. PMID 25403666.
- ^ Watson ID, Stewart MJ, Platt DJ (September 1988). "Clinical pharmacokinetics of enzyme inhibitors in antimicrobial chemotherapy". Clinical Pharmacokinetics. 15 (3). ss. 133-64. doi:10.2165/00003088-198815030-00001. PMID 3052984.
- ^ Hazra S, Xu H, Blanchard JS (June 2014). "Tebipenem, a new carbapenem antibiotic, is a slow substrate that inhibits the β-lactamase from Mycobacterium tuberculosis". Biochemistry. 53 (22). ss. 3671-8. doi:10.1021/bi500339j. PMC 4053071 $2. PMID 24846409.
- ^ "FDA approves new treatment for complicated urinary tract and complicated intra-abdominal infections". Food and Drug Administration. 17 Temmuz 2019. 20 Kasım 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Temmuz 2019.
- ^ "Cilastatin/imipenem/relebactam — AdisInsight". Springer International Publishing AG. 31 Mayıs 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 29 Nisan 2016.
- ^ "FDA approves new antibacterial drug" (Basın açıklaması). Food and Drug Administration. 29 Ağustos 2017. 23 Nisan 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Temmuz 2019.
- ^ Livermore DM (October 1995). "beta-Lactamases in laboratory and clinical resistance". Clinical Microbiology Reviews. 8 (4). ss. 557-84. doi:10.1128/cmr.8.4.557. PMC 172876 $2. PMID 8665470.
- ^ Leonard DA, Bonomo RA, Powers RA (November 2013). "Class D β-lactamases: a reappraisal after five decades". Accounts of Chemical Research. 46 (11). ss. 2407-15. doi:10.1021/ar300327a. PMC 4018812 $2. PMID 23902256.
Dış bağlantılar[değiştir | kaynağı değiştir]
- Xu H, Hazra S, Blanchard JS (June 2012). "NXL104 irreversibly inhibits the β-lactamase from Mycobacterium tuberculosis". Biochemistry. 51 (22). ss. 4551-7. doi:10.1021/bi300508r. PMC 3448018 $2. PMID 22587688. (İngilizce)
- Kurz SG, Wolff KA, Hazra S, Bethel CR, Hujer AM, Smith KM, Xu Y, Tremblay LW, Blanchard JS, Nguyen L, Bonomo RA (December 2013). "Can inhibitor-resistant substitutions in the Mycobacterium tuberculosis β-Lactamase BlaC lead to clavulanate resistance?: a biochemical rationale for the use of β-lactam-β-lactamase inhibitor combinations". Antimicrobial Agents and Chemotherapy. 57 (12). ss. 6085-96. doi:10.1128/AAC.01253-13. PMC 3837893 $2. PMID 24060876. (İngilizce)