Hissedilir ısı
Bu madde, öksüz maddedir; zira herhangi bir maddeden bu maddeye verilmiş bir bağlantı yoktur. (Şubat 2024) |
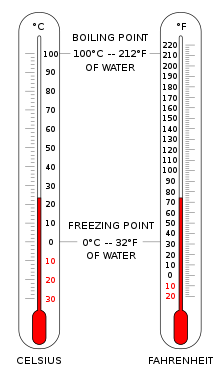
Hissedilir ısı, bir cisim veya termodinamik sistem tarafından değiştirilen ısı olup, burada ısı değişimi cismin veya sistemin sıcaklığını ve cismin veya sistemin bazı makroskobik değişkenlerini değiştirir, ancak hacim veya basınç gibi cisim veya sistemin diğer bazı makroskopik değişkenlerini değiştirmeden bırakır.[1][2][3][4]
Kullanım[değiştir | kaynağı değiştir]
| Termodinamik |
|---|
 |
Bu terim, gizli olarak değiştirilen ısı miktarı olan gizli ısı'nın aksine kullanılır yani sıcaklık değişimi olmadan meydana gelir. Örneğin buzun erimesi gibi bir faz değişiminde, buz ve sıvıyı içeren sistemin sıcaklığı buzun tamamı eriyene kadar sabit kalır. Gizli ve hissedilebilir terimleri birbiriyle ilişkilidir.
Bir termodinamik sürecin hissedilebilir ısısı, cismin kütlesinin (m), özgül ısı kapasitesi (c) ve sıcaklık değişimi () ile çarpımı olarak hesaplanabilir:
Hissedilir ısı ve gizli ısı enerjinin özel formları değildir. Daha ziyade, bir malzeme veya termodinamik sistem üzerindeki etkileri açısından belirtilen koşullar altında ısı alışverişini tanımlarlar.
Termodinamiğin temellerini açıklayan ilk bilim insanlarının yazılarında, hissedilir ısının kalorimetri alanında anlamı netti. James Prescott Joule 1847'de bunu termometrenin gösterdiği enerji olarak tanımladı.[5]
Doğadaki enerji transferinde birçok süreçte hem hissedilir hem de gizli ısılar vardır. Gizli ısı, sabit sıcaklıkta ölçülen durum değişiklikleriyle, özellikle atmosferdeki su buharı’nın çoğunlukla buharlaşma ve yoğunlaşma gibi faz değişimleriyle ilişkilidir; oysa hissedilir ısı atmosfer sıcaklığını doğrudan etkiler.
Meteorolojide 'hissedilir ısı akı' terimi, Dünya yüzeyinden atmosfere kadar olan iletken ısı akı’sı anlamındadır.[6] Dünyanın yüzey enerji bütçesinin önemli bir bileşeni hissedilir ısıdır. Hissedilir ısı akışı genellikle girdap kovaryans yöntemiyle ölçülür.
Sürekli ısı alışverişinde sistem zamana göre kararlı, uzaya göre ise geçici durumda çalışır. Bu nedenle, ısı eşanjörlerinin boyutlandırılması için genellikle sıcaklık farklarının logaritmik ortalamasını (LMTD) kullanırız:
veya :
- K genel ısı değişim katsayısıdır
- A alandır (m2 olarak)
- P ısıl güç olup P = Q / t formülüyle hesaplanır
- LMTD sıcaklık farklarının logaritmik ortalamasıdır:
ile:
- ∆TE : sıvı giriş sıcaklığındaki fark (karşı akım eşanjörü için geçerlidir)
- ∆TS : sıvı çıkış sıcaklığındaki fark (karşı akım eşanjörü için geçerlidir)
Katıların ısıl kapasitesi[değiştir | kaynağı değiştir]
Katıların ısı kapasitesi Dulong-Petit Yasası ile tanımlanır.
Ayrıca bakınız[değiştir | kaynağı değiştir]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Partington, J.R. (1949). An Advanced Treatise on Physical Chemistry, Volume 1, Fundamental Principles. The Properties of Gases, Longmans, Green, and Co., London, pages 155-157.
- ^ Prigogine, I., Defay, R. (1950/1954). Chemical Thermodynamics, Longmans, Green & Co, London, pages 22-23.
- ^ Adkins, C.J. (1975). Equilibrium Thermodynamics, second edition, McGraw-Hill, London, 0-07-084057-1, Section 3.6, pages 43-46.
- ^ Landsberg, P.T. (1978). Thermodynamics and Statistical Mechanics, Oxford University Press, Oxford, 0-19-851142-6, page 11.
- ^ J. P. Joule (1884), The Scientific Paper of James Prescott Joule, Londra Fizik Topluluğu, s. 274,
Bu hipotezlerin her ikisinin de geçerli bulunacağına inanma eğilimindeyim; bazı durumlarda, özellikle hissedilir ısı durumunda veya termometrenin gösterdiği gibi, ısının, içinde uyarıldığı cisimlerin parçacıklarının yaşam kuvvetinden oluştuğu görülecektir;
, Madde, Yaşam Kuvveti ve Isı Üzerine Ders. 5 Mayıs ve and 12 mayıs 1847 - ^ Stull, R.B. (2000). Meteorology for Scientists and Engineers, ikinci baskı, Brooks/Cole, Belmont CA, 978-0-534-37214-9, sayfa 57.



















