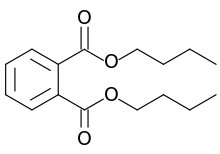
Dibütil ftalat
| |

| |
| Adlandırmalar | |
|---|---|
Dibütil benzen-1,2-dikarboksilat | |
Diğer adlar Dibütil ftalat Di-n-bütil ftalat Bütil ftalat n-Bütil ftalat 1,2-Benzendikarboksilik asit dibütil ester o-Benzendikarboksilik asit dibütil ester DBP Palatinol C Elaol Dibütil 1,2-benzen-dikarboksilat | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| 1914064 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.001.416 |
| EC Numarası |
|
| 262569 | |
| KEGG | |
PubChem CID
|
|
| RTECS numarası |
|
| UNII | |
CompTox Bilgi Panosu (EPA)
|
|
| |
| Özellikler | |
| Kimyasal formül | C16H22O4 |
| Molekül kütlesi | 278,34 g mol−1 |
| Görünüm | Renksiz veya soluk sarı renkte yağlı sıvı |
| Koku | aromatik |
| Yoğunluk | 1.05 g/cm3 at 20 °C |
| Erime noktası | -35 °C |
| Kaynama noktası | 340 °C |
| Çözünürlük (su içinde) | 13 mg/L (25 °C) |
| log P | 4.72 |
| Buhar basıncı | 0.00007 mmHg (20 °C)[1] |
| -175.1•10−6 cm3/mol | |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | N), Zararlı (Xi) |
| GHS etiketleme sistemi: | |
| Piktogramlar |  
|
| İşaret sözcüğü | Tehlike |
| Tehlike ifadeleri | H360Df, H400 |
| Önlem ifadeleri | P201, P202, P273, P281, P308+P313, P391, P405, P501 |
| NFPA 704 (yangın karosu) |
|
| Parlama noktası | 157 °C |
| 402 °C | |
| Patlama sınırları | %0.5 - 3.5 |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
5289 mg/kg (oral, fare) 8000 mg/kg (oral, sıçan) 10,000 mg/kg (oral, kobay)[2] |
LC50 (medyan konsantrasyon)
|
4250 mg/m3 (sıçan) 25000 mg/m3 (fare, 2 saat)[2] |
| NIOSH ABD maruz kalma limitleri: | |
| PEL (izin verilen) | TWA 5 mg/m3[1] |
| REL (tavsiye edilen) | TWA 5 mg/m3[1] |
| IDLH (anında tehlike) | 4000 mg/m3[1] |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Dibütil ftalat (DBP), düşük toksisitesi ve geniş sıvı aralığı nedeniyle plastikleştirici olarak yaygın halde kullanılan bir organik bileşiktir. Kimyasal formülü C6H4(CO2C4H9)2 olan DBP’nin, ticari örnekleri genellikle sarı olmasına rağmen renksiz bir yağ görünümündedir.[3]
Üretimi ve kullanımı
[değiştir | kaynağı değiştir]DBP, n-bütanolün ftalik anhidrit ile reaksiyonundan üretilir. Bu öncül bileşikler temiz ve ucuz bir şekilde üretilir.[3]
DBP, PVC gibi büyük mühendislik plastiklerinin kullanılmasına izin veren önemli bir plastikleştiricidir. Bu tür değiştirilmiş PVC, kanalizasyon ve diğer aşındırıcı malzemeleri taşımak için sıhhi tesisatta yaygın olarak kullanılmaktadır.[3]
Bozunma
[değiştir | kaynağı değiştir]Hidroliz
[değiştir | kaynağı değiştir]Monobütil ftalat (MBP) ana metabolitidir. DOI:10.1007/s40618-015-0279-6
DBP’nin Çifte sabunlaşması, ftalik asit ve n-bütanolü oluşturur.[4]
Çöplüklerde
[değiştir | kaynağı değiştir]DBP, 2.67 x 10−3 Pa düşük bir buhar basıncına sahiptir. Bu nedenle DBP kolayca buharlaşmaz (bu yüzden plastikleştirici olarak kullanılabilir).[5] I Henry Kanunu sabiti 8.83 x 10−7 atm-m3/mol’dür.[4]
Yansıtıldığı gibi yaklaşık 4 olan oktanol-su dağılım katsayısı ile, lipofiliktir, bu da suyla kolayca mobilize edilmediği (çözülmediği) anlamına gelir. Bununla birlikte, çözünmüş organik bileşikler (DOC) çöplüklerdeki hareketliliğini arttırmaktadır.[6][7]
Biyolojik bozunma
[değiştir | kaynağı değiştir]Mikroorganizmalar tarafından gerçekleştirilen biyolojik bozunma, DBP tarafından kirliliğin giderilmesi için bir yoldur. Örneğin, Enterobacter türleri, DBP konsantrasyonunun 1500 ppm'de görülebildiği yerlerde belediye katı atıklarını 2-3 saat yarılanma ömrü ile biyolojik olarak parçalayabilir. Aksine, aynı türler altı günlük bir süre sonunda dimetil ftalatın % 100'ünü parçalayabilir.[8] Beyaz çürüklük mantarı Polyporus brumalis DBP’yi bozundurur.[9]
Yönetmelikler
[değiştir | kaynağı değiştir]DBP aynı zamanda, endokrin bozucu olarak kabul edilmektedir.[10]
Avrupa Birliği
[değiştir | kaynağı değiştir]Ayrıca bakınız
[değiştir | kaynağı değiştir]- Ftalik asit
- Ftalatlar
- Diizobütil ftalat (DIBP)
- Oje
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0187". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Dibutil Ftalat". Immediately Dangerous to Life or Health Concentrations (IDLH). Ulusal İş Sağlığı ve Güvenliği Enstitüsü (NIOSH).
- ^ a b c Peter M. Lorz, Friedrich K. Towae, Walter Enke, Rudolf Jäckh, Naresh Bhargava, Wolfgang Hillesheim "Phthalic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, 2007, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a20_181.pub2
- ^ a b Huang, Jingyu; Nkrumah, Philip N.; Li, Yi; Appiah-Sefah, Gloria (2013). Reviews of Environmental Contamination and Toxicology Volume 224. Reviews of Environmental Contamination and Toxicology (İngilizce). 224. Springer, New York, NY. ss. 39-52. doi:10.1007/978-1-4614-5882-1_2. ISBN 9781461458814. PMID 23232918.
- ^ Donovan, Stephen F. (1996). "New method for estimating vapor pressure by the use of gas chromatography". Journal of Chromatography A. 749 (1–2): 123-129. doi:10.1016/0021-9673(96)00418-9.
- ^ Christensen, Thomas H; Kjeldsen, Peter; Bjerg, Poul L; Jensen, Dorthe L; Christensen, Jette B; Baun, Anders; Albrechtsen, Hans-Jørgen; Heron, Gorm (2001). "Biogeochemistry of landfill leachate plumes". Applied Geochemistry. 16 (7–8): 659-718. doi:10.1016/s0883-2927(00)00082-2.
- ^ Bauer, M.J.; Herrmann, R. (2 Temmuz 2016). "Dissolved organic carbon as the main carrier of phthalic acid esters in municipal landfill leachates". Waste Management & Research (İngilizce). 16 (5): 446-454. doi:10.1177/0734242x9801600507.
- ^ Abdel daiem, Mahmoud M.; Rivera-Utrilla, José; Ocampo-Pérez, Raúl; Méndez-Díaz, José D.; Sánchez-Polo, Manuel (2012). "Environmental impact of phthalic acid esters and their removal from water and sediments by different technologies – A review". Journal of Environmental Management. 109: 164-178. doi:10.1016/j.jenvman.2012.05.014. PMID 22796723.
- ^ Ishtiaq Ali, Muhammad (2011). Microbial degradation of polyvinyl chloride plastics (PDF) (PhD). Quaid-i-Azam University. s. 48. 24 Aralık 2013 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 29 Temmuz 2020.
- ^ "National Report on Human Exposure to Environmental Chemicals". Centers for Disease Control and Prevention, U.S. Department of Health and Human Services. 8 Nisan 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Mart 2009.
Dış bağlantılar
[değiştir | kaynağı değiştir]- Uluslararası Kimyasal Güvenlik Kartı 0036
- Dibutyl Phthalate and Cosmetics
- Hazardous substance fact sheet20 Mayıs 2011 tarihinde Wayback Machine sitesinde arşivlendi.
- Occupational safety and health guideline for dibutyl phthalate
- CDC - NIOSH Pocket Guide to Chemical Hazards1 Ekim 2017 tarihinde Wayback Machine sitesinde arşivlendi.

