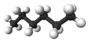Alkan
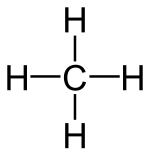
Alkanlar, (diğer bir deyişle Parafinler) sadece karbon (C) ve hidrojen (H) elementlerinin bulunduğu ve bu elementlerin birbirleriyle tekli bağ yaptığı doymuş alifatik organik bileşiklerin genel ismidir. Alkanlar birbirlerini 1 karbon ve 2 hidrojen ile takip eden bir homolog seri oluştururlar. Örneğin tek karbonlu metan, CH4 formülüne sahipken, çift karbonlu etan C2H6 kapalı formülüne sahiptir. Alkanlarda tüm atomlar tekli bağlarla birbirlerine bağlandığı ve Karbon atomunu bağlayabileceği en fazla Hidrojen atomunu bağladığından dolayı doymuş bileşikler kategorisine girerler. Doymuş hidrokarbonlardan olan alkanlar, CnH2n+2 n=1,2,3,.... genel formülüne sahiptir. Burada n'in 3 veya 3'ten büyük olması hâlinde sikloalkan denilen halkalı yapılar oluşabilmektedirler.[1]
Alkanlardan bir hidrojen koparılmasıyla elde edilen gruba alkil grubu denir. Örneğin metandan bir hidrojen çıkarılırsa metil (CH3), etandan bir hidrojen çıkarılırsa etil (C2H5) elde edilir. Bu moleküller bir bağ daha yaparak hidrokarbon zincirine bağlanır.
Dallanmamış alkanlar
[değiştir | kaynağı değiştir]Hidrokarbon zincirindeki karbon atomlarının en fazla iki karbon atomuyla yapmış olduğu moleküllere dallanmamış alkan denir. Dallanmamış alkanların yapısında sadece birincil ve ikincil karbon atomları bulunur. Dallanmamış alkanlar homolog bir sıra oluştururlar.
Aşağıdaki tabelada ilk 14 n-Alkanın çeşitli fiziksel özelliklerini görebilmekteyiz.
| C | Adı | Kimyasal formül | Yanma noktası | Erime noktası | Kaynama noktası | Özkütle | [Top-Çubuk modeli] |
|---|---|---|---|---|---|---|---|
| 1 | Metan | CH4 | – | 90,65 K | 111,4 K | 0,667 kg/m³ |  |
| 2 | Etan | C2H6 | – | 90 K | 185 K | 1,212 kg/m³ | 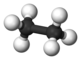 |
| 3 | Propan | C3H8 | – | 85 K | 231 K | 1,83 kg/m³ |  |
| 4 | n-Bütan | C4H10 | – | 135 K | 272,5 K | 2,703 kg/m³ | |
| 5 | n-Pentan | C5H12 | 224 K | 144 K | 309 K | 0,626 g/cm³ | |
| 6 | n-Hekzan | C6H14 | 250 K | 178 K | 342 K | 0,659 g/cm³ | |
| 7 | n-Heptan | C7H16 | 269 K | 182 K | 371 K | 0,684 g/cm³ | |
| 8 | n-Oktan | C8H18 | 289 K | 216 K | 399 K | 0,703 g/cm³ |  |
| 9 | n-Nonan | C9H20 | 304 K | 222 K | 424 K | 0,718 g/cm³ |  |
| 10 | n-Dekan | C10H22 | 319 K | 243 K | 447 K | 0,73 g/cm³ | |
| 11 | n-Undekan | C11H24 | 333 K | 248 K | 469 K | 0,74 g/cm³ | |
| 12 | n-Dodekan | C12H26 | 344 K | 263 K | 489 K | 0,75 g/cm³ |  |
Dallanmış alkanlar
[değiştir | kaynağı değiştir]Karbon atomunun bileşikteki sayısının artmasıyla, kovalent bağlarla birbirine bağlı olan atomların oluşturabileceği molekül, yapısal olarak çeşitlilik göstermektedir. Bu yüzden Karbon sayısı yüksek olan alkanlar karşımıza molekül formülleri aynı olmasına rağmen farklı yapılarla çıkmaktadırlar. Böyle bileşiklere yapı izomerleri denilmektedir.
Molekül formülü C4H10 olan bütan’da iki farklı yapıya rastlamaktayız. Bunlar n-bütan ve izo-bütan’dır.
Pentan üç farklı izomeri yapısıyla karşımıza çıkmaktadır.Pentanın izomer yapıları şunlardır: Bir zincir şeklinde ve dallanmamış yapısıyla n-Pentan, diğeri ikici Karbon atomunda tek bir dallanma gösteren yapısıyla izo-Pentan ve son olarak ikinci Karbonunda ikili dallanma gösteren neo-Pentan denir.
Karbon sayısının artmasıyla yapı izomerilerinin sayısı artmaktadır.
| Dallanmış Bazı Alkanlarda İsomeri Çeşitleri (Çubuk Modeli) | |||
|---|---|---|---|
| Genel Adı | n- | izo- | neo- |
| Propan |
 |
Bulunmamaktadır | Bulunmamaktadır |
| Bütan |
 |
 |
Bulunmamaktadır |
| Pentan |
 |
 |
 |
Sikloalkanlar
[değiştir | kaynağı değiştir]
Sikloalkanlar dairesel yapı gösteren doymuş hidrojen ve karbonlardan oluşan bileşiklerdir. Sikloalkanlar aynı zamanda dallanma gösterebilirler. Dallanmamış sikloalkanların genel formülü CnH2n şeklinde olup homolog bir yapı oluştururlar. Burada n ≥ 3 şartı vardır.
Adlandırma
[değiştir | kaynağı değiştir]19. yüzyılın sonlarına değin organik kimyada yapılan adlandırmalarda genelde o bileşiğin kaynağını ya da kullanıldığı yeri belirtecek şekilde olmaktaydı. Bu eski adlar, diğer bir deyişle yaygın adlar, günümüzde halen ticarette kimyacılar ve organik kimyacılar tarafından kullanılmaktadır. Bu nedenle bazı bileşiklerin yaygın isimlerinin bilinmesi zorunludur.
Günümüzde kullanılan sistem 1892’de Uluslararası Teorik ve Uygulamalı Kimya Birliği (IUPAC) tarafından önerilen bir sistemdir. Bu sistemde temel prensip her maddenin farklı bir isim alması üzerinedir. Bu yolla yedi milyar organik bileşik adlandırılmış ve ayrıca daha milyonlarca bileşiğin adlandırılmasına olanak vermektedir.[2][3]
Dallanmamış alkanlarda adlandırma
[değiştir | kaynağı değiştir]Dallanmamış alkanlarda adlandırma yapılırken Hidrokarbon zincirindeki karbon sayısının latincedeki karşılığı alınıp sonuna –an takısının takılmasıyla yapılmaktadır. Aşağıdaki tabloda ilk 20 n-Alkanın Kimyasal(Genel) formüllerini ve IUPAC Adlandırmadaki isimlerini görebiliriz.[4]
| Dallanmamış Alkanlarda IUPAC Adlandrılması | |||
|---|---|---|---|
| Genel Formülü | IUPAC Adı | Genel Formülü | IUPAC Adı |
| CH4 | Metan | C11H24 | Undekan |
| C2H6 | Etan | C12H26 | Dodekan |
| C3H8 | Propan | C13H28 | Tridekan |
| C4H10 | Bütan | C14H30 | Tetradekan |
| C5H12 | Pentan | C15H32 | Pentadekan |
| C6H14 | Heksan | C16H34 | Heksadekan |
| C7H16 | Heptan | C17H36 | Heptadekan |
| C8H18 | Oktan | C18H38 | Oktadekan |
| C9H20 | Nonan | C19H40 | Nanodekan |
| C10H22 | Dekan | C20H42 | Eiokoskan |
Dallanmış alkanlarda adlandırma
[değiştir | kaynağı değiştir]Alkanlarda en uzun karbon zinciri üzerinde başka bir grup bağlanmışsa buna dallanma denir ve sistematik adlandırmada belirtilmelidir. Dallanmış Alkanlarda adlandırma yapılırken dikkat edilecek kurallar aşağıda belirtilmiştir.[5][6]
1- Dallanmaya uğramış en uzun karbon zinciri bulunur.Yandaki tabloda da görüldüğü gibi 1a kutusundaki Hidrokarbonzincirinde en uzun karbon zincirini bulmak o kadar zor değildir, çünkü iki eşit uzunluğundaki karbon zincirinden oluşmaktadır.Bu iki zincir arasında istediğimizi seçebiliriz. Yalnız 1b kutusundaki Hidrokarbon zincirinde biri 6 diğeri 7 karbondan olmak üzeri iki farklı uzunluğtaki karbon zincirinden oluşmaktadır. Bize gerekli olan en uzun zincir olduğundan 7 karbonlu olan seçilir.
2- Dallanmış grublara Sübstitüen denilmektedir.Hidrokarbon zinciri üzerinde bulunun karbonlar numaralandırılır. Numaralandırma yapılırken sübstitüent grubuna en yakın uçtan başlanılır.Yandaki tabloda 2a ve 2b'de gördüğümüz gibi numaralandırma yapılırken Karbon zincirinin sağından ya da solundan başlamak önemli değildir. Burada önemli olan Sübstitüent grubuna en yakın uçtan başlamaktır.
3- Alkanlardan bir hidrojenin koparılmasıyla Alkiller oluşur. Yani en basit Alkan olan Metandan (CH4) bir hidrojenin uzaklaştırılmasıyla Metil (CH3), etandan (C2H6) bir hidrojen koparılırsa etil (C2H5), propandan(C3H8) bir hidrojenin uzaklaştırılmasıyla propil(C3H7) vb. oluşur. Bu Alkil grupları adlandırılma yapılırken yerleri belirtilmelidirler. Bu yüzden Alkil grubu diğer bir deyişle Sübstitüentlerin yerini belirten rakam ve isim arasına eksi(-) işareti koyularak yazılır.
4- Eğer bir Karbon zinciri üzerinde birden fazla Sübstitüent diğer bir deyişle alkil grubu varsa bunların yerleri en uzun karbon zinciri üzerinden belirlenir ve alfabetik sıralanma göz önünde bulundurularak yazılır. Yazılırken alkil grupları arasına eksi (-) işareti konularak birbirlerinden ayrı yazılır.
5- Aynı karbon üzerinde iki tane sübstitüent varsa bunların numarası iki defa kullanılır.
6- En uzun karbon zincirinin üzerinde iki veya daha fazla sübstitüent varsa bunların sayıları di-, tri-, tetra-, penta-, şeklinde belirtilerek adın önüne yazılır.
7- Eğer Karbonhidrad zinciri iki eşit uzunluktaki zincirden oluşuyorsa üzerinde en fazla sübstitüent bulunan zincir seçilir. En sonunada en uzun karbon zincirindeki alkanın adı yazılır.
8- Eğer Karbonhidrat zincirindeki ilk dallanmalar her iki uca da eşit uzaklıktaysa, numaralandırma yapılırken rakamların toplamı en az olan numaralandırma seçilir.
Alkanların fiziksel özellikleri
[değiştir | kaynağı değiştir]
Alkanları yapısında bulunan hidrojen ve karbon atomları birbirlerine kovalent bağlarıyla bağlıdırlar. Bundan dolayı alkanlar polarlıkları neredeyse yok denilecek kadar az olan moleküllerdir. Su moleküllerinde ise oksijen atomunun elektron çekme özelliği moleküldeki hidrojen atomunkinden çok yüksek olduğu için su molekülleri polarlaşma gösterir. Suyun polarlaşmış bir molekül ve alkanların polarlaşmamış bir molekül olduğundan alkanlar suda çözülmezler.
Dallanmamış alkanlarda zincirin uzamasıyla kaynama noktasında da bir artış gözlenmektedir. Bunun yanı sıra alkanların dallanması artıkça da bunların kaynama noktasında bir azalma olmaktadır. Dallanmamış alkanlarda zincirin uzamasıyla alkanların kütlesi daha da önemlisi molekülün yüzey alanı artmaktadır. Bununla doğrusal olarak da van der Waals Bağlarının kuvveti artmaktadır. Bu yüzden o molekülü bir arada tutan bağları koparmak için daha fazla enerji vermek zorunda kalıyoruz bu da kaynama noktasının artması demektir.
Dallanmış alkanlarda ise dallanma sonucu molekülün yüzeyinin küçülmesiyle kendi ve komşu moleküller arasındaki van der Waals bağlarının zayıflamasına sebep olurlar ve sonuç olarak dallanmış alkan moleküllerinde kaynama noktası düşmüş olur. Dallanmamış alkanlarda zincirin uzamasıyla düzenli artan artış erime noktası için görülmemektedir.
Alkanların yoğunluk bakımından organik bileşiklerde en küçük yoğunluğa sahip moleküllerdir. Ayrıca yoğunlukları suyunkinden küçük olduğundan suda yüzerler.[7]
Alkanların doğadaki kaynakları
[değiştir | kaynağı değiştir]İhtiyacımızın büyük bir kısmını oluşturan petrol ve doğal gaz Karbon ve Hidrojen'den oluşmaktadır diğer bir deyişle alkanlardan oluşmaktadır. Alkanlar Petrolden iki şekilde elde edilmektedir. Bunların birincisi klasik bir yöntem olan damıtma diğeride son yüzyılda kullanılan Kraking yöntemidir.[8]
Damıtma yöntemi
[değiştir | kaynağı değiştir]Petrol saf madde olmayan bir karışımdır. Bu yüzden içindeki maddeler çeşitli kaynama noktalarına sahiptirler. Rafinelilerde bu yöntem kullanılarak petrolden çeşitli ürünler elde edilmektedir. Bu yöntemle Petrol çeşitli sıcaklıklara kadar ısıtılarak içeriğindeki maddeler ilk etapta buharlaştırılıp ve daha sonra yoğunlaştırılarak birbirlerinden ayrıştırılır. Bununla elde edilecek bir maddenin miktarı o maddenin karışım içindeki miktarıyla sınırlıdır.[9]
Kraking
[değiştir | kaynağı değiştir]Petrol sanayisinin gelişmesiyle bazı petrol ürünlerine olan ihtiyacı artırmıştır. Bu yöntem kullanılarak petrolden ihtiyaca göre maddeler elde etme mümkündür. Katalizatörlerin ve ısının yardımıyla uzun Hidrokarbon zincirleri kırılarak daha küçük ve az dallanmış alkanlara çevrilmektedir. Bu işlem katalizatörsüzde yapılabilmektedir. Ancak katalizatörsüz yapılan işlemde düz zincirler halindeki alkanlar oluşmaktadır. Buda oktan bakımından zayıf kalmasına sebep olmakla beraber tercih edilmeyen bir işlemdir.[10]
Ayrıca bakınız
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- ^ T.W Graham Solomons (Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, (Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 130.
- ^ Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 50.
- ^ T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 135
- ^ T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 136
- ^ T.W Graham Solamons (Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, (Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 136-138
- ^ Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 51-53
- ^ Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 57-60
- ^ T.W Graham Solomon (Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 130
- ^ T.W Graham Solamons (Yazar), Craig B. Fryhle (Yazar), Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, (Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 130
- ^ T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 131