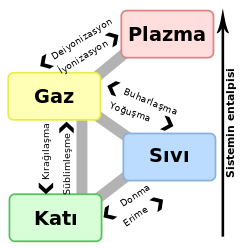
Kaynama
Kaynama, sıvının buhar basıncının dış basınca eşit olduğunda, sıvının her yerinden gaz kabarcıklarının çıkması. Saf maddelerin sabit atmosfer basıncı altında kaynama noktası sabittir. Kaynama süresi boyunca maddenin sıcaklığı değişmez. Sıvı bir maddenin içine uçucu olmayan bir çözünen eklenirse çözeltinin kaynama noktası yükselir. Çözünen madde miktarı arttıkça kaynama noktası yükselecektir. Aynı ortamdaki bütün sıvıların kaynama anındaki buhar basınçları eşittir, ancak maddelerin kaynama sıcaklığı maddenin cinsine, saflığına ve ortamın dış basıncına bağlıdır. Kaynama sıcaklığı maddeler için ayırt edici bir özelliktir.[1]
Kaynama sıcaklığındaki 1 gram sıvı maddenin tamamının gaz haline gelmesi için verilmesi gerek ısıya buharlaşma ısısı (Lb) denir. m gram maddeyi aynı sıcaklıkta buhar haline getirmek için verilmesi gerek ısı miktarı 𝑄 = 𝑚 𝐿𝑏 formülü ile hesaplanabilir. Suyun buharlaşma ısısı 540 cal/g'dır. Bu değer maddenin cinsine bağlıdır ve ayırt edici bir özelliktir.[1]
Kaynama noktası saf su için farklı sıcaklık birimlerinde 100 °C, 212 F ve 373 K olarak belirlenmiştir.
Bazı maddelerin Celsius ve Kelvin birimlerinde kaynama sıcaklıkları:
- Su: 100 °C (373 K)
- Metil alkol: 64,7 °C (337,8 K)
- Etil alkol: 78,38 °C (351,53 K)
- Eter: 34,6 °C (307,8 K)
- Aseton: 56 °C (329 K)
- Amonyak: -33 °C (240 K)
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b "Karadeniz Teknik Üniversitesi: Kaynama sıcaklığı". Karadeniz Teknik Üniversitesi. Erişim tarihi: 19 Mayıs 2020.[ölü/kırık bağlantı]
| Fizik ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. |