Gümüş sülfat: Revizyonlar arasındaki fark
Görünüm
| [kontrol edilmiş revizyon] | [kontrol edilmiş revizyon] |
İçerik silindi İçerik eklendi
Euphemiakh (mesaj | katkılar) Değişiklik özeti yok |
Teacher0691 (mesaj | katkılar) Kaldırıldı: Kategori:Bilgi kutusu bulunmayan sayfalar (Katalitik) |
||
| 31. satır: | 31. satır: | ||
[[Kategori:Sülfatlar]] |
[[Kategori:Sülfatlar]] |
||
[[Kategori:Bilgi kutusu bulunmayan kimyasal maddeler]] |
[[Kategori:Bilgi kutusu bulunmayan kimyasal maddeler]] |
||
[[Kategori:Bilgi kutusu bulunmayan sayfalar]] |
|||
Sayfanın 23.43, 9 Şubat 2019 tarihindeki hâli
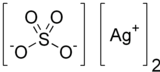
| |

| |
| Adlandırmalar | |
|---|---|
Gümüş sülfat | |
Diğer adlar digümüş(1+) tuz | |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
| Bilgi kutusu kaynakları |
Gümüş sülfat (Ag2SO4) gümüş kaplamada ve gümüş nitrat yerine boyanmayan madde olarak kullanılan gümüş iyonik bileşiği. Bu sülfat normal kullanım ve depolama durumunda kararlıdır fakat havaya ve ışığa mağruz kaldığında kararır. Suda çok az çözünür.
Hazırlanışı
Gümüş sülfat sülfürik asitin gümüş nitrata eklenmesi ile hazırlanır:
- 2 Ag+(aq) + SO42−(aq) → Ag2SO4(s)
Sonra çökelti sıcak suda yıkanır. Hazırlama işlemleri fazlaca kırmızı bir ışık altında gerçekleştirilir.
Gümüş(II) sülfat
Gümüş(II) sülfatın (AgSO4) sentezi bir değerlikli gümüş iyonu yerine iki değerlikli gümüş iyonunu içerir. Bu durum ilk kez 2010'da belirtilmiştir.[1] İşlem sülfürik asitin gümüş(II) florüre eklenmesi ile gerçekleşir. HF çıkışı gözlenir. Gümüş(II) sülfat 120 °C'de ekzotermik olarak bileşenlerine ayrışan siyah bir katıdır.
Kaynakça
- ^ Malinowski, P.; Derzsi, M.; Mazej, Z.; Jagličić, Z.; Gaweł, B.; Lasocha, W.; Grochala, W. (2010). "Ag(II)SO(4): A Genuine Sulfate of Divalent Silver with Anomalously Strong One-Dimensional Antiferromagnetic Interactions". Angewandte Chemie International Edition in English. 49 (9). ss. 1683–1686. doi:10.1002/anie.200906863. PMID 20084660.
