Germanyum: Revizyonlar arasındaki fark
| [kontrol edilmemiş revizyon] | [kontrol edilmemiş revizyon] |
elektron dizilimindeki sıralamada hata yapılmıştı. Dizilim sırasında (4s) orbitali, (3d) orbitalinden önce yazılır. |
"Germanium" sayfasının çevrilmesiyle oluşturuldu. Etiketler: İçerik Çevirmeni [Çevirmeni 2] |
||
| 1. satır: | 1. satır: | ||
'''Germanyum;''' [[Element simgesi|sembolü]] GE, [[atom numarası]] 32 olan [[Element|kimyasal element]]<nowiki/>tir. Parlak, sert-kırılgan, grimsi-beyaz ve [[Silisyum|silikona]] benzer bir görünümdedir. Silisyum ve [[kalay]] komşu grubuna kimyasal olarak benzeyen [[karbon grubu]]<nowiki/>ndaki bir [[Yarı metal|metaloid]]<nowiki/>dir. Silikon gibi, germanyum da doğal olarak [[Kimyasal reaksiyon|reaksiyona girer]] ve doğadaki [[oksijen]]<nowiki/>le kompleksler oluşturur. |
|||
{{Element| |
|||
Element_adı=Germanyum| |
|||
Kimyasal_simge=Ge| |
|||
Atom_numarası=32| |
|||
Kimyasal_seri=Metaloidler| |
|||
Grup=14| |
|||
Periyot=4| |
|||
Blok=p| |
|||
Görünüş=Gümüş grisi| |
|||
Atom_ağırlığı=72.59| |
|||
Elektron_dizilimi=[[[argon|Ar]]] 4s<sup>2</sup> 3d<sup>10</sup> 4p<sup>2</sup>| |
|||
Elektronlar=2, 8, 18, 4| |
|||
CAS_kayıt_numarası=7440-56-4| |
|||
Maddenin_hali=Katı| |
|||
Yoğunluk=5.323| |
|||
Sıvı_yoğunluğu=5.60 | |
|||
Ergime_noktası_K=1211.40| |
|||
Ergime_noktası_C=938.25| |
|||
Ergime_noktası_F=1720.85| |
|||
Kaynama_noktası_K=3106| |
|||
Kaynama_noktası_C=2833| |
|||
Kaynama_noktası_F=5131| |
|||
Ergime_ısısı=36.94| |
|||
Buharlaşma_ısısı=334| |
|||
Isı_kapasitesi=23.222| |
|||
Kristal_yapısı=Elmas yapı| |
|||
Yükseltgenme_seviyeleri=| |
|||
Elektronegatifliği=| |
|||
İyonlaşma_enerjisi= 762 | 1537.5 | 3302.1| |
|||
Atom_yarıçapı= [[1 E-10 m|125]]| |
|||
Atom_yarıçapı_hes=125| |
|||
Kovalent_yarıçapı=[[1 E-10 m|122]]| |
|||
Van_der_Waals_yarıçapı=| |
|||
Elektrik_direnci=| |
|||
Isıl_iletkenlik=60.2| |
|||
Isıl_genleşme=6.0| |
|||
Ses_hızı=5400| |
|||
Ses_hızı_derecesi=| |
|||
Mohs_sertliği=6.0| |
|||
Vickers_sertliği=| |
|||
Brinell_sertliği=| |
|||
İzotop_tablosu=}} |
|||
Germanyum yüksek konsantrasyonda nadiren göründüğü için geç keşfedildi. Germanyum[[Kimyasal elementlerin Dünya'nın yerkabuğundaki bollukları|, yer kabuğundaki elementlerin göreceli bolluğunda]] elliye yakın bir yerdedir. 1869'da [[Dmitri Mendeleyev|Dmitri Mendeleev]], varlığı ve bazı [[Kimyasal özellik|özelliklerini]] [[Periyodik tablo|periyodik tablodaki]] konumundan [[Dmitri Mendeleyev'in öngördüğü elementler|tahmin etti]] ve elementi '''ekasilicon''' olarak isimlendirdi. 1886'da Freiberg Üniversitesi'nden Clemens Winkler, argyrodite mineralinde [[gümüş]] ve [[kükürt]]<nowiki/>le birlikte yeni elementi buldu ve elemente ülkesi [[Alman İmparatorluğu|Almanya'nın]] adını verdi. Germanyum esas olarak sfaleritten ([[Çinko|çinkonun]] birincil cevheri) çıkarılır, ancak germanyum ticari olarak [[gümüş]], [[kurşun]] ve [[bakır]] [[Maden cevheri|cevherlerinden]] de geri kazanılır. |
|||
'''Germanyum''' ('''Ge'''; [[Almanca]] ''Germanium'' (n), [[Fransızca]] ''Germanium'' (m), [[İngilizce]] ''Germanium''), dikkat çekici derecede elektriksel özelliklere sahip gümüş grisi renginde metalik görünüşlü bir element. |
|||
Elemental germanyum, [[transistör]] ve çeşitli elektronik cihazlarda [[yarı iletken]] olarak kullanılır. Tarihsel olarak, yarı iletken elektroniğin ilk on yılı tamamen germanyuma dayanıyordu. Şu anda başlıca kullanımlar, [[Optik fiber|fiber optik]], kızılötesi optikler, [[Güneş Hücresi|güneş hücresi]] uygulamaları ve [[LED|ışık yayan diyotlar]] (LED)dır. Germanyum bileşikleri [[polimerizasyon]] katalisti olarak kullanılır ve son zamanlarda nanotel üretiminde kullanım alanı bulmuştur. Bu element, [[Organometalik kimya|organometalik kimyada]] yararlı olan tetraetilgermanyum gibi çok sayıda organogermanyum bileşiği oluşturur. Germanyum, teknoloji açısından kritik bir element olarak kabul edilir.<ref>{{Akademik dergi kaynağı|başlık=Critical Metals Ga, Ge and In: Experimental Evidence for Smelter Recovery Improvements|erişimtarihi=free|yazarlar=Avarmaa|tarih=June 2019|sayı=6|dil=en|sayfalar=367|çalışma=Minerals|cilt=9|doi=10.3390/min9060367}}</ref> |
|||
== Özellikleri == |
|||
Yarı metalik, yani metal ile ametaller arasında özellikler gösterir. [[Periyodik tablo|periyodik cetvel]]de dördüncü grupta olup, [[silisyum]] ve [[kalay]] arasında bulunur. Germanyum (+2) ve (+4) değerliklerini alır. [[Elmas]]a benzer kristalleşme gösterir. Atom numarası 32 ve atom ağırlığı 72,59’dur. Kütle numaraları 70 ile 76 arasında değişen 5 tâne kararlı, yine kütleleri 65 ile 78 arasında değişen ve yarılanma süreleri nispeten kısa olan 9 tâne radyoaktif izotopu vardır. Erime noktası 937 °C ve kaynama noktası 2800 °C’dir. Atmosferik şartlarda gayet kararlıdır. 600-700 °C’de havada oksitlenir. [[Halojen]]lerle şiddetli reaksiyon verir. Yoğunluğu 5,323 g/cm<sup>3</sup>tür. [[Nitrik asit]] ve derişik [[sülfürik asit]]te çözünür. |
|||
Germanyumun [[Organik kimya|canlılık]] için gerekli bir element olduğu düşünülmemektedir.Doğal olarak oluşan germanyum bileşikleri suda çözünmez olma eğilimindedir ve bu nedenle çok az oral [[Toksiklik|toksisiteye]] sahiptir. Bununla birlikte, sentetik çözünür germanyum tuzları [[Nefrotoksisite|nefrotoksiktir]] ve [[Halojen|halojenler]] ve [[hidrojen]] içeren sentetik kimyasal olarak reaktif germanyum bileşikleri tahriş edici toksinlerdir. |
|||
== Bulunuşu ve elde edilişi == |
|||
== Tarih == |
|||
1871’de [[Dimitri Mendeleyev]] mevcudiyetini tahmin etmiştir. 1886’da [[Clemens Winkler]], sülfitli mineral [[argirodit]]i analiz ederek, şimdiye kadar rastlamadığı bir element elde etti. Memleketine izafeten germanyum adını verdi. Germanyum nadir elementlerden olup, yer kabuğunda % 0,004-0,0007 oranında bulunur. Yer kabuğunda yoğun olarak bulunmadığından, germanyumun elde edilmesi oldukça zordur. Yer kabuğunda bulunan [[element]]lerin miktar olarak otuz altıncısıdır. Hiçbir zaman serbest halde bulunmaz. Germanyum, argirodit (4 Ag<sub>2</sub>S GeS<sub>2</sub>) mineralinde %6-7, [[germanit]] (7CuS.FeS.GeS) mineralinde %8,7, [[renierit]] mineralinde ise %5-7 oranında bulunur. Son iki mineral en çok [[Afrika]]’da bulunur. |
|||
[[Dosya:Mendeleev_1869_prediction_of_germanium_(detail).svg|sol|küçükresim| Germanyum tahmini, "?=70" (periyodik tablo 1869)]] |
|||
Rus kimyacı [[Dmitri Mendeleyev|Dmitri Mendeleev]], 1869'da ''Kimyasal Elementlerin Periyodik Yasası'' hakkındaki raporunda, [[silisyum]] ve [[kalay]] arasında [[Karbon grubu|karbon ailesi]]<nowiki/>ndeki bir boşluğu dolduracak olan bir [[Element|kimyasal elementin]] varlığını tahmin etti.<ref>{{Akademik dergi kaynağı|url=http://www.scs.uiuc.edu/~mainzv/HIST/awards/OPA%20Papers/2005-Kaji.pdf|başlık=D. I. Mendeleev's concept of chemical elements and ''The Principles of Chemistry''|erişimtarihi=2008-08-20|arşivtarihi=2008-12-17|arşivurl=https://web.archive.org/web/20081217080509/http://www.scs.uiuc.edu/~mainzv/HIST/awards/OPA%20Papers/2005-Kaji.pdf|yazarlar=Kaji|sayı=1|sayfalar=4–16|çalışma=Bulletin for the History of Chemistry|yıl=2002|cilt=27|ilk=Masanori|citeseerx=dead}}</ref> Periyodik tablosundaki konumu nedeniyle Mendeleev buna ''ekasilicon (Es)'' adını verdi ve [[Atom ağırlığı|atom ağırlığını]] 70 (daha sonra 72) olarak tahmin etti. |
|||
1885'in ortalarında, [[Freiberg|Saksonya, Freiberg]] yakınlarındaki bir madende yeni bir [[mineral]] keşfedildi ve yüksek [[gümüş]] içeriği nedeniyle ''argyrodite'' olarak adlandırıldı. Kimyager Clemens Winkler, gümüş, kükürt ve yeni bir elementin birleşimi olduğu kanıtlanan bu yeni minerali analiz etti. Winkler, 1886'da yeni elementi izole edebildi ve onu [[Antimon|antimona]] benzer buldu. Başlangıçta yeni elementin eka-antimon olduğunu düşündü, ancak kısa süre sonra onun bunun yerine eka-silikon olduğuna ikna oldu.<ref name="Winkle2" /><ref name="isolation">{{Akademik dergi kaynağı|url=http://gallica.bnf.fr/ark%3A/12148/bpt6k90705g/f212.chemindefer|başlık=Germanium, Ge, a New Nonmetal Element|arşivtarihi=December 7, 2008|arşivurl=https://web.archive.org/web/20081207033757/http://dbhs.wvusd.k12.ca.us/webdocs/Chem-History/Disc-of-Germanium.html|yazarlar=Winkler|sayı=1|dil=de|sayfalar=210–211|çalışma=Berichte der Deutschen Chemischen Gesellschaft|yıl=1887|cilt=19|doi=10.1002/cber.18860190156|ilk=Clemens|citeseerx=dead}}</ref> Winkler, yeni elementle ilgili sonuçlarını yayınlamadan önce, elementine ''neptünyum'' adını vermeye karar verdi, çünkü 1846'da [[Neptün]] gezegeninin keşfi de benzer şekilde onun varlığına dair önceki matematiksel tahminlerin ardından gelmişti. Bununla birlikte, "neptunium" adı, tahmin edilen başka bir kimyasal elemente zaten verilmişti (bugün 1940'ta keşfedilen [[Neptünyum|neptunium]] adını taşıyan element değil). Bunun yerine Winkler, anavatanının onuruna yeni elemente ''germanyum'' ( [[Latince]] ''[[Cermanya|Germania]]'' kelimesinden) adını verdi.<ref name="isolation" /> Argyrodite ampirik olarak Ag<sub>8</sub>GeS<sub>6</sub> olduğunu kanıtladı. Bu yeni element, [[arsenik]] ve antimon elementleriyle bazı benzerlikler gösterdiğinden, periyodik tablodaki uygun yeri düşünülüyordu, ancak Dmitri Mendeleev'in tahmin ettiği element "ekasilicon" ile benzerlikleri periyodik tablodaki yerini doğruladı.<ref name="isolation" /><ref>{{Akademik dergi kaynağı|url=http://cdl.library.cornell.edu/cgi-bin/moa/pageviewer?frames=1&coll=moa&view=50&root=%2Fmoa%2Fmanu%2Fmanu0018%2F&tif=00187.TIF|başlık=Germanium, a New Non-Metallic Element|erişimtarihi=2008-08-20|arşivtarihi=2008-12-19|arşivurl=https://web.archive.org/web/20081219162737/http://cdl.library.cornell.edu/cgi-bin/moa/pageviewer?frames=1&coll=moa&view=50&root=%2Fmoa%2Fmanu%2Fmanu0018%2F&tif=00187.TIF|sayfa=181|çalışma=The Manufacturer and Builder|yıl=1887|citeseerx=live}}</ref> Saksonya'daki madenlerden çıkarılan 500'kg'dan fazla malzeme ile Winkler 1887'de yeni elementin kimyasal özelliklerini doğruladı.<ref name="Winkle2">{{Akademik dergi kaynağı|url=http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f183.table|başlık=Mittheilungen über des Germanium. Zweite Abhandlung|erişimtarihi=2008-08-20|arşivtarihi=2012-11-03|arşivurl=https://web.archive.org/web/20121103012004/http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f183.table|yazarlar=Winkler|tarih=1887|sayı=1|dil=de|sayfalar=177–209|çalışma=J. Prak. Chemie|cilt=36|doi=10.1002/prac.18870360119|ilk=Clemens|citeseerx=live}}</ref><ref name="isolation" /><ref>{{Akademik dergi kaynağı|url=https://zenodo.org/record/1426200|başlık=Obituary: Clemens Winkler|erişimtarihi=2020-06-07|arşivtarihi=2020-08-01|arşivurl=https://web.archive.org/web/20200801004057/https://zenodo.org/record/1426200|yazarlar=Brunck|sayı=4|dil=de|sayfalar=4491–4548|çalışma=Berichte der Deutschen Chemischen Gesellschaft|yıl=1886|cilt=39|doi=10.1002/cber.190603904164|ilk=O.|citeseerx=live}}</ref> Ayrıca saf germanyum tetraklorürü ( {{Chem|GeCl|4}} analiz ederek 72.32'lik bir atom ağırlığı belirledi. Lecoq de Boisbaudran ise elementin kıvılcım [[Spektrum|spektrumundaki]] çizgileri karşılaştırarak 72.3'ü elde etti. <ref>{{Akademik dergi kaynağı|url=http://gallica.bnf.fr/ark:/12148/bpt6k3059r/f454.table|başlık=Sur le poids atomique du germanium|erişimtarihi=2008-08-20|arşivtarihi=2013-06-20|arşivurl=https://web.archive.org/web/20130620032945/http://gallica.bnf.fr/ark:/12148/bpt6k3059r/f454.table|yazarlar=de Boisbaudran|dil=fr|sayfa=452|çalışma=Comptes Rendus|yıl=1886|cilt=103|ilk=M. Lecoq|citeseerx=live}}</ref> |
|||
Germanyum, [[çinko]]nun saflaştırılması sırasında yan ürün olarak elde edilir. Burada elde edilen germanyum sülfür (GeS<sub>2</sub>) [[hidrojen]] veya [[karbon]] ile indirgenir. |
|||
Winkler, flor, klor, sülfür, dioksit bileşikleriyle ilk organogerman olan tetraetilgerman (Ge(C<nowiki><sub>2</sub></nowiki>H<nowiki><sub>5</sub></nowiki>)<nowiki><sub>4</sub></nowiki>) dahil olmak üzere birkaç germanyum bileşiği hazırlayabildi.<ref name="Winkle2">{{Akademik dergi kaynağı|url=http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f183.table|başlık=Mittheilungen über des Germanium. Zweite Abhandlung|erişimtarihi=2008-08-20|arşivtarihi=2012-11-03|arşivurl=https://web.archive.org/web/20121103012004/http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f183.table|yazarlar=Winkler|tarih=1887|sayı=1|dil=de|sayfalar=177–209|çalışma=J. Prak. Chemie|cilt=36|doi=10.1002/prac.18870360119|ilk=Clemens|citeseerx=live}}</ref> Mendeleev'in tahminleriyle iyi bir şekilde örtüşen bu bileşiklerden elde edilen fiziksel veriler, keşfi Mendeleyev'in element [[Periyodik tablo|periyodikliği]] fikrinin önemli bir teyidi haline getirdi.<ref name="Winkle2" /><div style="float: center; margin: 5px;"></div>Germanyumun 1930'ların sonlarına kadar zayıf iletken bir [[metal]] olduğu düşünülüyordu.<ref name="DOE">{{Akademik dergi kaynağı|url=http://www.osti.gov/bridge/servlets/purl/922705-bthJo6/922705.PDF|başlık=Germanium: From Its Discovery to SiGe Devices|erişimtarihi=2008-08-22|arşivtarihi=2019-07-10|arşivurl=https://web.archive.org/web/20190710154435/http://www.osti.gov/bridge/servlets/purl/922705-bthJo6/922705.PDF|yazarlar=Haller, E. E.|tarih=2006-06-14|çalışma=Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley|citeseerx=live}}</ref> Germanyum, [[elektronik]] yarı iletken olarak özelliklerinin kabul edildiği 1945 sonrasına kadar ekonomik olarak önemli hale gelmedi. [[II. Dünya Savaşı|İkinci Dünya Savaşı]] sırasında, çoğu [[diyot]] olmak üzere bazı özel [[Elektronik|elektronik cihazlarda]] az miktarda germanyum kullanıldı.<ref>{{Haber kaynağı|url=http://select.nytimes.com/gst/abstract.html?res=F30715FE3F5B157A93C2A8178ED85F478585F9|başlık=Germanium for Electronic Devices|erişimtarihi=2008-08-22|arşivtarihi=2013-06-13|arşivurl=https://web.archive.org/web/20130613202934/http://select.nytimes.com/gst/abstract.html?res=F30715FE3F5B157A93C2A8178ED85F478585F9|yazarlar=W. K.|tarih=1953-05-10|çalışma=The New York Times}}</ref><ref>{{Web kaynağı|url=http://www.computerhistory.org/semiconductor/timeline/1941-semiconductor.html|başlık=1941 – Semiconductor diode rectifiers serve in WW II|erişimtarihi=2008-08-22|arşivtarihi=2008-09-24|arşivurl=https://web.archive.org/web/20080924135754/http://www.computerhistory.org/semiconductor/timeline/1941-semiconductor.html|yayıncı=Computer History Museum}}</ref> İlk büyük kullanım, Savaş sırasında [[radar]] dalga tespiti için nokta temaslı [[Schottky diyot|Schottky diyotlarıydı]].<ref name="DOE" /> İlk silikon-germanyum alaşımları 1955'te elde edildi.<ref>{{Web kaynağı|url=http://www.sp.phy.cam.ac.uk/~SiGe/Silicon%20Germanium%20(SiGe)%20History.html|başlık=SiGe History|erişimtarihi=2008-08-22|arşivtarihi=2008-08-05|arşivurl=https://web.archive.org/web/20080805204801/http://www.sp.phy.cam.ac.uk/~SiGe/Silicon%20Germanium%20%28SiGe%29%20History.html|yayıncı=University of Cambridge}}</ref> 1945'ten önce izabe tesislerinde her yıl yalnızca birkaç yüz kilogram germanyum üretiliyordu, ancak 1950'lerin sonunda dünya çapındaki yıllık üretim 40 metrik tona ulaştı.<ref name="acs">{{Haber kaynağı|url=http://pubs.acs.org/cen/80th/print/germanium.html|başlık=Germanium|erişimtarihi=2008-08-22|arşivtarihi=2008-05-13|arşivurl=https://web.archive.org/web/20080513180858/http://pubs.acs.org/cen/80th/print/germanium.html|yazarlar=Halford|çalışma=Chemical & Engineering News|yayıncı=American Chemical Society|yıl=2003|ilk=Bethany}}</ref> |
|||
Yine germanyum, yumuşak katranlı maden kömürünün yakılması sırasında yan ürün olarak elde edilir. |
|||
1948'de germanyum [[Transistör|transistörün]] geliştirilmesi<ref>{{Akademik dergi kaynağı|başlık=The Transistor, A Semi-Conductor Triode|yazarlar=Bardeen|sayı=2|sayfalar=230–231|çalışma=Physical Review|yıl=1948|cilt=74|doi=10.1103/PhysRev.74.230|ilk=J.|yazar3=Brattain, W. H.}}</ref> sayısız [[Katı hâl elektroniği|katı hal elektroniği]]<nowiki/>ne kapı açtı.<ref>{{Web kaynağı|url=http://www.greatachievements.org/?id=3967|başlık=Electronics History 4 – Transistors|erişimtarihi=2008-08-22|arşivtarihi=2007-10-20|arşivurl=https://web.archive.org/web/20071020030644/http://www.greatachievements.org/?id=3967|yayıncı=National Academy of Engineering}}</ref> 1950'den 1970'lerin başına kadar, bu alan germanyum için artan bir pazar sağladı, ancak daha sonra transistör, diyot ve [[Doğrultucu|doğrultucularda]] germanyumun yerini yüksek saflıkta silikon almaya başladı.<ref name="usgs">{{Akademik dergi kaynağı|url=http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|başlık=Germanium – Statistics and Information|erişimtarihi=2008-08-28|arşivtarihi=2008-09-16|arşivurl=https://web.archive.org/web/20080916115005/http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|yazarlar=U.S. Geological Survey|çalışma=U.S. Geological Survey, Mineral Commodity Summaries|alıntı=Select 2008|yıl=2008|citeseerx=live}}</ref> Örneğin, [[Fairchild Semiconductor]] olan şirket, 1957'de açık bir şekilde silikon transistörler üretmek amacıyla kuruldu. Silikon üstün elektriksel özelliklere sahiptir, ancak [[Katı hâl elektroniği|yarı iletken elektroniğin]] ilk yıllarında ticari olarak elde edilemeyen çok daha fazla saflık gerektirir.<ref>{{Akademik dergi kaynağı|başlık=Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit|yazarlar=Teal|tarih=July 1976|sayı=7|sayfalar=621–639|çalışma=IEEE Transactions on Electron Devices|cilt=ED-23|doi=10.1109/T-ED.1976.18464|ilk=Gordon K.}}</ref> |
|||
== Bileşikleri == |
|||
Bu arada, [[Optik fiber|fiber optik]] iletişim ağları, [[Gece görüşü|gece görüş]] sistemleri ve [[polimerizasyon]] [[Kataliz|katalizörleri]] için germanyuma olan talep önemli ölçüde arttı.<ref name="acs">{{Haber kaynağı|url=http://pubs.acs.org/cen/80th/print/germanium.html|başlık=Germanium|erişimtarihi=2008-08-22|arşivtarihi=2008-05-13|arşivurl=https://web.archive.org/web/20080513180858/http://pubs.acs.org/cen/80th/print/germanium.html|yazarlar=Halford|çalışma=Chemical & Engineering News|yayıncı=American Chemical Society|yıl=2003|ilk=Bethany}}</ref> Bu son kullanımlar, 2000 yılında dünya çapındaki germanyum tüketiminin %85'ini temsil ediyordu.<ref name="usgs">{{Akademik dergi kaynağı|url=http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|başlık=Germanium – Statistics and Information|erişimtarihi=2008-08-28|arşivtarihi=2008-09-16|arşivurl=https://web.archive.org/web/20080916115005/http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|yazarlar=U.S. Geological Survey|çalışma=U.S. Geological Survey, Mineral Commodity Summaries|alıntı=Select 2008|yıl=2008|citeseerx=live}}</ref> ABD hükümeti, germanyumu stratejik ve kritik bir malzeme olarak belirledi ve stokladı.<ref name="acs" /> |
|||
İki tane önemli bileşiği vardır: 1) Germanyum tetraklorür (GeCl<sub>4</sub>): Germanyumun [[klor]] gazı ile yakılmasından elde edilir. [[Karbon tetraklorür]]e benzeyen bir sıvıdır. 2) Germanyum -4-oksit (GeO<sub>2</sub>) olup, yüksek sıcaklıkta germanyumun [[oksitlenme]]siyle elde edilir. Germanyumun birçok organik bileşikleri de yapılmıştır. |
|||
Germanyum arzı kullanılabilir kaynakların mevcudiyeti ile sınırlı olması bakımından silikondan farklıdır.Silikon sıradan kum ve [[Kuvars|kuvarstan]] geldiğinden, yalnızca üretim kapasitesi ile sınırlıdır. Silisyum 1998'de kg başına 10 dolardan daha ucuza satın alınabilirken, germanyumun fiyatı kg başına neredeyse 800 dolardı.<ref name="acs">{{Haber kaynağı|url=http://pubs.acs.org/cen/80th/print/germanium.html|başlık=Germanium|erişimtarihi=2008-08-22|arşivtarihi=2008-05-13|arşivurl=https://web.archive.org/web/20080513180858/http://pubs.acs.org/cen/80th/print/germanium.html|yazarlar=Halford|çalışma=Chemical & Engineering News|yayıncı=American Chemical Society|yıl=2003|ilk=Bethany}}</ref> |
|||
== Kullanıldığı yerler == |
|||
== Özellikler == |
|||
Germanyum 1945’ten itibaren çok önem kazanmaya başladı. Yarı metal olan germanyum, yarı iletkendir, yani [[Elektriksel iletkenlik|elektriksel iletkenliği]] [[metal]] ile [[ametaller]] arasındadır. Saf germanyum, düşük sıcaklıklarda yalıtkan, oda sıcaklığında zayıf iletken gibi hareket eder. Bu özelliklerinden dolayı elektronik sanayi için önemli elementtir. Germanyumlu aletler, vakum tüplerinin yerini aldı. Germanyum ile [[transistör]]lü aletler yaygın kullanma alanı bulmuştur. [[Diyot]]larda kullanılır. [[Transistör]] ve [[diyot]]lar, basit ve uzun ömürlü aletler olup, düşük güç kullanırlar ve az ısı yayarlar. Isıtılacak bir flaman olmadığı için, hemen devreye girerler. Germanyum 1960’ların sonuna doğru gayeye en uygun ve ucuz olduğu için [[radyo]] ve diğer ses iletim cihazlarında, yüksek [[voltaj]] ve yüksek güç kapasitesine sahip olduğundan da [[televizyon]] ve [[bilgisayar]]larda kullanılmaya başlanılmıştır. |
|||
[[Sıcaklık ve basınç için standart koşullar|Standart koşullar]] altında, germanyum kırılgan, gümüşi beyaz, yarı metalik bir elementtir.<ref name="nbb">{{Kitap kaynağı|başlık=Nature's Building Blocks|tarih=2001|sayfalar=506–510|yer=Oxford|yayıncı=Oxford University Press|isbn=978-0-19-850341-5|ilk=John}}</ref> Bu form'', a-germanium'' olarak bilinen, metalik bir parlaklığa ve [[Elmas|elmasla]] aynı elmas kübik kristal yapıya sahip bir [[allotrop]] oluşturur.<ref name="usgs">{{Akademik dergi kaynağı|url=http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|başlık=Germanium – Statistics and Information|erişimtarihi=2008-08-28|arşivtarihi=2008-09-16|arşivurl=https://web.archive.org/web/20080916115005/http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|yazarlar=U.S. Geological Survey|çalışma=U.S. Geological Survey, Mineral Commodity Summaries|alıntı=Select 2008|yıl=2008|citeseerx=live}}</ref> Kristal formda iken, germanyum yer değiştirme eşik enerjisine sahiptir. <math>19.7^{+0.6}_{-0.5}~\text{eV}</math>.<ref>{{Akademik dergi kaynağı|başlık=Energy loss due to defect formation from 206Pb recoils in SuperCDMS germanium detectors|yazarlar=Agnese|tarih=2018-08-27|sayı=9|sayfalar=092101|çalışma=Applied Physics Letters|cilt=113|issn=0003-6951|doi=10.1063/1.5041457|arxiv=1805.09942}}</ref> 120 [[Bar (birim)|kbar'ın]] üzerindeki basınçlarda, germanyum, β- [[kalay]] ile aynı yapıya sahip allotrop ''β-germanyum'' haline gelir.<ref name="HollemanAF">{{Kitap kaynağı|başlık=Lehrbuch der Anorganischen Chemie|tarih=2007|yayıncı=de Gruyter|seri=102nd|isbn=978-3-11-017770-1|oclc=145623740|ilk=A. F.|yazar3=Wiberg, E.|yazar4=Wiberg, N.}}</ref> Silisyum, [[galyum]], [[bizmut]], [[antimon]] ve [[su]] gibi, germanyum da erimiş halde katılaştıkça (yani [[Donma|donarken]]) genleşen az sayıdaki maddeden biridir.<ref name="HollemanAF" /> |
|||
Germanyum, kristal silisyum gibi [[Doğrudan ve dolaylı bant aralığı|dolaylı bir bant aralığına]] sahip bir [[Yarı iletken|yarı iletkendir]]. Bölge arıtma teknikleri, yarı iletkenler için 10<sup>10'</sup> yalnızca bir parça safsızlığa sahip kristal germanyum üretimine yol açmıştır,<ref name="lanl">{{Web kaynağı|url=http://periodic.lanl.gov/32.shtml|başlık=Germanium|erişimtarihi=2008-08-28|arşivtarihi=2011-06-22|arşivurl=https://web.archive.org/web/20110622065850/http://periodic.lanl.gov/32.shtml|yayıncı=Los Alamos National Laboratory}}</ref> bu onu şimdiye kadar elde edilen en saf malzemelerden biri yapmaktadır.<ref> |
|||
Germanyum [[diyot]]ları ince disk şeklinde ve çok ince telden ibarettir. Bunlar birbirlerine birleştirilir. Bir [[plastik]] içine konularak ısı ve [[nem]]den korunur. Bu bütün düzen bir [[Mısır (bitki)|mısır]] tanesi büyüklüğündedir. [[Transistör]]lerin, işitme cihazları gibi cihazlarda çok faydalı oldukları ortaya konmuştur. [[Bilgisayar]]larla [[transistör]]lerin kullanılması basitleşmiş, aynı zamanda yaygınlaşmıştır. |
|||
{{Kitap kaynağı|başlık=The Primordial Universe: 28 June – 23 July 1999|kısım=Dark Matter: Direct Detection|tarih=2001|sayfa=308|yayıncı=Springer|isbn=978-3-540-41046-1|editör2=Binetruy, B|yazar=Chardin, B.}}</ref> Son derece güçlü bir [[Elektromanyetik alan|elektromanyetik alanın]] varlığında [[Süperiletkenlik|süper iletken]] olduğu keşfedilen (2005'te) ilk metalik malzeme , germanyum, uranyum ve rodyum alaşımıydı.<ref> |
|||
{{Akademik dergi kaynağı|başlık=Magnetic field-induced superconductivity in the ferromagnet URhGe|yazarlar=Lévy|tarih=August 2005|sayı=5739|sayfalar=1343–1346|çalışma=Science|cilt=309|pmid=16123293|doi=10.1126/science.1115498}}</ref> |
|||
Saf germanyumun, ''germanyum bıyıkları'' olarak anılan çok uzun [[Dislokasyon|vida dislokasyon]]<nowiki/>larını kendiliğinden ekstrüde ettiği bilinmektedir. Bu bıyıkların büyümesi, germanyumdan yapılan eski diyotlar ve transistörlerin arızalanmasının birincil nedenlerinden biridir, çünkü sonunda [[kısa devre]] yapabilirler.<ref>{{Akademik dergi kaynağı|başlık=Morphology of Germanium Whiskers|yazarlar=Givargizov|sayı=1–3|sayfalar=37–41|çalışma=Kristall und Technik|yıl=1972|cilt=7|doi=10.1002/crat.19720070107|ilk=E. I.}}</ref> |
|||
Germanyum normal ışığa karşı şeffaf olmadığı hâlde, [[kızılötesi]] ışınlara karşı şeffaftır. Yüksek kırılma indisine sahip olan germanyum, optik elemanların yapılmasında kullanılır. Camlarda [[silisyum]] muhtevası, kısmen veya tamamen germanyum dioksitle değiştirilerek, optik aletlerin özelliklerini değiştirmek mümkündür. |
|||
=== Kimya === |
|||
Yüksek [[kırılma indisi]]ne sahip camlar, büyük açı kamera merkezlerinde, [[mikroskop]] objektiflerinde kullanılır. Germanyumlu camların kimyasal dirençleri de yüksektir. Isı şoklarına karşı dayanıklıdır. 400 °C’nin altında yumuşamazlar; erime dereceleri yaklaşık 1500 °C civarındadır. Kimyasal davranışları [[karbon]]unkine benzer. Bu sebeple organik bileşikleri, bir seri araştırma konusu olmuştur. Germanyumun, su gibi, donma noktası altında hacmi genişler. Alaşımlarında da bu özellik görülür. |
|||
Elemental germanyum yaklaşık 250 °C de havada yavaşça oksitlenmeye başlayarak GeO<nowiki><sub id="mwAT8">2</sub></nowiki> oluşturuyor.<ref>{{Akademik dergi kaynağı|başlık=KRXPS study of the oxidation of Ge(001) surface|yazarlar=Tabet, N|tarih=1998|sayı=1–4|sayfalar=275–282|çalışma=Applied Surface Science|cilt=134|doi=10.1016/S0169-4332(98)00251-7}}</ref> Germanyum seyreltik [[Asit|asitler]] ve [[Alkali|alkalilerde]] çözünmez, ancak sıcak konsantre sülfürik ve nitrik asitlerde yavaşça çözünür ve erimiş alkalilerle şiddetli reaksiyona girerek germanatlar üretir ( {{Chem|[GeO|3|]|2−}}). Germanyumun birçok +2 bileşiği bilinmesine rağmen çoğunlukla +4 [[Yükseltgenme durumu|oksidasyon durumunda]] oluşur. Diğer oksidasyon durumları nadirdir: Ge<sub>2</sub>Cl<sub>6</sub> gibi bileşiklerde +3, oksitlerin yüzeyinde +3 ve +1 bulunur,<ref>{{Akademik dergi kaynağı|başlık=XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates|yazarlar=Tabet, N|tarih=1999|sayfalar=233–238|çalışma=Journal of Electron Spectroscopy and Related Phenomena|cilt=101–103|doi=10.1016/S0368-2048(98)00451-4}}</ref> veya germanitlerde negatif oksidasyon durumları bulunabilir; örneğin {{Chem|Mg|2|Ge}} -4 de olduğu gibi. |
|||
Ge<sub>4</sub><sup>2−</sup>, Ge<sub>9</sub><sup>4−</sup>, Ge<sub>9</sub><sup>2−</sup>, [(Ge<sub>9</sub>)<sub>2</sub>]<sup>6−</sup> gibi Germanyum küme anyonları ([[Zintl Fazı|Zintl]] iyonları), sıvı amonyak içinde alkali metaller ve germanyum içeren alaşımlardanetilendiamin veya bir kriptandın varlığında ekstraksiyon yoluyla hazırlanmıştır.<ref name="Greenwood">{{Greenwood&Earnshaw}}</ref><ref>{{Akademik dergi kaynağı|başlık=Oxidative Coupling of Deltahedral [Ge<sub>9</sub>]<sup>4−</sup> Zintl Ions|yazarlar=Xu|tarih=1999|sayı=39|sayfalar=9245–9246|çalışma=J. Am. Chem. Soc.|cilt=121|doi=10.1021/ja992269s}}</ref> |
|||
== Toksisite == |
|||
Germanyumun neden olduğu sağlık hasarı, insanlarda [1] [2] [3], germanyum bileşiklerinin gıda takviyesi olarak uzun süreli alımından sonra birkaç kez meydana geldi. Bu, hasta için ölümcül olabilen (geri döndürülemez [2]) böbrek yetmezliğine [3] kadar böbreklerde fonksiyonel bozukluklara yol açabilir. [3] Periferik nöropati ve ikincil hastalık olarak diğer nörolojik hasarlar da bildirilmiştir. [4] [1] |
|||
İki germanyum [[Oksit|oksidi]] bilinmektedir: germanyum dioksit ({{Chem|GeO|2}}) ve germanyum monoksit, ({{Chem|GeO}}).<ref name="HollemanAF">{{Kitap kaynağı|başlık=Lehrbuch der Anorganischen Chemie|tarih=2007|yayıncı=de Gruyter|seri=102nd|isbn=978-3-11-017770-1|oclc=145623740|ilk=A. F.|yazar3=Wiberg, E.|yazar4=Wiberg, N.}}</ref> Dioksit, GeO<sub>2</sub>, germanyum disülfidin ({{Chem|GeS|2}}) kavrulmasıyla elde edilebilir ve suda çok az çözünen, ancak almanatlar oluşturmak için alkalilerle reaksiyona giren beyaz bir tozdur.<ref name="HollemanAF" /> Monoksit, GeO <sub>2'nin</sub> Ge metali ile yüksek sıcaklıkta reaksiyonuyla elde edilebilir.<ref name="HollemanAF" /> Dioksit (ve ilgili oksitler ve germanatlar), görünür ışık için yüksek bir kırılma indeksine sahip olma, ancak [[kızılötesi]] ışığa karşı şeffaflık gibi alışılmadık bir özellik sergiler.<ref>{{Akademik dergi kaynağı|başlık=Infrared Transparent Germanate Glass-Ceramics|yazarlar=Bayya|tarih=2002|sayı=12|sayfalar=3114–3116|çalışma=Journal of the American Ceramic Society|cilt=85|doi=10.1111/j.1151-2916.2002.tb00594.x|ilk=Shyam S.|yazar3=Sanghera, Jasbinder S.|yazar4=Aggarwal, Ishwar D.}}</ref><ref>{{Akademik dergi kaynağı|başlık=Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products|yazarlar=Drugoveiko|tarih=1975|sayı=2|sayfalar=191–193|çalışma=Journal of Applied Spectroscopy|cilt=22|doi=10.1007/BF00614256}}</ref> [[Sintilatör]] olarak Bismut germanate, Bi<sub>4</sub> Ge<sub>3</sub>O<sub>12</sub> kullanılmaktadır.<ref name="BGO">{{Akademik dergi kaynağı|başlık=A Bismuth Germanate-Avalanche Photodiode Module Designed for Use in High Resolution Positron Emission Tomography|yazarlar=Lightstone|tarih=1986|sayı=1|sayfalar=456–459|çalışma=IEEE Transactions on Nuclear Science|cilt=33|doi=10.1109/TNS.1986.4337142|ilk=A. W.|yazar3=McIntyre, R. J.|yazar4=Lecomte, R.}}</ref> |
|||
Hayvan deneylerinden germanyumun düşük akut oral toksisiteye sahip olduğu bilinmektedir. Sıçanlarda LD50 değeri (test hayvanlarının yarısının öldüğü doz) vücut ağırlığının kilogramı başına 3700 mg'dır. [4] |
|||
Diğer [[Kalkojen|kalkojenlerle]] Di [[Sülfür|sülfit]] ( {{Chem|GeS|2}}) gibi ikili bileşikler de bilinmektedir; {{Chem|GeS|2}} ve di selenid ({{Chem|GeSe|2}}) ve monosülfit (GeS), monoselenit (GeSe) ve mono tellür (GeTe). GeS<sub>2,</sub> hidrojen sülfür Ge(IV) içeren güçlü asit çözeltilerinden geçirildiğinde beyaz bir çökelti olarak oluşur.<ref name="Greenwood">{{Greenwood&Earnshaw}}</ref> Disülfit, suda ve kostik alkali veya alkalin sülfitlerin çözeltilerinde önemli ölçüde çözünür. Bununla birlikte, Winkler'in elementi keşfetmesine izin veren asidik suda çözünmez.<ref>{{Akademik dergi kaynağı|başlık=Germanium and its Inorganic Compounds|yazarlar=Johnson|tarih=1952|sayı=3|sayfalar=431–469|çalışma=Chem. Rev.|cilt=51|doi=10.1021/cr60160a002|ilk=Otto H.}}</ref> Disülfitin bir [[hidrojen]] akımında ısıtılmasıyla, koyu renkli ve metalik parlaklığa sahip ince plakalarda süblimleşen ve kostik alkalilerin çözeltilerinde çözünen monosülfür (GeS) oluşur.<ref name="HollemanAF">{{Kitap kaynağı|başlık=Lehrbuch der Anorganischen Chemie|tarih=2007|yayıncı=de Gruyter|seri=102nd|isbn=978-3-11-017770-1|oclc=145623740|ilk=A. F.|yazar3=Wiberg, E.|yazar4=Wiberg, N.}}</ref> [[Alkali metal|Alkalin karbonatlar]] ve [[kükürt]] ile eritildiğinde, germanyum bileşikleri, tiyogermanatlar olarak bilinen tuzları oluşturur.<ref>{{Akademik dergi kaynağı|başlık=First synthesis of mesostructured thiogermanates|yazarlar=Fröba|tarih=1997|sayı=18|sayfalar=1729–1730|çalışma=Chemical Communications|doi=10.1039/a703634e}}</ref> |
|||
Şu anda hayvan deneylerinden elde edilen verilere göre, germanyum ne teratojenik ne de kanserojen. [4] |
|||
[[Dosya:Germane-2D-dimensions.png|alt=Skeletal chemical structure of a tetrahedral molecule with germanium atom in its center bonded to four hydrogen atoms. The Ge-H distance is 152.51 picometers.|sol|küçükresim| Germane [[Metan|metana]] benzer.]] |
|||
Dört tetra [[halojenür]] bilinmektedir. Normal şartlar altında GeI<sub>4</sub> katı, GeF<sub>4</sub> gaz ve diğerleri uçucu sıvılardır. Örneğin, germanyum tetraklorür, 83.1'°Cde metali klor ile ısıtarak kaynayan renksiz, dumanlı bir sıvı olarak elde edilir.<ref name="HollemanAF">{{Kitap kaynağı|başlık=Lehrbuch der Anorganischen Chemie|tarih=2007|yayıncı=de Gruyter|seri=102nd|isbn=978-3-11-017770-1|oclc=145623740|ilk=A. F.|yazar3=Wiberg, E.|yazar4=Wiberg, N.}}</ref> Tüm tetrahalidler kolayca hidratlı germanyum dioksite hidrolize edilir.<ref name="HollemanAF" /> GeCl<sub>4</sub> organogermanyum bileşiklerinin üretiminde kullanılır. Dört dihalidin tümü bilinmektedir ve tetrahalidlerin aksine polimerik katılardır.<ref name="Greenwood" /> Ek olarak Ge<sub>2</sub>Cl<sub>6</sub> ve Ge<sub>''n''</sub>Cl<sub>2''n''+2</sub> formülünün bazı daha yüksek bileşikleri bilinmektedir.<ref name="HollemanAF" /> [[Neopentan]] yapıya sahip Ge<sub>5</sub>Cl<sub>12</sub> birimini içeren sıra dışı bileşik Ge<sub>6</sub>Cl<sub>16</sub> hazırlanmıştır.<ref>{{Akademik dergi kaynağı|başlık=The Crystal Structure and Raman Spectrum of Ge<sub>5</sub>Cl<sub>12</sub>·GeCl<sub>4</sub> and the Vibrational Spectrum of Ge<sub>2</sub>Cl<sub>6</sub>|yazarlar=Beattie|tarih=1998|sayı=23|sayfalar=6032–6034|çalışma=Inorg. Chem.|cilt=37|pmid=11670739|doi=10.1021/ic9807341|ilk=I.R.|yazar3=Jones, P.J.|yazar4=Reid, G.}}</ref> |
|||
Germane (GeH<sub>4</sub>), yapı olarak [[Metan|metana]] benzer bir bileşiktir. Beşe kadar germanyum atomu içeren Ge<sub>''n''</sub>H<sub>2 ''n''+2</sub> formülüne sahip [[Alkan|alkanlara]] benzer bileşikler olan poligermanlar bilinmektedir. GeH<sub>4</sub> sıvı amonyak içinde alkali metallerle reaksiyona girerek GeH<nowiki><sub id="mwAck">3</sub></nowiki><nowiki><sup id="mwAco">-</sup></nowiki> [[İyon|anyonu]] içeren beyaz kristal MGeH<sub>3</sub> oluşturur.<ref name="Greenwood" /> Bir, iki ve üç halojen atomlu germanyum hidrohalojenürler renksiz reaktif sıvılardır.<ref name="Greenwood" /> |
|||
Germanyumun toksisite mekanizması henüz tam olarak anlaşılmamıştır. Bununla birlikte, farklı hücrelerin mitokondrileri üzerinde spesifik patolojik etkiler gözlendi.{{Germanyum bileşikleri}}[https://pubmed.ncbi.nlm.nih.gov/8488824/ 1 https://pubmed.ncbi.nlm.nih.gov/8488824/] {{Webarşiv|url=https://web.archive.org/web/20210426121739/https://pubmed.ncbi.nlm.nih.gov/8488824/ |tarih=26 Nisan 2021 }} |
|||
[[Dosya:NucleophilicAdditionWithOrganogermanium.png|alt=Skeletal chemical structures outlining an additive chemical reaction including an organogermanium compound.|sağ|küçükresim| Bir organogermanyum bileşiği ile [[Nükleofil|nükleofilik]] ekleme.]] |
|||
İlk organogermanyum bileşiği, 1887'de Winkler tarafından sentezlendi; germanyum tetraklorürün dietilçinko ile reaksiyonu tetraetilgerman verdi ( {{Chem|Ge(C|2|H|5|)|4}}.<ref name="Winkle2">{{Akademik dergi kaynağı|url=http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f183.table|başlık=Mittheilungen über des Germanium. Zweite Abhandlung|erişimtarihi=2008-08-20|arşivtarihi=2012-11-03|arşivurl=https://web.archive.org/web/20121103012004/http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f183.table|yazarlar=Winkler|tarih=1887|sayı=1|dil=de|sayfalar=177–209|çalışma=J. Prak. Chemie|cilt=36|doi=10.1002/prac.18870360119|ilk=Clemens|citeseerx=live}}</ref> Tetrametilgerman gibi R<sub>4</sub>Ge (burada R bir [[Alkil|alkildir]] ) tipindeki organogermanlar {{Chem|Ge(CH|3|)|4}} ve tetraetilgermana mevcut en ucuz germanyum öncüsü germanyum tetraklorür ve alkil nükleofiller yoluyla erişilir. İzobütilgerman {{Chem|(CH|3|)|2|CHCH|2|GeH|3}} gibi organik germanyum hidritlerin daha az tehlikeli [[yarı iletken]] uygulamalarında zehirli German gazı yerine kullanılabileceği bulunmuştur. Birçok germanyum reaktif ara ürünü bilinmektedir: [[Ornatık|germil]] [[Radikal (kimya)|serbest radikalleri]], germilenler ( karbenlere benzer) ve germynes (karbinlere benzer).<ref>{{Akademik dergi kaynağı|başlık=Reactive intermediates in organogermanium chemistry|yazarlar=Satge|tarih=1984|sayı=1|sayfalar=137–150|çalışma=Pure Appl. Chem.|cilt=56|doi=10.1351/pac198456010137|ilk=Jacques}}</ref><ref>{{Akademik dergi kaynağı|başlık=Organogermanium Chemistry|yazarlar=Quane|tarih=1963|sayı=4|sayfalar=403–442|çalışma=Chemical Reviews|cilt=63|doi=10.1021/cr60224a004|ilk=Denis|yazar3=Bottei, Rudolph S.}}</ref> Organogermanyum bileşiği 2-karboksietilgermaseskuioksan ilk olarak 1970'lerde rapor edildi ve bir süre besin takviyesi olarak kullanıldı ve muhtemelen anti-tümör niteliklere sahip olduğu düşünülüyordu.<ref name="toxic">{{Akademik dergi kaynağı|url=https://zenodo.org/record/1229957|başlık=Hazard Assessment of Germanium Supplements|erişimtarihi=2019-06-30|arşivtarihi=2020-03-10|arşivurl=https://web.archive.org/web/20200310041729/https://zenodo.org/record/1229957|yazarlar=Tao|tarih=June 1997|sayı=3|sayfalar=211–219|çalışma=[[Regulatory Toxicology and Pharmacology]]|cilt=25|pmid=9237323|doi=10.1006/rtph.1997.1098|ilk=S. H.|yazar3=Bolger, P. M.|citeseerx=live}}</ref> |
|||
Germanyum Eind adlı bir ligand (1,1,3,3,5,5,7,7-oktaetil-s-hidrindasen-4-il) kullanarak oksijenle çift bağ (germanon) oluşturabilir. Germanyum hidrit ve germanyum tetrahidrit hava ile karıştırıldığında çok yanıcı ve hatta patlayıcıdır.<ref>{{Haber kaynağı|url=http://www.rsc.org/chemistryworld/News/2012/March/germanone-germanium-oxygen-double-bond-created.asp|başlık=Germanium-oxygen double bond takes centre stage|erişimtarihi=2014-05-15|arşivtarihi=2014-05-17|arşivurl=https://web.archive.org/web/20140517121351/http://www.rsc.org/chemistryworld/News/2012/March/germanone-germanium-oxygen-double-bond-created.asp|yazarlar=Broadwith|tarih=25 March 2012|çalışma=Chemistry World|ilk=Phillip}}</ref> |
|||
2 https://pubmed.ncbi.nlm.nih.gov/1726409/ {{Webarşiv|url=https://web.archive.org/web/20210426121739/https://pubmed.ncbi.nlm.nih.gov/1726409/ |tarih=26 Nisan 2021 }} |
|||
=== İzotoplar === |
|||
3 https://pubmed.ncbi.nlm.nih.gov/1650857/ {{Webarşiv|url=https://web.archive.org/web/20210426121739/https://pubmed.ncbi.nlm.nih.gov/1650857/ |tarih=26 Nisan 2021 }} |
|||
Germanyum 5 doğal [[izotop]]<nowiki/>ta bulunur: <sup>70</sup>Ge, <sup>72</sup>Ge, <sup>73</sup>Ge, <sup>74</sup>Ge ve <sup>76</sup>Ge. Bunlardan <sup>76</sup>Ge çok az radyoaktiftir, [[Yarı ömür|yarı ömrü]] 1.78×10<sup>21</sup> yıl olan çift beta bozunmasıyla bozunur. <sup>74</sup>Ge yaklaşık %36 [[Doğal bolluk|doğal bolluğa]] sahip en yaygın izotoptur. <sup>76</sup>Ge yaklaşık %7 doğal bolluk ile en az yaygın olanıdır. <sup>72</sup>Ge, |
|||
Alfa parçacıkları ile bombardıman edildiğinde, istikrarlı <sup>77</sup>Se üretir ve süreçte yüksek enerjili elektronlar serbest bırakır.<ref name="72Ge" /> Bu nedenle nükleer piller için [[radon]] ile birlikte kullanılır.<ref name="72Ge">Perreault, Bruce A. [http://www.google.com/patents/US7800286 "Alpha Fusion Electrical Energy Valve"], US Patent 7800286, issued September 21, 2010. </ref> |
|||
4 [https://www.baua.de/DE/Angebote/Rechtstexte-und-Technische-Regeln/Regelwerk/TRGS/pdf/900/900-germanium.pdf?__blob=publicationFile&v=2 https://www.baua.de/] {{Webarşiv|url=https://web.archive.org/web/20210426121750/https://www.baua.de/DE/Angebote/Rechtstexte-und-Technische-Regeln/Regelwerk/TRGS/pdf/900/900-germanium.pdf?__blob=publicationFile&v=2 |tarih=26 Nisan 2021 }}{{Otorite kontrolü}} |
|||
Atom kütlesi 58 ila 89 arasında değişen en az 27 [[Radyonüklit|radyoizotop]] da sentezlendi. Bunlardan en kararlı olanı <sup>68</sup>Ge, {{Değer|270.95}} gün yarı ömürlü, [[Elektron yakalanması|elektron yakalama]] ile bozunur. En az kararlıyarı ömrü {{Değer|30}}ms olan <sup>60</sup>Ge'tır. Germanyumun radyoizotoplarının çoğu [[Beta bozunması|beta bozunmasıyla]] bozunurken <sup>61</sup>Ge ve <sup>64</sup>Ge gecikmiş [[Pozitron emisyonu|{{Atomaltı parçacık|beta+}}]]<nowiki/>bozunur. <sup>84</sup>Ge den <sup>87</sup>Ge'ye izotoplar ayrıca minör [[Beta bozunması|{{Atomaltı parçacık|beta-}}]] gecikmeli [[Nötron emisyonu|nötron emisyon]] bozunma yolları sergiler.<ref name="nubase">{{NUBASE 2003}}</ref> |
|||
=== Varlığı === |
|||
[[Dosya:Renierit.JPG|alt=A brown block of irregular shape and surface, about 6 cm in size.|küçükresim| Renierit]] |
|||
Germanyum, [[yıldız nükleosentezi]] tarafından, çoğunlukla [[Asimptotik dev kol|asimptotik dev dal]] yıldızlarında s-işlemi tarafından oluşturulur. S süreci, titreşen [[kırmızı dev]] yıldızların içindeki daha hafif elementlerin yavaş bir [[nötron]] yakalamasıdır.<ref name="sterling">{{Akademik dergi kaynağı|başlık=Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer|yazarlar=Sterling|sayı=1|sayfalar=L55–L58|çalışma=The Astrophysical Journal Letters|yıl=2002|cilt=578|doi=10.1086/344473|ilk=N. C.|yazar3=Dinerstein, Harriet L.|yazar4=Bowers, Charles W.|arxiv=astro-ph/0208516}}</ref> Germanyum en uzak yıldızların bazılarıyla<ref>{{Akademik dergi kaynağı|başlık=Astronomy: Elements of surprise|yazarlar=Cowan|tarih=2003-05-01|sayı=29|sayfa=29|çalışma=Nature|cilt=423|pmid=12721614|doi=10.1038/423029a|ilk=John}}</ref> Jüpiter'in atmosferinde tespit edilmiştir. <ref>{{Akademik dergi kaynağı|başlık=The tropospheric gas composition of Jupiter's north equatorial belt /NH<sub>3</sub>, PH<sub>3</sub>, CH<sub>3</sub>D, GeH<sub>4</sub>, H<sub>2</sub>O/ and the Jovian D/H isotopic ratio|yazarlar=Kunde|tarih=1982|sayfalar=443–467|çalışma=Astrophysical Journal|cilt=263|doi=10.1086/160516|ilk=V.|yazar3=Hanel, R.|yazar4=Maguire, W.}}</ref> |
|||
Germanyumun [[Kimyasal elementlerin Dünya'nın yerkabuğundaki bollukları|yer kabuğundaki]] bolluğu yaklaşık olarak 1.6'ppmdir.<ref name="Holl">{{Akademik dergi kaynağı|başlık=Metallogenesis of germanium – A review|yazarlar=Höll|tarih=2007|sayı=3–4|sayfalar=145–180|çalışma=Ore Geology Reviews|cilt=30|doi=10.1016/j.oregeorev.2005.07.034|ilk=R.|yazar3=Kling, M.|yazar4=Schroll, E.}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFHöllKling,_M.Schroll,_E.2007">Höll, R.; Kling, M.; Schroll, E. (2007). </cite></ref> Arjirodit, briartit, germanit, renierit ve sfalerit gibi sadece birkaç mineral önemli miktarda germanyum içerir.<ref name="usgs">{{Akademik dergi kaynağı|url=http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|başlık=Germanium – Statistics and Information|erişimtarihi=2008-08-28|arşivtarihi=2008-09-16|arşivurl=https://web.archive.org/web/20080916115005/http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|yazarlar=U.S. Geological Survey|çalışma=U.S. Geological Survey, Mineral Commodity Summaries|alıntı=Select 2008|yıl=2008|citeseerx=live}}<cite class="citation journal cs1" data-ve-ignore="true" id="CITEREFU.S._Geological_Survey2008">U.S. Geological Survey (2008). </cite></ref><ref>{{Akademik dergi kaynağı|url=https://www.researchgate.net/publication/309583931|başlık=The distribution of gallium, germanium and indium in conventional and non-conventional resources – Implications for global availability (PDF Download Available)|erişimtarihi=2017-06-10|arşivtarihi=2018-10-06|arşivurl=https://web.archive.org/web/20181006235214/https://www.researchgate.net/publication/309583931|yazarlar=Frenzel|çalışma=ResearchGate|yayıncı=Unpublished|yıl=2016|doi=10.13140/rg.2.2.20956.18564|citeseerx=live}}</ref> Sadece çok azı (özellikle germanit) çok nadiren kazılabilir miktarlarda bulunur.<ref>{{Akademik dergi kaynağı|url=https://www.researchgate.net/publication/250273740|başlık=Eyselite, Fe3+Ge34+O7(OH), a new mineral species from Tsumeb, Namibia|yazarlar=Roberts|tarih=December 2004|yazarları-göster=etal|sayı=6|sayfalar=1771–1776|çalışma=The Canadian Mineralogist|cilt=42|doi=10.2113/gscanmin.42.6.1771}}</ref><ref>{{Web kaynağı|url=https://www.deutsche-rohstoffagentur.de/DERA/DE/Downloads/vortrag_germanium.pdf?__blob=publicationFile&v=2|başlık=Archived copy|erişimtarihi=2018-10-06|arşivtarihi=2018-10-06|arşivurl=https://web.archive.org/web/20181006234914/https://www.deutsche-rohstoffagentur.de/DERA/DE/Downloads/vortrag_germanium.pdf?__blob=publicationFile&v=2}}</ref><ref>{{Web kaynağı|url=http://tupa.gtk.fi/raportti/arkisto/070_peh_76.pdf|başlık=Archived copy|erişimtarihi=2018-10-06|arşivtarihi=2020-03-20|arşivurl=https://web.archive.org/web/20200320190457/http://tupa.gtk.fi/raportti/arkisto/070_peh_76.pdf}}</ref> Bazı çinko-bakır-kurşun cevher gövdeleri, nihai cevher konsantresinden ekstraksiyonu haklı çıkarmaya yetecek kadar germanyum içerir.<ref name="Holl" /> Alışılmadık bir doğal zenginleştirme işlemi[[Victor Goldschmidt|, Victor Moritz Goldschmidt]] tarafından germanyum yatakları için yapılan geniş bir araştırma sırasında keşfedilen bazı kömür damarlarında yüksek bir germanyum içeriğine neden olur.<ref name="Gold1">{{Akademik dergi kaynağı|url=http://resolver.sub.uni-goettingen.de/purl?GDZPPN002508303|başlık=Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten|erişimtarihi=2008-08-25|arşivtarihi=2018-03-03|arşivurl=https://web.archive.org/web/20180303165042/http://resolver.sub.uni-goettingen.de/purl?GDZPPN002508303|yazarlar=Goldschmidt|tarih=1930|sayfalar=141–167|çalışma=Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse|ilk=V. M.|citeseerx=live}}</ref><ref name="Gold2">{{Akademik dergi kaynağı|url=http://resolver.sub.uni-goettingen.de/purl?GDZPPN002509180|başlık=Zur Geochemie des Germaniums|erişimtarihi=2008-08-25|arşivtarihi=2008-12-01|arşivurl=https://web.archive.org/web/20081201115130/http://resolver.sub.uni-goettingen.de/purl/?GDZPPN002509180|yazarlar=Goldschmidt|tarih=1933|sayfalar=141–167|çalışma=Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse|ilk=V. M.|yazar3=Peters, Cl.|citeseerx=live}}</ref> Şimdiye kadar bulunan en yüksek konsantrasyon, %1,6 oranında germanyum içeren Hartley kömür külündeydi.<ref name="Gold1" /><ref name="Gold2" /> [[İç Moğolistan]], [[Xilinhot|Xilinhaote]] yakınlarındaki kömür yatakları tahminen 1600 [[Ton (birim)|ton]] germanyum barındırıryor.<ref name="Holl" /> |
|||
== Üretim == |
|||
2011 yılında dünya çapında, çoğunlukla Çin (80 ton), Rusya (5 ton) ve Amerika Birleşik Devletleri'nde (3 ton)olmak üzere yaklaşık 118 [[Ton (birim)|ton]] germanyum üretildi.<ref name="usgs">{{Akademik dergi kaynağı|url=http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|başlık=Germanium – Statistics and Information|erişimtarihi=2008-08-28|arşivtarihi=2008-09-16|arşivurl=https://web.archive.org/web/20080916115005/http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|yazarlar=U.S. Geological Survey|çalışma=U.S. Geological Survey, Mineral Commodity Summaries|alıntı=Select 2008|yıl=2008|citeseerx=live}}</ref> Germanyum, %0,3'e varan oranlarda yoğunlaştığı sfalerit [[çinko]] cevherlerinden,<ref>{{Akademik dergi kaynağı|başlık=Germanium geochemistry and mineralogy|yazarlar=Bernstein, L|tarih=1985|sayı=11|sayfalar=2409–2422|çalışma=Geochimica et Cosmochimica Acta|cilt=49|doi=10.1016/0016-7037(85)90241-8}}</ref> özellikle düşük sıcaklıkta tortu barındıran, masif [[Çinko|Zn]] – [[Kurşun|Pb]] – [[Bakır|Cu]] (– [[Baryum|Ba]] ) yatakları ve karbonatlı Zn-Pb depozitlerden bir yan ürün olarak geri kazanılır.<ref>{{Akademik dergi kaynağı|başlık=Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis|yazarlar=Frenzel|tarih=July 2016|sayfalar=52–78|çalışma=Ore Geology Reviews|cilt=76|doi=10.1016/j.oregeorev.2015.12.017}}</ref> Yakın zamanda yapılan bir araştırma, bilinen çinko rezervlerinde, özellikle Mississippi-Valley tipi yataklarda bulunanlarda en az 10.000 ton çıkarılabilir germanyum bulunduğunu, kömür rezervlerinde ise en az 112.000 ton bulunacağını buldu.<ref>{{Akademik dergi kaynağı|başlık=On the geological availability of germanium|yazarlar=Frenzel|tarih=2013-12-29|sayı=4|sayfalar=471–486|çalışma=Mineralium Deposita|cilt=49|issn=0026-4598|doi=10.1007/s00126-013-0506-z}}</ref><ref>{{Akademik dergi kaynağı|başlık=Erratum to: On the geological availability of germanium|yazarlar=Frenzel|tarih=2014-01-19|sayı=4|sayfa=487|çalışma=Mineralium Deposita|cilt=49|issn=0026-4598|doi=10.1007/s00126-014-0509-4}}</ref> 2007'de talebin %35'i geri dönüştürülmüş germanyumdan karşılandı.<ref name="Holl">{{Akademik dergi kaynağı|başlık=Metallogenesis of germanium – A review|yazarlar=Höll|tarih=2007|sayı=3–4|sayfalar=145–180|çalışma=Ore Geology Reviews|cilt=30|doi=10.1016/j.oregeorev.2005.07.034|ilk=R.|yazar3=Kling, M.|yazar4=Schroll, E.}}</ref><div style="float: right; margin: 5px;"> |
|||
{| class="wikitable" style="font-size:85%; text-align:right;" |
|||
! Yıl |
|||
! Fiyatı ( [[Amerikan doları|$]] /kg) <ref>{{Kitap kaynağı|url=http://minerals.usgs.gov/minerals/pubs/commodity/germanium/index.html#mcs|başlık=USGS Minerals Information|erişimtarihi=2013-04-22|arşivtarihi=2013-05-07|arşivurl=https://web.archive.org/web/20130507125723/http://minerals.usgs.gov/minerals/pubs/commodity/germanium/index.html#mcs|tarih=1977|ansiklopedi=U.S. Geological Survey Mineral Commodity Summaries|isbn=978-0-85934-039-7|oclc=16437701|yazar=R.N. Soar}}</ref> |
|||
|- |
|||
| 1999 |
|||
| 1.400 |
|||
|- |
|||
| 2000 |
|||
| 1.250 |
|||
|- |
|||
| 2001 |
|||
| 890 |
|||
|- |
|||
| 2002 |
|||
| 620 |
|||
|- |
|||
| 2003 |
|||
| 380 |
|||
|- |
|||
| 2004 |
|||
| 600 |
|||
|- |
|||
| 2005 |
|||
| 660 |
|||
|- |
|||
| 2006 |
|||
| 880 |
|||
|- |
|||
| 2007 |
|||
| 1.240 |
|||
|- |
|||
| 2008 |
|||
| 1.490 |
|||
|- |
|||
| 2009 |
|||
| 950 |
|||
|- |
|||
| 2010 |
|||
| 940 |
|||
|- |
|||
| 2011 |
|||
| 1.625 |
|||
|- |
|||
| 2012 |
|||
| 1.680 |
|||
|- |
|||
| 2013 |
|||
| 1.875 |
|||
|- |
|||
| 2014 |
|||
| 1.900 |
|||
|- |
|||
| 2015 |
|||
| 1.760 |
|||
|- |
|||
| 2016 |
|||
| 950 |
|||
|- |
|||
| 2017 |
|||
| 1.358 |
|||
|- |
|||
| 2018 |
|||
| 1.300 |
|||
|- |
|||
| 2019 |
|||
| 1.240 |
|||
|- |
|||
| 2020 |
|||
| 1.000 |
|||
|} |
|||
</div> |
|||
== Uygulamalar == |
|||
2007'de dünya çapında germanyumun ana son kullanımlarının şu şekilde olduğu tahmin ediliyor: %35 [[Optik fiber|fiber optik]], %30 kızılötesi optikler, %15 [[polimerizasyon]] katalizörleri ve %15 elektronik ve güneş enerjisi uygulamaları.<ref name="usgs">{{Akademik dergi kaynağı|url=http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|başlık=Germanium – Statistics and Information|erişimtarihi=2008-08-28|arşivtarihi=2008-09-16|arşivurl=https://web.archive.org/web/20080916115005/http://minerals.usgs.gov/minerals/pubs/commodity/germanium/|yazarlar=U.S. Geological Survey|çalışma=U.S. Geological Survey, Mineral Commodity Summaries|alıntı=Select 2008|yıl=2008|citeseerx=live}}</ref> Geri kalan %5 ise fosfor, metalurji ve kemoterapi gibi kullanımlara gitti.<ref name="usgs" /> |
|||
* alman |
|||
* Vitrin |
|||
* transistörün tarihi |
|||
== Referanslar == |
|||
[[Kategori:Germanyum| ]] |
|||
[[Kategori:Elementler]] |
|||
[[Kategori:Yarı metaller]] |
|||
[[Kategori:Optik malzemeler]] |
[[Kategori:Optik malzemeler]] |
||
[[Kategori:Yarı metaller]] |
|||
[[Kategori:Elementler]] |
|||
[[Kategori:Germanyum]] |
|||
[[Kategori:KB1: Jülyen-Miladi belirsizliği]] |
|||
Sayfanın 12.04, 6 Temmuz 2023 tarihindeki hâli
Germanyum; sembolü GE, atom numarası 32 olan kimyasal elementtir. Parlak, sert-kırılgan, grimsi-beyaz ve silikona benzer bir görünümdedir. Silisyum ve kalay komşu grubuna kimyasal olarak benzeyen karbon grubundaki bir metaloiddir. Silikon gibi, germanyum da doğal olarak reaksiyona girer ve doğadaki oksijenle kompleksler oluşturur.
Germanyum yüksek konsantrasyonda nadiren göründüğü için geç keşfedildi. Germanyum, yer kabuğundaki elementlerin göreceli bolluğunda elliye yakın bir yerdedir. 1869'da Dmitri Mendeleev, varlığı ve bazı özelliklerini periyodik tablodaki konumundan tahmin etti ve elementi ekasilicon olarak isimlendirdi. 1886'da Freiberg Üniversitesi'nden Clemens Winkler, argyrodite mineralinde gümüş ve kükürtle birlikte yeni elementi buldu ve elemente ülkesi Almanya'nın adını verdi. Germanyum esas olarak sfaleritten (çinkonun birincil cevheri) çıkarılır, ancak germanyum ticari olarak gümüş, kurşun ve bakır cevherlerinden de geri kazanılır.
Elemental germanyum, transistör ve çeşitli elektronik cihazlarda yarı iletken olarak kullanılır. Tarihsel olarak, yarı iletken elektroniğin ilk on yılı tamamen germanyuma dayanıyordu. Şu anda başlıca kullanımlar, fiber optik, kızılötesi optikler, güneş hücresi uygulamaları ve ışık yayan diyotlar (LED)dır. Germanyum bileşikleri polimerizasyon katalisti olarak kullanılır ve son zamanlarda nanotel üretiminde kullanım alanı bulmuştur. Bu element, organometalik kimyada yararlı olan tetraetilgermanyum gibi çok sayıda organogermanyum bileşiği oluşturur. Germanyum, teknoloji açısından kritik bir element olarak kabul edilir.[1]
Germanyumun canlılık için gerekli bir element olduğu düşünülmemektedir.Doğal olarak oluşan germanyum bileşikleri suda çözünmez olma eğilimindedir ve bu nedenle çok az oral toksisiteye sahiptir. Bununla birlikte, sentetik çözünür germanyum tuzları nefrotoksiktir ve halojenler ve hidrojen içeren sentetik kimyasal olarak reaktif germanyum bileşikleri tahriş edici toksinlerdir.
Tarih

Rus kimyacı Dmitri Mendeleev, 1869'da Kimyasal Elementlerin Periyodik Yasası hakkındaki raporunda, silisyum ve kalay arasında karbon ailesindeki bir boşluğu dolduracak olan bir kimyasal elementin varlığını tahmin etti.[2] Periyodik tablosundaki konumu nedeniyle Mendeleev buna ekasilicon (Es) adını verdi ve atom ağırlığını 70 (daha sonra 72) olarak tahmin etti.
1885'in ortalarında, Saksonya, Freiberg yakınlarındaki bir madende yeni bir mineral keşfedildi ve yüksek gümüş içeriği nedeniyle argyrodite olarak adlandırıldı. Kimyager Clemens Winkler, gümüş, kükürt ve yeni bir elementin birleşimi olduğu kanıtlanan bu yeni minerali analiz etti. Winkler, 1886'da yeni elementi izole edebildi ve onu antimona benzer buldu. Başlangıçta yeni elementin eka-antimon olduğunu düşündü, ancak kısa süre sonra onun bunun yerine eka-silikon olduğuna ikna oldu.[3][4] Winkler, yeni elementle ilgili sonuçlarını yayınlamadan önce, elementine neptünyum adını vermeye karar verdi, çünkü 1846'da Neptün gezegeninin keşfi de benzer şekilde onun varlığına dair önceki matematiksel tahminlerin ardından gelmişti. Bununla birlikte, "neptunium" adı, tahmin edilen başka bir kimyasal elemente zaten verilmişti (bugün 1940'ta keşfedilen neptunium adını taşıyan element değil). Bunun yerine Winkler, anavatanının onuruna yeni elemente germanyum ( Latince Germania kelimesinden) adını verdi.[4] Argyrodite ampirik olarak Ag8GeS6 olduğunu kanıtladı. Bu yeni element, arsenik ve antimon elementleriyle bazı benzerlikler gösterdiğinden, periyodik tablodaki uygun yeri düşünülüyordu, ancak Dmitri Mendeleev'in tahmin ettiği element "ekasilicon" ile benzerlikleri periyodik tablodaki yerini doğruladı.[4][5] Saksonya'daki madenlerden çıkarılan 500'kg'dan fazla malzeme ile Winkler 1887'de yeni elementin kimyasal özelliklerini doğruladı.[3][4][6] Ayrıca saf germanyum tetraklorürü ( GeCl4 analiz ederek 72.32'lik bir atom ağırlığı belirledi. Lecoq de Boisbaudran ise elementin kıvılcım spektrumundaki çizgileri karşılaştırarak 72.3'ü elde etti. [7]
Winkler, flor, klor, sülfür, dioksit bileşikleriyle ilk organogerman olan tetraetilgerman (Ge(C<sub>2</sub>H<sub>5</sub>)<sub>4</sub>) dahil olmak üzere birkaç germanyum bileşiği hazırlayabildi.[3] Mendeleev'in tahminleriyle iyi bir şekilde örtüşen bu bileşiklerden elde edilen fiziksel veriler, keşfi Mendeleyev'in element periyodikliği fikrinin önemli bir teyidi haline getirdi.[3]
Germanyumun 1930'ların sonlarına kadar zayıf iletken bir metal olduğu düşünülüyordu.[8] Germanyum, elektronik yarı iletken olarak özelliklerinin kabul edildiği 1945 sonrasına kadar ekonomik olarak önemli hale gelmedi. İkinci Dünya Savaşı sırasında, çoğu diyot olmak üzere bazı özel elektronik cihazlarda az miktarda germanyum kullanıldı.[9][10] İlk büyük kullanım, Savaş sırasında radar dalga tespiti için nokta temaslı Schottky diyotlarıydı.[8] İlk silikon-germanyum alaşımları 1955'te elde edildi.[11] 1945'ten önce izabe tesislerinde her yıl yalnızca birkaç yüz kilogram germanyum üretiliyordu, ancak 1950'lerin sonunda dünya çapındaki yıllık üretim 40 metrik tona ulaştı.[12]
1948'de germanyum transistörün geliştirilmesi[13] sayısız katı hal elektroniğine kapı açtı.[14] 1950'den 1970'lerin başına kadar, bu alan germanyum için artan bir pazar sağladı, ancak daha sonra transistör, diyot ve doğrultucularda germanyumun yerini yüksek saflıkta silikon almaya başladı.[15] Örneğin, Fairchild Semiconductor olan şirket, 1957'de açık bir şekilde silikon transistörler üretmek amacıyla kuruldu. Silikon üstün elektriksel özelliklere sahiptir, ancak yarı iletken elektroniğin ilk yıllarında ticari olarak elde edilemeyen çok daha fazla saflık gerektirir.[16]
Bu arada, fiber optik iletişim ağları, gece görüş sistemleri ve polimerizasyon katalizörleri için germanyuma olan talep önemli ölçüde arttı.[12] Bu son kullanımlar, 2000 yılında dünya çapındaki germanyum tüketiminin %85'ini temsil ediyordu.[15] ABD hükümeti, germanyumu stratejik ve kritik bir malzeme olarak belirledi ve stokladı.[12]
Germanyum arzı kullanılabilir kaynakların mevcudiyeti ile sınırlı olması bakımından silikondan farklıdır.Silikon sıradan kum ve kuvarstan geldiğinden, yalnızca üretim kapasitesi ile sınırlıdır. Silisyum 1998'de kg başına 10 dolardan daha ucuza satın alınabilirken, germanyumun fiyatı kg başına neredeyse 800 dolardı.[12]
Özellikler
Standart koşullar altında, germanyum kırılgan, gümüşi beyaz, yarı metalik bir elementtir.[17] Bu form, a-germanium olarak bilinen, metalik bir parlaklığa ve elmasla aynı elmas kübik kristal yapıya sahip bir allotrop oluşturur.[15] Kristal formda iken, germanyum yer değiştirme eşik enerjisine sahiptir. .[18] 120 kbar'ın üzerindeki basınçlarda, germanyum, β- kalay ile aynı yapıya sahip allotrop β-germanyum haline gelir.[19] Silisyum, galyum, bizmut, antimon ve su gibi, germanyum da erimiş halde katılaştıkça (yani donarken) genleşen az sayıdaki maddeden biridir.[19]
Germanyum, kristal silisyum gibi dolaylı bir bant aralığına sahip bir yarı iletkendir. Bölge arıtma teknikleri, yarı iletkenler için 1010' yalnızca bir parça safsızlığa sahip kristal germanyum üretimine yol açmıştır,[20] bu onu şimdiye kadar elde edilen en saf malzemelerden biri yapmaktadır.[21] Son derece güçlü bir elektromanyetik alanın varlığında süper iletken olduğu keşfedilen (2005'te) ilk metalik malzeme , germanyum, uranyum ve rodyum alaşımıydı.[22]
Saf germanyumun, germanyum bıyıkları olarak anılan çok uzun vida dislokasyonlarını kendiliğinden ekstrüde ettiği bilinmektedir. Bu bıyıkların büyümesi, germanyumdan yapılan eski diyotlar ve transistörlerin arızalanmasının birincil nedenlerinden biridir, çünkü sonunda kısa devre yapabilirler.[23]
Kimya
Elemental germanyum yaklaşık 250 °C de havada yavaşça oksitlenmeye başlayarak GeO<sub id="mwAT8">2</sub> oluşturuyor.[24] Germanyum seyreltik asitler ve alkalilerde çözünmez, ancak sıcak konsantre sülfürik ve nitrik asitlerde yavaşça çözünür ve erimiş alkalilerle şiddetli reaksiyona girerek germanatlar üretir ( [GeO3]2-). Germanyumun birçok +2 bileşiği bilinmesine rağmen çoğunlukla +4 oksidasyon durumunda oluşur. Diğer oksidasyon durumları nadirdir: Ge2Cl6 gibi bileşiklerde +3, oksitlerin yüzeyinde +3 ve +1 bulunur,[25] veya germanitlerde negatif oksidasyon durumları bulunabilir; örneğin Mg2Ge -4 de olduğu gibi.
Ge42−, Ge94−, Ge92−, [(Ge9)2]6− gibi Germanyum küme anyonları (Zintl iyonları), sıvı amonyak içinde alkali metaller ve germanyum içeren alaşımlardanetilendiamin veya bir kriptandın varlığında ekstraksiyon yoluyla hazırlanmıştır.[26][27]
İki germanyum oksidi bilinmektedir: germanyum dioksit (GeO2) ve germanyum monoksit, (GeO).[19] Dioksit, GeO2, germanyum disülfidin (GeS2) kavrulmasıyla elde edilebilir ve suda çok az çözünen, ancak almanatlar oluşturmak için alkalilerle reaksiyona giren beyaz bir tozdur.[19] Monoksit, GeO 2'nin Ge metali ile yüksek sıcaklıkta reaksiyonuyla elde edilebilir.[19] Dioksit (ve ilgili oksitler ve germanatlar), görünür ışık için yüksek bir kırılma indeksine sahip olma, ancak kızılötesi ışığa karşı şeffaflık gibi alışılmadık bir özellik sergiler.[28][29] Sintilatör olarak Bismut germanate, Bi4 Ge3O12 kullanılmaktadır.[30]
Diğer kalkojenlerle Di sülfit ( GeS2) gibi ikili bileşikler de bilinmektedir; GeS2 ve di selenid (GeSe2) ve monosülfit (GeS), monoselenit (GeSe) ve mono tellür (GeTe). GeS2, hidrojen sülfür Ge(IV) içeren güçlü asit çözeltilerinden geçirildiğinde beyaz bir çökelti olarak oluşur.[26] Disülfit, suda ve kostik alkali veya alkalin sülfitlerin çözeltilerinde önemli ölçüde çözünür. Bununla birlikte, Winkler'in elementi keşfetmesine izin veren asidik suda çözünmez.[31] Disülfitin bir hidrojen akımında ısıtılmasıyla, koyu renkli ve metalik parlaklığa sahip ince plakalarda süblimleşen ve kostik alkalilerin çözeltilerinde çözünen monosülfür (GeS) oluşur.[19] Alkalin karbonatlar ve kükürt ile eritildiğinde, germanyum bileşikleri, tiyogermanatlar olarak bilinen tuzları oluşturur.[32]
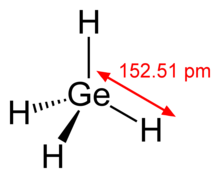
Dört tetra halojenür bilinmektedir. Normal şartlar altında GeI4 katı, GeF4 gaz ve diğerleri uçucu sıvılardır. Örneğin, germanyum tetraklorür, 83.1'°Cde metali klor ile ısıtarak kaynayan renksiz, dumanlı bir sıvı olarak elde edilir.[19] Tüm tetrahalidler kolayca hidratlı germanyum dioksite hidrolize edilir.[19] GeCl4 organogermanyum bileşiklerinin üretiminde kullanılır. Dört dihalidin tümü bilinmektedir ve tetrahalidlerin aksine polimerik katılardır.[26] Ek olarak Ge2Cl6 ve GenCl2n+2 formülünün bazı daha yüksek bileşikleri bilinmektedir.[19] Neopentan yapıya sahip Ge5Cl12 birimini içeren sıra dışı bileşik Ge6Cl16 hazırlanmıştır.[33]
Germane (GeH4), yapı olarak metana benzer bir bileşiktir. Beşe kadar germanyum atomu içeren GenH2 n+2 formülüne sahip alkanlara benzer bileşikler olan poligermanlar bilinmektedir. GeH4 sıvı amonyak içinde alkali metallerle reaksiyona girerek GeH<sub id="mwAck">3</sub><sup id="mwAco">-</sup> anyonu içeren beyaz kristal MGeH3 oluşturur.[26] Bir, iki ve üç halojen atomlu germanyum hidrohalojenürler renksiz reaktif sıvılardır.[26]

İlk organogermanyum bileşiği, 1887'de Winkler tarafından sentezlendi; germanyum tetraklorürün dietilçinko ile reaksiyonu tetraetilgerman verdi ( Ge(C2H5)4.[3] Tetrametilgerman gibi R4Ge (burada R bir alkildir ) tipindeki organogermanlar Ge(CH3)4 ve tetraetilgermana mevcut en ucuz germanyum öncüsü germanyum tetraklorür ve alkil nükleofiller yoluyla erişilir. İzobütilgerman (CH3)2CHCH2GeH3 gibi organik germanyum hidritlerin daha az tehlikeli yarı iletken uygulamalarında zehirli German gazı yerine kullanılabileceği bulunmuştur. Birçok germanyum reaktif ara ürünü bilinmektedir: germil serbest radikalleri, germilenler ( karbenlere benzer) ve germynes (karbinlere benzer).[34][35] Organogermanyum bileşiği 2-karboksietilgermaseskuioksan ilk olarak 1970'lerde rapor edildi ve bir süre besin takviyesi olarak kullanıldı ve muhtemelen anti-tümör niteliklere sahip olduğu düşünülüyordu.[36]
Germanyum Eind adlı bir ligand (1,1,3,3,5,5,7,7-oktaetil-s-hidrindasen-4-il) kullanarak oksijenle çift bağ (germanon) oluşturabilir. Germanyum hidrit ve germanyum tetrahidrit hava ile karıştırıldığında çok yanıcı ve hatta patlayıcıdır.[37]
İzotoplar
Germanyum 5 doğal izotopta bulunur: 70Ge, 72Ge, 73Ge, 74Ge ve 76Ge. Bunlardan 76Ge çok az radyoaktiftir, yarı ömrü 1.78×1021 yıl olan çift beta bozunmasıyla bozunur. 74Ge yaklaşık %36 doğal bolluğa sahip en yaygın izotoptur. 76Ge yaklaşık %7 doğal bolluk ile en az yaygın olanıdır. 72Ge,
Alfa parçacıkları ile bombardıman edildiğinde, istikrarlı 77Se üretir ve süreçte yüksek enerjili elektronlar serbest bırakır.[38] Bu nedenle nükleer piller için radon ile birlikte kullanılır.[38]
Atom kütlesi 58 ila 89 arasında değişen en az 27 radyoizotop da sentezlendi. Bunlardan en kararlı olanı 68Ge, 270,95 gün yarı ömürlü, elektron yakalama ile bozunur. En az kararlıyarı ömrü 30ms olan 60Ge'tır. Germanyumun radyoizotoplarının çoğu beta bozunmasıyla bozunurken 61Ge ve 64Ge gecikmiş
β+
bozunur. 84Ge den 87Ge'ye izotoplar ayrıca minör
β-
gecikmeli nötron emisyon bozunma yolları sergiler.[39]
Varlığı

Germanyum, yıldız nükleosentezi tarafından, çoğunlukla asimptotik dev dal yıldızlarında s-işlemi tarafından oluşturulur. S süreci, titreşen kırmızı dev yıldızların içindeki daha hafif elementlerin yavaş bir nötron yakalamasıdır.[40] Germanyum en uzak yıldızların bazılarıyla[41] Jüpiter'in atmosferinde tespit edilmiştir. [42]
Germanyumun yer kabuğundaki bolluğu yaklaşık olarak 1.6'ppmdir.[43] Arjirodit, briartit, germanit, renierit ve sfalerit gibi sadece birkaç mineral önemli miktarda germanyum içerir.[15][44] Sadece çok azı (özellikle germanit) çok nadiren kazılabilir miktarlarda bulunur.[45][46][47] Bazı çinko-bakır-kurşun cevher gövdeleri, nihai cevher konsantresinden ekstraksiyonu haklı çıkarmaya yetecek kadar germanyum içerir.[43] Alışılmadık bir doğal zenginleştirme işlemi, Victor Moritz Goldschmidt tarafından germanyum yatakları için yapılan geniş bir araştırma sırasında keşfedilen bazı kömür damarlarında yüksek bir germanyum içeriğine neden olur.[48][49] Şimdiye kadar bulunan en yüksek konsantrasyon, %1,6 oranında germanyum içeren Hartley kömür külündeydi.[48][49] İç Moğolistan, Xilinhaote yakınlarındaki kömür yatakları tahminen 1600 ton germanyum barındırıryor.[43]
Üretim
2011 yılında dünya çapında, çoğunlukla Çin (80 ton), Rusya (5 ton) ve Amerika Birleşik Devletleri'nde (3 ton)olmak üzere yaklaşık 118 ton germanyum üretildi.[15] Germanyum, %0,3'e varan oranlarda yoğunlaştığı sfalerit çinko cevherlerinden,[50] özellikle düşük sıcaklıkta tortu barındıran, masif Zn – Pb – Cu (– Ba ) yatakları ve karbonatlı Zn-Pb depozitlerden bir yan ürün olarak geri kazanılır.[51] Yakın zamanda yapılan bir araştırma, bilinen çinko rezervlerinde, özellikle Mississippi-Valley tipi yataklarda bulunanlarda en az 10.000 ton çıkarılabilir germanyum bulunduğunu, kömür rezervlerinde ise en az 112.000 ton bulunacağını buldu.[52][53] 2007'de talebin %35'i geri dönüştürülmüş germanyumdan karşılandı.[43]
| Yıl | Fiyatı ( $ /kg) [54] |
|---|---|
| 1999 | 1.400 |
| 2000 | 1.250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1.240 |
| 2008 | 1.490 |
| 2009 | 950 |
| 2010 | 940 |
| 2011 | 1.625 |
| 2012 | 1.680 |
| 2013 | 1.875 |
| 2014 | 1.900 |
| 2015 | 1.760 |
| 2016 | 950 |
| 2017 | 1.358 |
| 2018 | 1.300 |
| 2019 | 1.240 |
| 2020 | 1.000 |
Uygulamalar
2007'de dünya çapında germanyumun ana son kullanımlarının şu şekilde olduğu tahmin ediliyor: %35 fiber optik, %30 kızılötesi optikler, %15 polimerizasyon katalizörleri ve %15 elektronik ve güneş enerjisi uygulamaları.[15] Geri kalan %5 ise fosfor, metalurji ve kemoterapi gibi kullanımlara gitti.[15]
- alman
- Vitrin
- transistörün tarihi
Referanslar
- ^ Avarmaa (June 2019). "Critical Metals Ga, Ge and In: Experimental Evidence for Smelter Recovery Improvements". Minerals (İngilizce). 9 (6): 367. doi:10.3390/min9060367. Tarih değerini gözden geçirin:
|erişimtarihi=(yardım); - ^ "D. I. Mendeleev's concept of chemical elements and The Principles of Chemistry" (PDF). Bulletin for the History of Chemistry. 27 (1): 4–16. 2002. CiteSeerX dead $2
|citeseerx=değerini kontrol edin (yardım). 2008-12-17 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 2008-08-20. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar|ad1=eksik|soyadı1=(yardım) - ^ a b c d e "Mittheilungen über des Germanium. Zweite Abhandlung". J. Prak. Chemie (Almanca). 36 (1): 177–209. 1887. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). doi:10.1002/prac.18870360119. 2012-11-03 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-20. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar|ad1=eksik|soyadı1=(yardım) - ^ a b c d "Germanium, Ge, a New Nonmetal Element". Berichte der Deutschen Chemischen Gesellschaft (Almanca). 19 (1): 210–211. 1887. CiteSeerX dead $2
|citeseerx=değerini kontrol edin (yardım). doi:10.1002/cber.18860190156. December 7, 2008 tarihinde kaynağından arşivlendi. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar|ad1=eksik|soyadı1=(yardım) - ^ "Germanium, a New Non-Metallic Element". The Manufacturer and Builder: 181. 1887. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). 2008-12-19 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-20. - ^ "Obituary: Clemens Winkler". Berichte der Deutschen Chemischen Gesellschaft (Almanca). 39 (4): 4491–4548. 1886. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). doi:10.1002/cber.190603904164. 2020-08-01 tarihinde kaynağından arşivlendi. Erişim tarihi: 2020-06-07. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar|ad1=eksik|soyadı1=(yardım) - ^ "Sur le poids atomique du germanium". Comptes Rendus (Fransızca). 103: 452. 1886. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). 2013-06-20 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-20. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar|ad1=eksik|soyadı1=(yardım) - ^ a b Haller, E. E. (2006-06-14). "Germanium: From Its Discovery to SiGe Devices" (PDF). Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). 2019-07-10 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 2008-08-22. - ^ W. K. (1953-05-10). "Germanium for Electronic Devices". The New York Times. 2013-06-13 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-22.
- ^ "1941 – Semiconductor diode rectifiers serve in WW II". Computer History Museum. 2008-09-24 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-22.
- ^ "SiGe History". University of Cambridge. 2008-08-05 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-22.
- ^ a b c d "Germanium". Chemical & Engineering News. American Chemical Society. 2003. 2008-05-13 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-22. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Brattain, W. H. (1948). "The Transistor, A Semi-Conductor Triode". Physical Review. 74 (2): 230–231. doi:10.1103/PhysRev.74.230. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Electronics History 4 – Transistors". National Academy of Engineering. 2007-10-20 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-22.
- ^ a b c d e f g U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). 2008-09-16 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-28.Select 2008
Kaynak hatası: Geçersiz<ref>etiketi: "usgs" adı farklı içerikte birden fazla tanımlanmış (Bkz: Kaynak gösterme) - ^ "Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit". IEEE Transactions on Electron Devices. ED-23 (7): 621–639. July 1976. doi:10.1109/T-ED.1976.18464. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Nature's Building Blocks. Oxford: Oxford University Press. 2001. ss. 506–510. ISBN 978-0-19-850341-5. Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Agnese (2018-08-27). "Energy loss due to defect formation from 206Pb recoils in SuperCDMS germanium detectors". Applied Physics Letters. 113 (9): 092101. arXiv:1805.09942 $2. doi:10.1063/1.5041457. ISSN 0003-6951.
- ^ a b c d e f g h i Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie. 102nd. de Gruyter. ISBN 978-3-11-017770-1. OCLC 145623740. Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Germanium". Los Alamos National Laboratory. 2011-06-22 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-28.
- ^
Chardin, B. (2001). "Dark Matter: Direct Detection". Binetruy, B (Ed.). The Primordial Universe: 28 June – 23 July 1999. Springer. s. 308. ISBN 978-3-540-41046-1. r eksik
|soyadı1=(yardım) - ^ Lévy (August 2005). "Magnetic field-induced superconductivity in the ferromagnet URhGe". Science. 309 (5739): 1343–1346. doi:10.1126/science.1115498. PMID 16123293.
- ^ "Morphology of Germanium Whiskers". Kristall und Technik. 7 (1–3): 37–41. 1972. doi:10.1002/crat.19720070107. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Tabet, N (1998). "KRXPS study of the oxidation of Ge(001) surface". Applied Surface Science. 134 (1–4): 275–282. doi:10.1016/S0169-4332(98)00251-7.
- ^ Tabet, N (1999). "XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates". Journal of Electron Spectroscopy and Related Phenomena. 101–103: 233–238. doi:10.1016/S0368-2048(98)00451-4.
- ^ a b c d e Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. bas.). Butterworth-Heinemann. ISBN 0080379419.
- ^ Xu (1999). "Oxidative Coupling of Deltahedral [Ge9]4− Zintl Ions". J. Am. Chem. Soc. 121 (39): 9245–9246. doi:10.1021/ja992269s.
- ^ Sanghera, Jasbinder S.; Aggarwal, Ishwar D. (2002). "Infrared Transparent Germanate Glass-Ceramics". Journal of the American Ceramic Society. 85 (12): 3114–3116. doi:10.1111/j.1151-2916.2002.tb00594.x. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ Drugoveiko (1975). "Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products". Journal of Applied Spectroscopy. 22 (2): 191–193. doi:10.1007/BF00614256.
- ^ McIntyre, R. J.; Lecomte, R. (1986). "A Bismuth Germanate-Avalanche Photodiode Module Designed for Use in High Resolution Positron Emission Tomography". IEEE Transactions on Nuclear Science. 33 (1): 456–459. doi:10.1109/TNS.1986.4337142. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Germanium and its Inorganic Compounds". Chem. Rev. 51 (3): 431–469. 1952. doi:10.1021/cr60160a002. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Fröba (1997). "First synthesis of mesostructured thiogermanates". Chemical Communications (18): 1729–1730. doi:10.1039/a703634e.
- ^ Jones, P.J.; Reid, G. (1998). "The Crystal Structure and Raman Spectrum of Ge5Cl12·GeCl4 and the Vibrational Spectrum of Ge2Cl6". Inorg. Chem. 37 (23): 6032–6034. doi:10.1021/ic9807341. PMID 11670739. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Reactive intermediates in organogermanium chemistry". Pure Appl. Chem. 56 (1): 137–150. 1984. doi:10.1351/pac198456010137. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Bottei, Rudolph S. (1963). "Organogermanium Chemistry". Chemical Reviews. 63 (4): 403–442. doi:10.1021/cr60224a004. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ Bolger, P. M. (June 1997). "Hazard Assessment of Germanium Supplements". Regulatory Toxicology and Pharmacology. 25 (3): 211–219. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). doi:10.1006/rtph.1997.1098. PMID 9237323. 2020-03-10 tarihinde kaynağından arşivlendi. Erişim tarihi: 2019-06-30. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Germanium-oxygen double bond takes centre stage". Chemistry World. 25 March 2012. 2014-05-17 tarihinde kaynağından arşivlendi. Erişim tarihi: 2014-05-15. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ a b Perreault, Bruce A. "Alpha Fusion Electrical Energy Valve", US Patent 7800286, issued September 21, 2010.
- ^ Şablon:NUBASE 2003
- ^ Dinerstein, Harriet L.; Bowers, Charles W. (2002). "Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer". The Astrophysical Journal Letters. 578 (1): L55–L58. arXiv:astro-ph/0208516 $2. doi:10.1086/344473. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ "Astronomy: Elements of surprise". Nature. 423 (29): 29. 2003-05-01. doi:10.1038/423029a. PMID 12721614. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım) - ^ Hanel, R.; Maguire, W. (1982). "The tropospheric gas composition of Jupiter's north equatorial belt /NH3, PH3, CH3D, GeH4, H2O/ and the Jovian D/H isotopic ratio". Astrophysical Journal. 263: 443–467. doi:10.1086/160516. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ a b c d Kling, M.; Schroll, E. (2007). "Metallogenesis of germanium – A review". Ore Geology Reviews. 30 (3–4): 145–180. doi:10.1016/j.oregeorev.2005.07.034. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar
|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım)Höll, R.; Kling, M.; Schroll, E. (2007). Kaynak hatası: Geçersiz<ref>etiketi: "Holl" adı farklı içerikte birden fazla tanımlanmış (Bkz: Kaynak gösterme) - ^ Frenzel (2016). "The distribution of gallium, germanium and indium in conventional and non-conventional resources – Implications for global availability (PDF Download Available)". ResearchGate. Unpublished. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). doi:10.13140/rg.2.2.20956.18564. 2018-10-06 tarihinde kaynağından arşivlendi. Erişim tarihi: 2017-06-10. - ^ Roberts ve diğerleri. (December 2004). "Eyselite, Fe3+Ge34+O7(OH), a new mineral species from Tsumeb, Namibia". The Canadian Mineralogist. 42 (6): 1771–1776. doi:10.2113/gscanmin.42.6.1771.
- ^ "Archived copy" (PDF). 2018-10-06 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 2018-10-06.
- ^ "Archived copy" (PDF). 2020-03-20 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 2018-10-06.
- ^ a b "Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. 1930. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). 2018-03-03 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-25. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar|ad1=eksik|soyadı1=(yardım) - ^ a b Peters, Cl. (1933). "Zur Geochemie des Germaniums". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. CiteSeerX live $2
|citeseerx=değerini kontrol edin (yardım). 2008-12-01 tarihinde kaynağından arşivlendi. Erişim tarihi: 2008-08-25. Birden fazla yazar-name-list parameters kullanıldı (yardım); Yazar|ad1=eksik|soyadı1=(yardım); Yazar eksik|soyadı2=(yardım) - ^ Bernstein, L (1985). "Germanium geochemistry and mineralogy". Geochimica et Cosmochimica Acta. 49 (11): 2409–2422. doi:10.1016/0016-7037(85)90241-8.
- ^ Frenzel (July 2016). "Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis". Ore Geology Reviews. 76: 52–78. doi:10.1016/j.oregeorev.2015.12.017.
- ^ Frenzel (2013-12-29). "On the geological availability of germanium". Mineralium Deposita. 49 (4): 471–486. doi:10.1007/s00126-013-0506-z. ISSN 0026-4598.
- ^ Frenzel (2014-01-19). "Erratum to: On the geological availability of germanium". Mineralium Deposita. 49 (4): 487. doi:10.1007/s00126-014-0509-4. ISSN 0026-4598.
- ^ R.N. Soar (1977). USGS Minerals Information. U.S. Geological Survey Mineral Commodity Summaries. ISBN 978-0-85934-039-7. OCLC 16437701. 2013-05-07 tarihinde kaynağından arşivlendi. Erişim tarihi: 2013-04-22.

