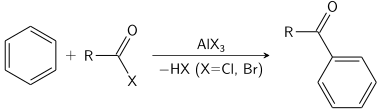Elektrofilik aromatik sübstitüsyon
Elektrofilik aromatik sübstitüsyon, bir aromatik sisteme (genellikle hidrojen) bağlı bir atomun bir elektrofil ile değiştirildiği organik reaksiyondur. En önemli elektrofilik aromatik sübstitüsyonlardan bazıları aromatik nitrolama, aromatik halojenasyon, aromatik sülfonasyon, alkilasyon ve açilasyon tipindeki Friedel– Crafts reaksiyonudur.[1]
Örnek reaksiyonlar[değiştir | kaynağı değiştir]
Bu reaksiyonun en yaygın olarak uygulanan örneği benzenin etilasyonudur.
Etil benzen, 1999 yılında yaklaşık 24,700,000 ton üretilmiştir.[2] (Dehidrojenasyon ve polimerizasyondan sonra, ticari bir plastik olan polistiren üretilir.) Bu işlemde, asitler yeni oluşan pozitif yüklü karbon iyonunu (karbokatyon) oluşturmak için katalizör olarak kullanılır. Benzenin diğer birçok elektrofilik reaksiyonu, çok daha küçük olmasına rağmen ; önemli ara maddelere giden değerli yollar olmaktadır. Benzenin nitrolanması, elektrofil olarak nitronyum iyonunun etkisiyle yapılır. Dumanlı sülfürik asitle yapılan sülfonasyon benzen sülfonik asiti verir. Brom, klor veya iyotla yapılan aromatik halojenasyon ilgili aril halojenürleri verir. Bu reaksiyon tipik olarak, ilgili demir veya alüminyum halojenür tarafından katalize edilir.
Friedel–Crafts reaksiyonu bir açilasyon veya bir alkilasyon olarak gerçekleştirilebilir. Genellikle, alüminyum klorür kullanılsa da hemen hemen her kuvvetli Levis asidi kullanılabilir. Açilasyon reaksiyonu için stokiyometrik miktarda alüminyum klorür gereklidir.
Reaksiyon mekanizması[değiştir | kaynağı değiştir]
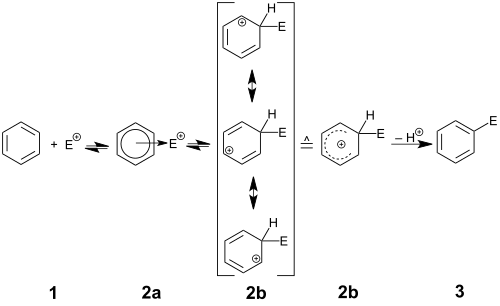
Hughes–Ingold mekanizma sembolü SEAr,[3] ile gösterilen genel reaksiyon mekanizması, aromatik halkanın elektrofil E+’ya saldırmasıyla başlar. Bu adım, pozitif yüklü ve delokalize bir siklohekzadienil katyonunun oluşumuna yol açar. Bu katyon aynı zamanda bir arenyum iyonu, Wheland ara maddesi veya aren σ-kompleksi olarak da bilinir. Bu karbokatyonun birçok örneği karakterize edilmiştir. Ancak, normal çalışma koşulları altında bu yüksek orandaki asidik türler, aromatikliği yeniden oluşturmak için sp3 karbonuna bağlı protonu çözücüye (veya başka herhangi bir zayıf baza) verecektir. Net sonuç, aril halkasında H’nin E ile değiştirilmesidir. Bazen, H+ yanında diğer elektrofüjler (elektron çiftleri olmadan ayrılabilen gruplar) aromatikliği yeniden oluşturmak için ayrılacaktır; bu türler arasında silil grupları (SiR3+ olarak), karboksi grubu (CO2 + H+ olarak), iyodo grubu (I+ olarak) ve t-bütil (R+ olarak) gibi tersiyer alkil grupları bulunur. Bu tür sübstitüentlerin ayrılma kapasitesi, özellikle silil’in başka bir fonksiyonel grup (ipso saldırısı) ile değiştirilmesi durumunda, bazen sentetik olarak kullanılır. Bununla birlikte, iyodo veya alkil gibi grupların kaybı daha sıklıkla istenmeyen bir yan reaksiyondur.
Ayrıca bakınız[değiştir | kaynağı değiştir]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th bas.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Vincent A. Welch, Kevin J. Fallon, Heinz-Peter Gelbke "Ethylbenzene" Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a10_035.pub2
- ^ Gawley, Robert E. (4 Haziran 1999). "A proposal for (slight) modification of the Hughes–Ingold mechanistic descriptors for substitution reactions". Tetrahedron Letters. 40 (23): 4297-4300. doi:10.1016/S0040-4039(99)00780-7. ISSN 0040-4039.