Sülfat: Revizyonlar arasındaki fark
| [kontrol edilmemiş revizyon] | [kontrol edilmiş revizyon] |
İçerik silindi İçerik eklendi
Kimya bilgi kutusu şablonu eklendi. |
Kaynaksız şablonu eklendi. |
||
| 1. satır: | 1. satır: | ||
{{Kaynaksız}} |
|||
{{Kimya bilgi kutusu |
{{Kimya bilgi kutusu |
||
| Ad = Sülfat |
| Ad = Sülfat |
||
| 104. satır: | 105. satır: | ||
== Hidrojen sülfat == |
== Hidrojen sülfat == |
||
Sülfürik asit ile [[su]]yun tepkimeye girmesiyle iki hidrojen sülfat ve [[hidronyum]] oluşur. Yapısında bir hidrojen, bir [[kükürt]] ve dört oksijen bulunur. [[İyon yükü]] ise [[anyon]]dur (-). |
Sülfürik asit ile [[su]]yun tepkimeye girmesiyle iki hidrojen sülfat ve [[hidronyum]] oluşur. Yapısında bir hidrojen, bir [[kükürt]] ve dört oksijen bulunur. [[İyon yükü]] ise [[anyon]]dur (-). |
||
==Kaynakça== |
|||
{{Kaynakça}} |
|||
{{inorganik kimya-taslak}} |
{{inorganik kimya-taslak}} |
||
Sayfanın 11.28, 12 Nisan 2016 tarihindeki hâli
Bu madde hiçbir kaynak içermemektedir. (Bu şablonun nasıl ve ne zaman kaldırılması gerektiğini öğrenin) |
| |

| |
| Adlandırmalar | |
|---|---|
Sülfat | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.108.048 |
| EC Numarası |
|
PubChem CID
|
|
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
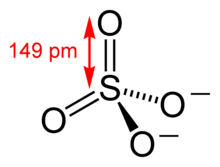
| Molekül formülü | SO42- |
| Molekül kütlesi | 96.06 g/mol |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Sülfat, inorganik kimya'da sülfürik asit'in bir tuzudur. Sülfat iyonu, poliatomik bir anyondur. Ampirik formülü SO42-'dir ve moleküler ağırlığı 96,06 daltondur. Bir sülfür atomu ve bunu tetrahedral yapıda çevreleyen dört ekivalan oksijen atomundan müteşekkildir. Dimetil sülfat gibi organik sülfatlar, kovalent bileşiklerdir ve sülfürik asitin esterleridir.
- Sülfürik asitte metalin eritilmesi
- Sülfürik asidin bir metal hidroksit veya oksit ile reaksiyonu
- Metal sülfür veya sülfitlerin oksidizasyonu
Hidrojen sülfat
Sülfürik asit ile suyun tepkimeye girmesiyle iki hidrojen sülfat ve hidronyum oluşur. Yapısında bir hidrojen, bir kükürt ve dört oksijen bulunur. İyon yükü ise anyondur (-).
Kaynakça
| İnorganik kimya ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. |
