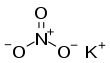Potasyum nitrat

| |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Potasyum nitrat | |||
Diğer adlar Güherçile Hint güherçilesi | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.926 | ||
| EC Numarası |
| ||
| E numaraları | E252 (koruyucular) | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| UN numarası | 1486 | ||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Molekül formülü | KNO3 | ||
| Molekül kütlesi | 101,1032 g/mol | ||
| Görünüm | beyaz kristal katı | ||
| Koku | kokusuz | ||
| Yoğunluk | 2,109 g/cm3 (16 °C) | ||
| Erime noktası | 334 °C | ||
| Kaynama noktası | 400 °C’de bozunur | ||
| Çözünürlük (su içinde) | 133 g/L (0 °C) 316 g/L (20 °C) 2460 g/L (100 °C)[2] | ||
| Çözünürlük | etanolde çok az çözünür gliserin ve amonyakta çözünür | ||
| Baziklik (pKb) | 15,3[3] | ||
| Kırınım dizimi (nD) | 1.5056 | ||
| Yapı | |||
| Ortorombik, Aragonit | |||
| Termokimya | |||
Isı sığası (C)
|
95,06 J/mol K | ||
Standart formasyon entalpisi (ΔfH⦵298)
|
-494,00 kJ/mol | ||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | Oksitleyici. Yutulduğunda, solunduğunda ya da cilde nüfuz ettiğinde zararlıdır. Cilt ve göz çevresinde tahrişe neden olur. | ||
| GHS etiketleme sistemi: | |||
| Piktogramlar |  
| ||
| R-ibareleri | R8 R22 R36 R37 R38 | ||
| G-ibareleri | S7 S16 S17 S26 S36 S41 | ||
| Tehlike ifadeleri | H272, H315, H319, H335 | ||
| Önlem ifadeleri | P102, P210, P220, P221, P280 | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | Yanıcı değildir | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
3750 mg/kg (oral, sıçan)[4] | ||
| AB İndeksi | Listede yer almamaktadır | ||
| AB sınıflandırması | Oksitleyici (O) | ||
| Güvenlik bilgi formu (SDS) | ICSC 0184 | ||
| Benzeyen bileşikler | |||
Diğer anyonlar
|
Potasyum nitrit | ||
Diğer katyonlar
|
Lityum nitrat Sodyum nitrat Rubidyum nitrat Sezyum nitrat | ||
Benzeyen bileşikler
|
Potasyum sülfat Potasyum klorür | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
| Bilgi kutusu kaynakları | |||
Potasyum nitrat, formülü KNO3 olan bir potasyum bileşiğidir. Güherçile olarak da bilinen bileşik doğal hâlde kayaçlarda ve mağaralarda oluşan beyaz renkli kabuksu yapıda bulunur.
Potasyum nitrat başlıca olarak gübreler, roket itici yakıtı ve havai fişeklerin üretiminde kullanılır; Kükürt ve odun kömürü ile belirli oranlarda karıştırılırsa karabarutu oluşturur. Gıda katkısı olarak kullanıldığı Avrupa Birliği normlarında E252 olarak adlandırılır.
Üretimi[değiştir | kaynağı değiştir]
Çözelti hâlindeki sodyum nitrat ve potasyum klorür karışımının çifte ayrışması sonunda elde edilir. Kaynar hâldeki çözeltilerin karışımından çözünürlüğü sıcakta pek fazla değişmeyen sodyum klorür çökelir. Çözünürlüğü daha fazla olan ve çözelti hâlinde kalan potasyum nitrat soğuma sonucunda kristalleşir.
- NaNO3 + KCl ⇌ KNO3 (çözelti)+ NaCl↓(katı)
Potasyum nitrat üretiminin yukarıdaki reaksiyona benzer alternatif diğer bir yolu amonyum nitrat ve potasyum klorürün birleşimine dayanan reaksiyondur. Bu reaksiyonla kolayca elde edilen potasyum nitratın içeriğinde sodyum bulunmaz.
- NH4NO3 + KCl → NH4Cl + KNO3
Potasyum nitrat, amonyum nitrat ve potasyum hidroksitin birleştirilmesi ile yapılabilir.
- NH4NO3 + KOH → NH3 (gaz) + KNO3 + H2O
Potasyum nitrat, nitrik asit ve potasyum hidroksitin nötrleştirilmesi yolu ile de üretilebilir. Bu reaksiyon çok ekzotermiktir.
- KOH (çözelti) + HNO3 → KNO3 (çözelti) + H2O
Özellikleri[değiştir | kaynağı değiştir]
Potasyum nitrat oda sıcaklığında ortorombik bir kristal yapısına sahip olmasına karşın 129 °C sıcaklıkta trigonal bir kristal yapısına dönüşür. 560 °C üzerindeki sıcaklığa ısıtıldığında ise parçalanarak oksijen ve potasyum nitrite dönüşür:
- 2 KNO3 → 2 KNO2 + O2
Potasyum nitrat suda normal bir şekilde çözünse de çözünürlüğü sıcaklık ile artar. Sulu çözeltisi hemen hemen nötr özellik gösterir (%10’luk potasyum nitrat çözeltisinin 14 °C'de pH derecesi 6,2'dir). Çok higroskopik değildir. Alkolde çözünmez ve zehirli değildir; indirgen maddelerle patlayarak tepkime verse de tek başına patlayıcı özelliği yoktur.
Kullanımı[değiştir | kaynağı değiştir]
Karabarut[değiştir | kaynağı değiştir]
Karabarutun üç bileşeninden biri olan potasyum nitrat odun kömürü tozu (aslında karbon) ve kükürdün yanında, karabarut bileşiminde oksitleyici olarak rol oynar.
Gübre[değiştir | kaynağı değiştir]
Potasyum nitrat çoğunlukla, makro besinlerin ikisi olan azot ve potasyum kaynağı olarak bitkilere uygun gübrelerde kullanılır. Tek başına saf gübre olarak kullanıldığında NPK oranı 13-0-46 olmaktadır.
Gıda koruyucusu[değiştir | kaynağı değiştir]
Gıda koruma maddesi olarak, potasyum nitrat Orta Çağ’dan bu yana etlerin muhafazasında kullanılmışsa da bakteriyel enfeksiyonu önlemede sodyum nitrat (ve nitrit) daha güvenilir olduğu için günümüzde gıda koruyucusu olarak önemini yitirmiştir. Etlerin ve et ürünlerini (bilhassa sucuk ve salam) muhafaza etmesinin yanında ayrıca onlara kırmızı bir renk vermek için de kullanılır.
Oksitleyici[değiştir | kaynağı değiştir]
Potasyum nitrat etkili bir oksitleyicidir. Potasyum içerdiğinden yanma ile leylak renkli bir alev oluşturur. Bu nedenle amatör roket itici yakıtları ile şeker ve potasyum nitrat karışımıyla yapılan sis bombası gibi birçok piroteknik bileşimde ve havai fişeklerde kullanılır. Ayrıca tütünün düzgün yanmasını sağlamak için sigara sarılmadan önce tütün harmanına eklenir.
Farmakoloji[değiştir | kaynağı değiştir]
Potasyum nitrat hassas dişler için kullanılan bazı diş macunlarında bulunabilir. Son zamanlarda, hassas dişlerin tedavisi için diş macununda potasyum nitrat kullanımı artmaktadır.
Potasyum nitrat eskiden bir hipotansif olarak yüksek kan basıncı mücadelesinde başarıyla kullanılmıştır. Gliseril trinitrat (nitrogliserin), amil nitrit ve izosorbit türevleri gibi diğer nitrat ve nitritler anjin rahatsızlığının verdiği sıkıntıyı hafifletmek için hâlâ kullanılmaktadır.
Tarihçe[değiştir | kaynağı değiştir]
12. ve 13. yüzyıla ait Endülüs Müslümanlarının kitaplarda “Alev püskürterek hareket eden, işleyen ve yanan yumurtalar”, “Gök gürlemesi gibi gürültü" yapan roketlerden söz edilmekte ve ilk defa “füze ile harekete geçen torpillerin” şekillerine varıncaya kadar detaylı bilgiler verilmektedir. Bunlardan biri, Hasanü’r-Rahman adlı Müslüman bilginin 1275 yılında kaleme aldığı “Harp Tarihi” adlı eserdir. Bu asırda ilim adamlarının destekleyicisi, bizzat sultanlar olmuş, “güherçile” denilen kimyevi maddenin, tahrip gücünü araştırmak üzere kimyagerler görevlendirilmiştir. Laboratuvarda geceli gündüzlü süren çalışmalar sonunda, birçok kimyevi keşiflerde bulunulmuştur. Bu keşiflerden Avrupa 2 asır sonra haberdar olmuştur. Sebebi kötü kopyalama usulleri ve İtalyanca tercümelerdir.[5]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Alman İş Güvenliği ve Sağlığı Enstitüsü'nün GESTIS Madde Veritabanındaki Potassium nitrate kaydı, accessed on 9 Mart 2007.
- ^ B. J. Kosanke, B. Sturman, K. Kosanke, I. von Maltitz, T. Shimizu, M. A. Wilson, N. Kubota, C. Jennings-White, D. Chapman (2004). "2". Pyrotechnic Chemistry. Journal of Pyrotechnics. ss. 5-6. ISBN 1-889526-15-0. 2 Temmuz 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Şubat 2015.
- ^ Kolthoff, Treatise on Analytical Chemistry, New York, Interscience Encyclopedia, Inc., 1959.
- ^ "Arşivlenmiş kopya". 12 Ağustos 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Şubat 2015.
- ^ "İslam Toplumu ve Medeniyet : İlk Roket, İlk Telgraf Hattı ve İlk Denizaltı » Sorularla İslamiyet". Sorularla İslamiyet. 15 Mart 2007. 8 Ekim 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Eylül 2020.
Dış bağlantılar[değiştir | kaynağı değiştir]
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)-4 | RONO2 | NO-3 NH4NO3 |
HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 |
Co(NO3)2 Co(NO3)3 |
Ni(NO3)2 | CuNO3 Cu(NO3)2 |
Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2 Pd(NO3)4 |
AgNO3 Ag(NO3)2 |
Cd(NO3)2 | In(NO3)3 | Sn(NO3)4 | Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | Ta | W | Re | Os | Ir | Pt(NO3)2 Pt(NO3)4 |
Au(NO3)3 | Hg2(NO3)2 Hg(NO3)2 |
TlNO3 Tl(NO3)3 |
Pb(NO3)2 | Bi(NO3)3 BiO(NO3) |
Po(NO3)4 | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 |
Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)3 | Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | No | Lr | |||