İlaç yan etkisi
| İlaç yan etkisi | |
|---|---|
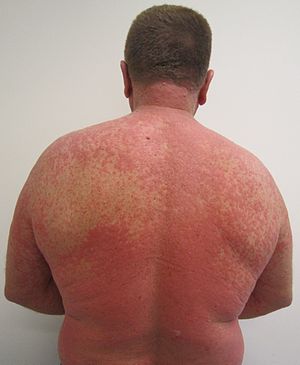 | |
| İlaç kaynaklı deri döküntüsü |
İlaç yan etkisi (İYE), kişinin aldığı bir ilaçtan ötürü bir zarar görmesi.[1] Tek doz ya da daha uzun kullanımlarda ya da iki veya daha fazla ilacın beraber kullanımından olayı oluşabilir. Bu ifade yan etki ifadesinden farklıdır, yan etkiler bazen faydalı etkiler de olabilir.[2] İlaç yan etkisi çalışmaları, farmakovijilans ile bağlantılıdır. Olumsuz ilaç olayları (Adverse drug events), bir ilaç alındığında meydana gelen, yaralanma nedeni olarak tanımlansın veya tanımlanmasın herhangi bir zararı ifade eder.[1] İlaç yan etkisi, olumsuz ilaç olaylarının nedensel ilişki gösterebilen özel bir tipidir.
Sınıflandırma
[değiştir | kaynağı değiştir]İlaç yan olayları sebepleri ve şiddetleri gibi kriterlere göre sınıflandırılabilirler.
Sebep
[değiştir | kaynağı değiştir]- A Tipi: Arttırılmış farmakolojik tepkiler- doza bağımlı ve tahmini
- A Tipi tepkiler, advers ilaç reaksiyonlarının yaklaşık %80'ini oluşturmaktadır, Genellikle, ilacın ana farmakolojik etkisinin bir sonucu (kendisi antikoagülan olan warfarin maddesini kullanınca kanama olması gibi) ya da ilacın düşük terapötik indeksi (digoxin kullanımı sonucu bulantı olması) nedeniyle oluşur ve bu nedenden dolayı tahmin edilebilirler. Etkiler doza bağımlı olarak genelde hafiftir ancak ciddi veya ölümcül olabilirler (warfarin nedeniyle kafa içi kanama). Uygunsuz dozlar nedeniyle bu tür tepkiler özellikle ilaç eliminasyonunun bozulduğu zamanlarda meydana gelir. 'Yan etki' terimi genelde A Tipinin küçük tepkileri için kullanılır.[3]
- B Tipi: Doza bağımlı olmayan ve tahmin edilemeyen. İdiyosenkratik
- B Tipi tepkiler, Doza bağımlı olmayan ve öngörülemeyen tepkilerdir. Genelde çok ölümcül olabilen bu tepkiler kişiye özgü değillerdir.
Tip A ve B 1970'lerde önerilmişlerdir,[4] tanımlamada iki tipin yetersiz kaldığı görülmüş ve sonradan diğer tipler önerilmiştir.[5]
Ciddiyeti ve şiddeti
[değiştir | kaynağı değiştir]FDA, ilaç yan etkisinin neden olduğu sonuçları şöyle sıralamıştır:[6]
- Ölüm
- Yaşam tehdidi
- Hastaneye yatırma (ilk veya uzun süreli)
- Sakatlık - hastanın vücut fonksiyonlarında önemli veya kalıcı değişim, bozulma, hasar / fiziksel aktivitelerde ya da yaşam kalitesinde azalma
- Konjenital anomali
- Kalıcı bozukluğu veya hasarı önlemek için müdahale gerektirebilir
Söz konusu ilaç yan etkisinin yoğunluğu keyfi bir ölçekte bulunmaktadır. Advers olaylarda, "şiddetli" ve "ciddi" terimleri teknik olarak birbirinden çok farklıdır. Bu terimler kolayca karıştırılabilir ancak birbirinin yeriner kullanılamazlar, bu terimleri kullanırken dikkat edilmesi gerekir.
Bir baş ağrısının şiddeti, şiddetli ağrıya neden oluyorsa. Klinisyenler ağrının şiddetini değerlendirmek amacıyla "görsel analog skala" gibi ölçeklerden yardım alırlar. On the other hand, a headache is not usually serious (but may be in case of subarachnoid haemorrhage, subdural bleed, even a migraine may temporally fit criteria), unless it also satisfies the criteria for seriousness listed above.
Konum
[değiştir | kaynağı değiştir]Yan etkiler yerel olabilirler.
Mesela, bazı göz hipertansifleri göz damlası olarak yerel uygulanmalarına rağmen sistemik etkilere neden olabilirler,[7] bunun nedeni, preparatın bir kısmının sistemik dolaşıma karışmasıdır.
Mekanizmalar
[değiştir | kaynağı değiştir]
Araştırmalar ilaçlarım biyokimyasal etkilerini daha iyi açıklamaklardır. Ortak mekanizmalar şunlardır:
- Anormal farmakokinetik etki nedenleri
- genetik etkenler
- komorbidite hastalık durumları
- Birbirini tetikleyen sinerjik etkiler
- Hastalık ve ilaç arasında
- iki ilaç arasında
Anormal Farmakokinetik etkiler
[değiştir | kaynağı değiştir]Komorbid hastalık durumları
[değiştir | kaynağı değiştir]Çeşitli hastalıklar, özellikle de böbrek ya da karaciğer yetmezliğine neden olan hastalıklar ilaç metabolizmasını değiştirebilir. Hastalık durumlarında dolayı ilaç etkileşimlerinin değiştiğini gösteren araştırmalar mevcuttur.[8]
Genetik etkenler
[değiştir | kaynağı değiştir]Anormal ilaç etkileşimleri kalıtsal etkenlerden kaynaklanabilir.[9][10] İşlevsel genomik, normal ilaç reaksiyonları için kalıtım temel çalışmadır.
Faz I reaksiyonları
[değiştir | kaynağı değiştir]Kalıtsal olarak geçen sitokrom P450'nin anormal alelleri ilaç metabolizmasını değiştirebilir. P450 etkileşimlerinin neden olduğu ilaç yan etkilerini içeren tablolar kullanımdadır.[11][12]
Kalıtsal anormal bütirilkolinesteraz (psödokolinesteraz), süksinilkolin gibi ilaçların metabolizmasını etkileyebilir[13]
Faz II Reaksiyonları
[değiştir | kaynağı değiştir]Bazı ilaçlar kalıtsal anormal n-asetiltransferaz ile konjuge etki göstererek izoniazid, hidralazin ve prokainamid gibi ilaçların atılımını hızlandırabilirler.[12][13]
Kalıtsal anormal thiopurine S-methyltransferase, thiopurine türü ilaçlar olan mercaptopurine ve azathioprine.in metabolizmasını etkileyebilirler.[12]
Diğer ilaçlar ile etkileşimleri
[değiştir | kaynağı değiştir]İlaç etkileşim riskleri polifarmasi ile artabilir.
Protein bağlama
[değiştir | kaynağı değiştir]Bu etkiler genellikle yeni ve kalıcı durumlar elde edilinceye kadar geçici ve hafiftir.[14][15] Bu durum başlıca ilk geçişleri karaciğer metabolizması olmayan ilaçlarda görülür.
İlaçların bağlandığı temel plazma proteinleri:[16]
- albümin
- α1-asit glikoprotein
- lipoproteinler
Warfarin ile bazı ilaçların etkileşimleri proteinlere bağlanmada değişikliklere neden olmaktadırlar.[16]
Sitokrom P450
[değiştir | kaynağı değiştir]Anormal aktarılan aleller ya da ilaç etkileşimleri nedeniyle sitokrom P450'nin neden olduğu anormal metabolizmaya sahip olan hastalar.[11]
Sinerjik etkiler
[değiştir | kaynağı değiştir]Sinerjizme örnek olarak QT aralığını arttıran iki ilaç verilebilir.
Nedensellik değerlendirmesi
[değiştir | kaynağı değiştir]Nedensellik değerlendirmesi, ilaç kaynaklı yan etki olasılığını tanımlamakta kullanılır. Nedensellik değerlendirmesinde birden çok sayıda metot mevcuttur, bunlardan bazıları Naranjo algoritması, Venulet algoritması ve WHO nedensellik terimi değerlendirme kriteridir. Bu algoritmaların her birinin kullanımının artıları ve eksileri vardır ve uygulamak için belli bir düzeyde uzmanlık gerektirir.[17][2]
Takip
[değiştir | kaynağı değiştir]Birçok ülkede ilaç güvenliği ve tepkilerini izlemek için kurulmuş resmi kurumlar vardır. Uluslararası düzeyde, WHO'nun "Uppsala İzleme Merkezi" ve Avrupa Birliği'nin "Avrupa İlaç Ajansı" (EMEA) vardır. ABD'de, pazarlama sonrası çalışmalardan "Gıda ve İlaç İdaresi" (FDA) sorumludur. Kanada'da, pazarlanan sağlık ürünlerinin gözetiminden "Kanada'da Pazarlanan Sağlık Ürünleri Müdürlüğü" sorumludur. Avustralya'da, terapötük ürünlerin satış sonrası izlemesini "Terapötik Mallar İdaresi" (TGA).
Epidemiyoloji
[değiştir | kaynağı değiştir]Sağlık Araştırmalar ve Kalitesi Ajansı'nın (AHRQ) 2011'de yaptığı bir araştırmanın sonucunda, yatıştırıcılar ve hipnotikler hastane ortamında görülen ilaç yan etkisi vakalarında baş etkenler iken. Tüm İYE vakalarının yaklaşık %2.8'i için başvuru yapılmıştır ve %4.4'ü ise hastane ortamında alınan yatıştırıcı ve hipnotik ilaçlar nedeniyle olmaktadır.[18] AHRQ tarafından 2011'de yapılan ikinci bir çalışmada ise, hastanede yatış sırasında meydana gelen İYE vakalarına en çok sebep olan preparatlar steroidler, antibiyotikler, opiatlar ve narkotikler ve antikoagülantlar olduğu ortaya çıkmıştır. Kentsel eğitim hastanelerinde antibiyotik ve opiatlar/narkotikler yüzünden meydana gelen İYE vakalarının kentsel olmayanlara göre çok daha fazla olduğu görülmüştür. İYE vakalarının kâr amacı gütmeyen özel hastanelerde, kâr amacı güden kamu ve özel hastanelere nazaran daha fazla meydana geldiği görülmüştür.[19]
2011 yılında kadınlar erkeklere oranla opiatler/narkotikler nedeniyle daha fazla İYE vakasına maruz kalmışlardır, erkekler ise antikoagülanlar nedeniyle kadınlardan daha fazla İYE vakaları yaşamışlardır. Yaklaşık 1,000 65 yaş üstü hastanın 8'i hastane yatışlarında dört preparat yüzünden İYE durumu yaşamaktadır (steroidler, antibiyotikler, opiatler ve antikoagülanlar).[19] Bir çalışma, hastaların %48'inin en az bir ilaç nedeniyle İYE vakasına maruz kaldığını ve yardım almak için eczacılara başvurduklarını göstermiştir.[20]
Ayrıca bakınız
[değiştir | kaynağı değiştir]Dış bağlantılar
[değiştir | kaynağı değiştir]- ADR online araçları[ölü/kırık bağlantı]
- İlaç Toksisitesi (Citizendium)
- Yüksek etkinlikte antiretroviral tedavi gören HIV pozitif hastalarda İYE insidansı 8 Mart 2021 tarihinde Wayback Machine sitesinde arşivlendi. PMC3312730
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b "Guideline For Good Clinical Practice"[ölü/kırık bağlantı] (PDF).
- ^ a b Nebeker JR, Barach P, Samore MH (2004).
- ^ Ritter, J M (2008).
- ^ Rawlins MD, Thompson JW.
- ^ Aronson JK.
- ^ "MedWatch - What Is A Serious Adverse Event?" 29 Eylül 2007 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Rang, H. P. (2003).
- ^ "Clinical Drug Use" 1 Kasım 2007 tarihinde Archive.is sitesinde arşivlendi.
- ^ Phillips KA, Veenstra DL, Oren E, Lee JK, Sadee W (2001).
- ^ Goldstein DB (2003).
- ^ a b "Drug-Interactions.com" 30 Ağustos 2007 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ a b c Weinshilboum ARE; Collins, Francis S.; Weinshilboum, Richard (2003).
- ^ a b Evans WE, McLeod HL (2003).
- ^ DeVane CL (2002).
- ^ Benet LZ, Hoener BA (2002).
- ^ a b Sands CD, Chan ES, Welty TE (2002).
- ^ Davies EC, Rowe PH, James S, et al. (2011).
- ^ Weiss AJ, Elixhauser A. Origin of Adverse Drug Events in You.
- ^ a b Weiss A.J., Elixhauser A. Characteristics of Adverse Drug Events Originating During the Hospital Stay, 2011.
- ^ Yeung E (2015).
| Sınıflandırma |
|---|
