Hidrojen bağı: Revizyonlar arasındaki fark
| [kontrol edilmiş revizyon] | [kontrol edilmemiş revizyon] |
düzeltme AWB ile |
→Kaynaklar: Onceki yazi daha bilimsel bir sekilde, daha fazla kaynak ekleyerek duzenlendi. |
||
| 1. satır: | 1. satır: | ||
[[Dosya:Liquid water simulation.jpg|thumb|300px|[[Dosya:3D model hydrogen bonds in water.svg|küçükresim|Su molekulleri arasindaki hidrojen baglarinin 3-boyutlu model gosterimi]]Kirmizi renkli atomlar oksijen atomunu, griler hidrojen atomunu temsil etmektedir. Her bir su molekulu icin pozitif hidrojen ve negatif oksijen taraflari arasinda olusan hidrojen baglari seritli cizgilerle sembolize edilmistir.]] |
|||
[[Dosya:Liquid water simulation.jpg|thumb|right|300px|[[Su]] molekülü; yeşil çizgilerle birleştirilmiş moleküller '''hidrojen bağı'''nı temsil ediyor.]] |
|||
'''Hidrojen bağı''', bir [[hidrojen]] (H, arti yuklu) [[atom]]<nowiki/>unun [[elektronegatif]]<nowiki/>ligi oldukca yuksek baska bir atoma ([[oksijen]] (O), [[azot]] (N) ya da [[flor]] (F) gibi, eksi yuklu) [[Kovalent bağ|kovalent bag]]<nowiki/>larla baglanmasi sonucu olusan [[Polar bağ|polar]] [[molekül]]<nowiki/>un (ornegin [[su]] (H<sub>2</sub>O) molekulu) hidrojeni ile baska bir molekulun [[elektronegatif]] atomu arasinda olusan zayif [[Kimyasal bağ|kimyasal bag]]<nowiki/>dir. Canli hucrelerde, elektronegatif molekuller genellikle oksijen ya azot atomlaridir. Yasamsal acidan, zayif kimyasal baglar arasinda oldukca onemli bir yere sahiptir<ref>[[By Lisa A. Urry, Michael L. Cain, Steven A. Wasserman, Peter V. Minorsky, Jane B. Reece Published by Pearson Copyright © 2017 Published Date: Oct 19, 2016|Campbell Biology]], 11th Edition By Lisa A. Urry, Michael L. Cain, Steven A. Wasserman, Peter V. Minorsky, Jane B. Reece Published by Pearson Copyright © 2017 Published Date: Oct 19, 2016</ref>. |
|||
'''Hidrojen bağı''', bir [[molekül]] oksijen, azot veya flor gibi [[elektronegatif]] bir atoma bağlı hidrojenin kısmi artı yükle yüklenmesi sonucu, başka veya aynı moleküldeki elektronegatif atom ile yaptığı kuvvetli bağdır. |
|||
Hidrojen baglari molekuller arasinda ya da bir molekulun farkli kisimlari arasinda olusabilir. Molekul geometrisi ve cevreye bagli olarak, hidrojen bagi serbest enerji kapasitesi 1 ile 5 kcal/mol arasindadir. Bu ozellik, hidrojen baglarini [[Van der waals]] etkilesiminden (zayif bir bag turu) guclu, [[Kovalent bağ|kovalent]] ve [[iyonik bağ]]<nowiki/>lardan zayif kilar. |
|||
[[Van der waals]] kuvvetinden güçlü olmasına karşın, tipik hidrojen bağı [[iyonik bağ]] ve [[kovalent bağ]]dan daha güçsüzdür. [[Protein]]ler ve [[nükleik asit]]ler gibi makromoleküller içinde, aynı molekülün iki parçası arasında var olabilir. |
|||
Hidrojen baglari inorganik molekuller arasinda (ornek: su molekulleri arasinda, ya da su ve NH3 arasinda) ya da organik molekuller arasinda (ornek: DNA ve proteinler) arasinda olusabilir. Su molekulleri arasinda olusan hidrojen baglari, suyun yuksek kaynama noktasinin sebebidir (100 °C). Molekuller arasi olusan hidrojen baglari [[protein]]<nowiki/>lerin ikincil ve ucuncul yapilari ve [[Nükleik asit|nukleik asit]]<nowiki/>lerin yapisal olusumunda onemli bir yere sahiptir. |
|||
''Hidrojen bağı'' ismi, bağın bir [[hidrojen]] atomunu kapsamasından gelir. Genelde bağ, hidrojenin [[flor]], [[oksijen]] ve [[azot]] gibi elektronegatifliği yüksek atomlarla yapmış olduğu kuvvetli bir etkileşim türüdür.(Sadece F,O,N ile H atomu arasında oluşabilir) |
|||
2011 yilinda [[Uluslararası Temel ve Uygulamalı Kimya Birliği|IUPAC]] Grubunun onerisiyle gelisen hidrojen bagi tanimi, Pure and Applied Chemistry<ref>https://www.iupac.org/publications/pac/</ref> akademik mecmuasinda soyle yayinlanmistir: Hidrojen baglari, bir molekuldeki hidrojen atomu ya da X-H molekul parcaciginin (X, H’den daha electronegatif) ve ayni ya da farkli bir molekuldeki bir atom ya da atom grubunun arasindaki cekimsel etkilesimdir<ref>Elangannan Arunan1,‡, Gautam R. Desiraju2, Roger A. Klein3, Joanna Sadlej4, Steve Scheiner5, Ibon Alkorta6, David C. Clary7, Robert H. Crabtree8, Joseph J. Dannenberg9, Pavel Hobza10, Henrik G. Kjaergaard11, Anthony C. Legon12, Benedetta Mennucci13, and David J. Nesbitt14 (2011) "Definition of the hydrogen bond (IUPAC Recommendations 2011)" [https://www.iupac.org/publications/pac/pdf/2011/pdf/8308x1637.pdf Pure Appl. Chem.], Vol.83, No. 8, pp. 1637–1641, 2011. [https://www.iupac.org/publications/pac/pdf/2011/pdf/8308x1637.pdf doi:10.1351/PAC-REC-10-01-02] © 2011 IUPAC, Publication date (Web): 8 July 2011</ref>. |
|||
Eğer hidrojen bağı atomu iki atom arasında ortak kullanılıyor ise meydana gelen iki molekül arasındaki zayıf bir bağdır. |
|||
Hidrojen bağları genellikle oksijen ve azot gibi negatif elektrik yüklü atomlarla diğer bir negatif yüklü atomlara kovalent olarak bağlanmış hidrojen atomları arasında oluşan bağlardır. |
|||
Dipol dipol etkileşmesinin kimyadaki en bariz örneğini teşkil eder. |
|||
Hidrojen Bağı Van der Waals bağından güçlüdür , molekülleri arasında daha güçlü etkileşim olan maddenin kaynama noktası daha yüksektir.Bu yüzden hidrojen bağı içeren maddelerin erime - kaynama noktaları Van der Waals bağı içeren maddelere göre daha yüksektir.İki farklı molekül birbirleriyle hidrojen bağı oluşturabilir. |
|||
== Kaynaklar == |
== Kaynaklar == |
||
* [http://en.wikipedia.org/w/index.php?title=Hydrogen_bond&oldid=85288990 2 Kasım 2006 tarihli İngilizce Wikipedia maddesi] |
* [http://en.wikipedia.org/w/index.php?title=Hydrogen_bond&oldid=85288990 2 Kasım 2006 tarihli İngilizce Wikipedia maddesi] |
||
* [[:en:Hydrogen_bond#cite_note-6|21 Subat 2017 tarihli Vikipedi makalesi]] |
|||
* [http://chemistry.elmhurst.edu/vchembook/161Ahydrogenbond.html Elmhurst chembook] |
|||
{{fiziksel kimya-taslak}} |
{{fiziksel kimya-taslak}} |
||
Sayfanın 17.43, 26 Şubat 2017 tarihindeki hâli
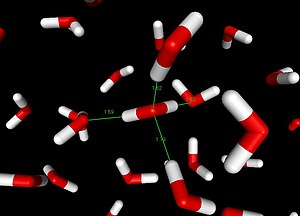

Hidrojen bağı, bir hidrojen (H, arti yuklu) atomunun elektronegatifligi oldukca yuksek baska bir atoma (oksijen (O), azot (N) ya da flor (F) gibi, eksi yuklu) kovalent baglarla baglanmasi sonucu olusan polar molekülun (ornegin su (H2O) molekulu) hidrojeni ile baska bir molekulun elektronegatif atomu arasinda olusan zayif kimyasal bagdir. Canli hucrelerde, elektronegatif molekuller genellikle oksijen ya azot atomlaridir. Yasamsal acidan, zayif kimyasal baglar arasinda oldukca onemli bir yere sahiptir[1].
Hidrojen baglari molekuller arasinda ya da bir molekulun farkli kisimlari arasinda olusabilir. Molekul geometrisi ve cevreye bagli olarak, hidrojen bagi serbest enerji kapasitesi 1 ile 5 kcal/mol arasindadir. Bu ozellik, hidrojen baglarini Van der waals etkilesiminden (zayif bir bag turu) guclu, kovalent ve iyonik bağlardan zayif kilar.
Hidrojen baglari inorganik molekuller arasinda (ornek: su molekulleri arasinda, ya da su ve NH3 arasinda) ya da organik molekuller arasinda (ornek: DNA ve proteinler) arasinda olusabilir. Su molekulleri arasinda olusan hidrojen baglari, suyun yuksek kaynama noktasinin sebebidir (100 °C). Molekuller arasi olusan hidrojen baglari proteinlerin ikincil ve ucuncul yapilari ve nukleik asitlerin yapisal olusumunda onemli bir yere sahiptir.
2011 yilinda IUPAC Grubunun onerisiyle gelisen hidrojen bagi tanimi, Pure and Applied Chemistry[2] akademik mecmuasinda soyle yayinlanmistir: Hidrojen baglari, bir molekuldeki hidrojen atomu ya da X-H molekul parcaciginin (X, H’den daha electronegatif) ve ayni ya da farkli bir molekuldeki bir atom ya da atom grubunun arasindaki cekimsel etkilesimdir[3].
Kaynaklar
- 2 Kasım 2006 tarihli İngilizce Wikipedia maddesi
- 21 Subat 2017 tarihli Vikipedi makalesi
- Elmhurst chembook
| Fiziksel kimya ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. |
- ^ Campbell Biology, 11th Edition By Lisa A. Urry, Michael L. Cain, Steven A. Wasserman, Peter V. Minorsky, Jane B. Reece Published by Pearson Copyright © 2017 Published Date: Oct 19, 2016
- ^ https://www.iupac.org/publications/pac/
- ^ Elangannan Arunan1,‡, Gautam R. Desiraju2, Roger A. Klein3, Joanna Sadlej4, Steve Scheiner5, Ibon Alkorta6, David C. Clary7, Robert H. Crabtree8, Joseph J. Dannenberg9, Pavel Hobza10, Henrik G. Kjaergaard11, Anthony C. Legon12, Benedetta Mennucci13, and David J. Nesbitt14 (2011) "Definition of the hydrogen bond (IUPAC Recommendations 2011)" Pure Appl. Chem., Vol.83, No. 8, pp. 1637–1641, 2011. doi:10.1351/PAC-REC-10-01-02 © 2011 IUPAC, Publication date (Web): 8 July 2011
