Karbon-karbon bağı
Karbon-karbon bağı, iki karbon atomu arasındaki kovalent bir bağdır.[1] En yaygın şekli tekli bağdır: iki atomun her birinden birer tane olmak üzere iki elektrondan oluşan bir bağ. Karbon-karbon tekli bağı bir sigma bağıdır ve karbon atomlarının her birinden bir hibridize orbital arasında oluşur. Etanda orbitaller sp3-hibridize orbitallerdir, ancak diğer hibridizasyonlara sahip karbon atomları arasında oluşan tek bağlar meydana gelir (örneğin sp2'den sp2'ye). Aslında, tekli bağdaki karbon atomlarının aynı hibridizasyona sahip olması gerekmez. Karbon atomları ayrıca alken adı verilen bileşiklerde çift bağ veya alkin adı verilen bileşiklerde üçlü bağ oluşturabilir. Bir çift bağ, sp2-hibritleşmiş bir orbital ve hibritleşmeye dahil olmayan bir p-orbitali ile oluşturulur. Üçlü bağ, sp-hibritleşmiş bir orbital ve her atomdan iki p-orbitali ile oluşturulur. P-orbitallerinin kullanımı bir pi bağı oluşturur.[2]
Zincirler ve dallanma
[değiştir | kaynağı değiştir]Karbon, kendi atomlarından uzun zincirler oluşturabilen birkaç elementten biridir, bu özelliğe katenasyon denir. Bu özellik karbon-karbon bağının gücüyle birleştiğinde, birçoğu yaşamın önemli yapısal unsurları olan muazzam sayıda moleküler form ortaya çıkar, bu nedenle karbon bileşiklerinin kendi çalışma alanları vardır: organik kimya.
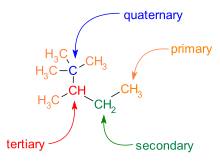
Dallanma C-C iskeletlerinde de yaygındır. Bir moleküldeki karbon atomları, sahip oldukları karbon komşularının sayısına göre kategorize edilir:
- Birincil karbonun bir karbon komşusu vardır.
- İkincil karbonun iki karbon komşusu vardır.
- Üçüncül karbonun üç karbon komşusu vardır.
- Dördüncül karbonun dört karbon komşusu vardır.
"Yapısal olarak karmaşık organik moleküllerde", molekülün şeklini belirleyen kuaterner lokuslardaki karbon-karbon bağlarının üç boyutlu yönelimidir.[3] Ayrıca, kuaterner lokuslar kortizon ve morfin gibi biyolojik olarak aktif birçok küçük molekülde bulunur.[3]
Sentez
[değiştir | kaynağı değiştir]Karbon-karbon bağı oluşturma reaksiyonları, yeni bir karbon-karbon bağının oluştuğu organik reaksiyonlardır. İlaçlar ve plastikler gibi insan yapımı birçok kimyasalın üretiminde önemlidir. Bir karbon-karbon bağının kırıldığı ters reaksiyon, karbon-karbon bağı aktivasyonu olarak bilinir.
Karbon-karbon bağı oluşturan reaksiyonlara örnek olarak aldol reaksiyonu, Diels-Alder reaksiyonu, Grignard reaksiyonu, çapraz bağlama reaksiyonları, Michael bağlama reaksiyonu ve Wittig reaksiyonu verilebilir.
Üçüncül karbonlar için istenen üç boyutlu yapıların yönlendirilmiş sentezi 20. yüzyılın sonlarında büyük ölçüde çözüldü, ancak dördüncül karbon sentezini yönlendirmek için aynı yetenek 21. yüzyılın ilk on yılına kadar ortaya çıkmaya başlamadı.[3]
Bağ kuvvetleri ve uzunlukları
[değiştir | kaynağı değiştir]Karbon-karbon tekli bağı C-H, O-H, N-H, H-H, H-Cl, C-F ve birçok ikili veya üçlü bağdan daha zayıftır ve C-O, Si-O, P-O ve S-H bağları ile karşılaştırılabilir,[4] ancak genellikle güçlü olarak kabul edilir.
| C-C bağı | Molekül | Bağ ayrışma enerjisi (kcal/mol) |
|---|---|---|
| CH3−CH3 | etan | 90 |
| C6H5−CH3 | toluen | 102 |
| C6H5−C6H5 | bifenil | 114 |
| CH3C(O)−CH3 | aseton | 84 |
| CH3−CN | asetonitril | 136 |
| CH3−CH2OH | etanol | 88 |
Yukarıda verilen değerler yaygın olarak karşılaşılan C-C bağ ayrışma enerjilerini temsil etmektedir; zaman zaman aykırı değerler bu aralıktan büyük ölçüde sapabilir.
| Molekül | Etan | Etilen | Asetilen |
|---|---|---|---|
| Formül | C2H6 | C2H4 | C2H2 |
| Sınıf | alkan | alken | alkin |
| Yapı | 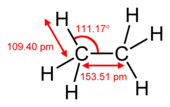
|

|

|
| Karbonun hibridizasyonu | sp3 | sp2 | sp |
| C-C bağ uzunluğu | 153.5 pm | 133.9 pm | 120.3 pm |
| C-C tekli bağ oranı | 100% | %87 | %78 |
| Yapı belirleme yöntemi | mikrodalga spektroskopisi | mikrodalga spektroskopisi | kızılötesi spektroskopisi |
Olağanüstü durumlar
[değiştir | kaynağı değiştir]Uzun, zayıf C-C tekli bağları
[değiştir | kaynağı değiştir]C-C bağının uzadığı çeşitli uç durumlar tespit edilmiştir. Gomberg'in dimerinde, bir C-C bağı 159,7 pikometre ile oldukça uzundur. Çözeltide oda sıcaklığında tersine çevrilebilir ve kolayca kırılan bu bağdır:[6]
Daha da sıkışık olan hekzakis(3,5-di-tert-butilfenil)etan molekülünde, stabilize triarilmetil radikalini oluşturmak için bağ ayrışma enerjisi sadece 8 kcal/mol'dür. Ayrıca şiddetli sterik sıkışıklığının bir sonucu olarak, hekzakis(3,5-di-tert-butilfenil)etan 167 pm uzunluğunda büyük ölçüde uzatılmış bir merkezi bağa sahiptir.[7]
Bükülmüş, zayıf C-C çift bağları
[değiştir | kaynağı değiştir]Tetrakis(dimetilamino)etilenin (TDAE) yapısı oldukça bozuktur. C=C mesafesi normal 135 pm olmasına rağmen iki N2C ucu için dihedral açı 28º'dir. Neredeyse izostrüktürel tetraizopropiletilen de 135 pm'lik bir C=C mesafesine sahiptir, ancak C6 çekirdeği düzlemseldir.[8]
Kısa, güçlü C-C üçlü bağları
[değiştir | kaynağı değiştir]Diğer uçta, diasetilenin merkezi karbon-karbon tek bağı 160 kcal/mol ile çok güçlüdür, çünkü tek bağ sp hibridizasyonunun iki karbonunu birleştirir.[9] Karbon-karbon çoklu bağları genellikle daha güçlüdür; etilenin çift bağının ve asetilenin üçlü bağının bağ ayrışma enerjilerinin sırasıyla 174 ve 230 kcal/mol olduğu belirlenmiştir.[10] İyodonyum türü [HC≡C-I+Ph] [CF3SO3-] için, güçlü bir şekilde elektron çeken iyodonyum kısmı nedeniyle 115 pm'lik çok kısa bir üçlü bağ gözlenmiştir.[11]
Kaynakça
[değiştir | kaynağı değiştir]- ^ Dembicki, Harry (6 Ekim 2016). Practical Petroleum Geochemistry for Exploration and Production (İngilizce). Elsevier. s. 7. ISBN 9780128033517.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th bas.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ a b c Quasdorf, Kyle W.; Overman, Larry E. (Aralık 2014). "Catalytic enantioselective synthesis of quaternary carbon stereocentres". Nature (İngilizce). 516 (7530): 181-191. doi:10.1038/nature14007. ISSN 1476-4687. 31 Ocak 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Nisan 2024.
- ^ Yu-Ran Luo and Jin-Pei Cheng "Bond Dissociation Energies" in CRC Handbook of Chemistry and Physics, 96th Edition.
- ^ CRC Handbook of Chemistry and Physics, 88th edition
- ^ Bochkarev, L. N.; Molosnova, N. E.; Zakharov, L. N.; Fukin, G. K.; Yanovsky, A. I.; Struchkov, Y. T. (1995). "1-Diphenylmethylene-4-(triphenylmethyl)cyclohexa-2,5-diene Benzene Solvate". Acta Crystallographica Section C Crystal Structure Communications. 51 (3). ss. 489-491. doi:10.1107/S0108270194009005.
- ^ Rösel, Sören; Balestrieri, Ciro; Schreiner, Peter R. (2017). "Sizing the role of London dispersion in the dissociation of all-meta tert-butyl hexaphenylethane". Chemical Science (İngilizce). 8 (1). ss. 405-410. doi:10.1039/c6sc02727j. ISSN 2041-6520. PMC 5365070 $2. PMID 28451185.
- ^ Bock, Hans; Borrmann, Horst; Havlas, Zdenek; Oberhammer, Heinz; Ruppert, Klaus; Simon, Arndt (1991). "Tetrakis(dimethylamino)ethene: An Extremely Electron-Rich Molecule with Unusual Structure both in the Crystal and in the Gas Phase". Angewandte Chemie International Edition in English. 30 (12). ss. 1678-1681. doi:10.1002/anie.199116781.
- ^ "NIST Webbook". 23 Nisan 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Nisan 2024.
- ^ Blanksby, Stephen J.; Ellison, G. Barney (April 2003). "Bond Dissociation Energies of Organic Molecules". Accounts of Chemical Research (İngilizce). 36 (4). ss. 255-263. CiteSeerX 10.1.1.616.3043 $2. doi:10.1021/ar020230d. ISSN 0001-4842. PMID 12693923.
- ^ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (1992). Introduction to organic chemistry. 4th. Upper Saddle River, N.J.: Prentice Hall. s. 574. ISBN 978-0139738500. OCLC 52836313.

