SDS-PAGE
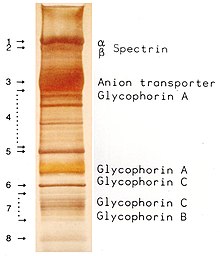
SDS-PAGE (sodyum dodesil sülfat–poliakrilamid jel Elektroforez) bir poliakrilamid jel elektroforez varyantı olan ve biyokimyada karışımlardaki yüklü molekülleri elektrik alan varlığında moleküler kütlelerine göre ayıran analitik bir metottur. Sodyum dodesil sülfat (SDS) molekülleri proteinlerin izolasyon ve tanımlanmasına yardım ederler.
Bu süreksiz elektroforetik sistemi Ulrich K. Laemmli tarafından geliştirilmiştir. Bu teknik molekül kütlesi 5 ve 250 KDa arasında arasında olan proteinleri iyi ayırır.[1] Bu metodu açıklayan makale, tek kişi tarafından yazılmış en çok atıf almış makale iken totalde ise ikinci en çok atıf almış makaledir.[2]
Özellikleri[değiştir | kaynağı değiştir]
SDS-PAGE proteinlerin moleküler kütlelerine göre ayrımına izin veren bir yöntemdir. Aynı zamanda matrix olarak bilinen medyum poliakrilamid temelli devamsız bir jeldir. Buna ek olarak, SDS kullanılır. Yaklaşık 1.4 gram SDS 1 gram proteine bağlanır,[3][4][5] yani her bir aminoasite 2 SDS molekülü bağlanmış olur. SDS yüzey aktif madde olarak davranır, proteinlerin kendi taşıdıkları yüklerin üzerini kaplar ve böylece proteinlerin kendi yükleri kaybolmuş ve ayrım yük temelinde gerçekleşmemiş olur. Ayrıca pozitif yükler de ayırma jelinin bazik pH'ı ile yüksek oranda indirgenir.Belli bir elektrik alanın varlığında proteinler anottan katoda doğru ilerler bu ilerlemenin hızı moleküler kütlenin büyüklüğü ile değişir. Bu basit prosedür proteinlerin moleküler kütle temelinde hassas ayrımına olanak sağlar.


Prosedür[değiştir | kaynağı değiştir]
SDS-PAGE metodu jelin hazırlanması, numunenin hazırlanması, elektroforez, protein boyama veya western blot ve oluşan bantların incelenmesinden ibarettir.
Jel üretimi[değiştir | kaynağı değiştir]

Jel, readikal polimerizasyonu ile birbirine mühürlü iki cam parçasından oluşan kalıbın içinde oluşur. Bu iki cam parçası maşalar yardımı ile geçici olarak mühürlenir. Jel solusyonu monomer olan acrilamid, çapraz bağlardan sorumlu metilenbisacrilamid, yarılma ve sıkışma tamponları, su ve SDS' ten ibarettir. TEMED katalizörü ve başlatıcı amonyum persülfat (APS) ortama eklemek polimerizasyonu başlatır.

Numune hazırlama[değiştir | kaynağı değiştir]

Numune hazırlamada, numune tamponu ve SDS çok miktarda numuneye uygulandıktan sonra numune 95 °C' de 5 dakika ısıtılır. Bu işlemler hidrojen bağlarını yıkarak 2. ve 3. yapıları bozar. Posiyonel olarak disülfid bağları indirginme ile kırılabilir. Bu amaçla, β-merkaptoetanol (β-ME 5% (v/v)), ditiotireitol (DTT, 10 milimolar) veya ditioeritiritol (DTE, 10 millimolar) gibi indirgen tioller numune tamponuna eklenir. Oda sıcaklığında soğutma sonrasında numune daha önceden elektroforez tamponuna batırılmış jeldeki ceplere yüklenir. Numunelere ek markır yüklenir. Bu metot ±10% yanılma payına sahiptir.[6]
Elektroforez[değiştir | kaynağı değiştir]

Jel boyama[değiştir | kaynağı değiştir]

Moleküler kütle hesabı[değiştir | kaynağı değiştir]

Dış bağlantılar[değiştir | kaynağı değiştir]
- OpenWetWare: protocol for BisTris SDS-PAGE 4 Ekim 2018 tarihinde Wayback Machine sitesinde arşivlendi.
Kaynakça[değiştir | kaynağı değiştir]
- ^ Laemmli, U. K. (1970). "Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4". Nature. 227 (5259). ss. 680-685. doi:10.1038/227680a0. ISSN 0028-0836.
- ^ Neue Zürcher Zeitung: Interview with Ulrich Lämmli in German 15 Ekim 2012 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ Reynolds, Jacqueline A.; Tanford, Charles (1970). "Binding of dodecyl sulfate to proteins at high binding ratios. Possible implications for the state of proteins in biological membranes". Proc Natl Acad Sci U S A. 66 (3). ss. 1002-7. doi:10.1073/pnas.66.3.1002. PMC 283150 $2. PMID 5269225.
- ^ Smith, B. J. (1984). SDS Polyacrylamide Gel Electrophoresis of Proteins. 1. ss. 41–56. DOI:10.1385/0-89603-062-8:41.
- ^ Staikos, Georgios; Dondos, Anastasios (2009). "Study of the sodium dodecyl sulphate–protein complexes: evidence of their wormlike conformation by treating them as random coil polymers". Colloid and Polymer Science. 287 (8). ss. 1001-1004. doi:10.1007/s00396-009-2059-3. ISSN 0303-402X.
- ^ Rosenberg, Ian M. (22 Aralık 2006). Protein Analysis and Purification: Benchtop Techniques. Springer Science & Business Media. ss. 103-. ISBN 978-0-8176-4412-3.
