Konukçu-konuk kimyası
Konukçu-konuk kimyası; Supramoleküler kimyada[1] tam kovalent bağlar dışındaki kuvvetler tarafından benzersiz yapısal ilişkilerde bir arada tutulan iki veya daha fazla molekül ya da iyondan oluşan kompleksleri tanımlar. Kovalent olmayan bağlanma yoluyla moleküler tanıma ve etkileşim fikrini kapsar. Kovalent olmayan bağlanma, proteinler gibi büyük moleküllerin 3 boyutlu yapısının korunmasında kritik öneme sahiptir ve büyük moleküllerin spesifik olarak ancak geçici olarak birbirine bağlandığı birçok biyolojik süreçte yer alır.
Kovalent olmayan etkileşimler kabaca daha elektrostatik veya dağıtıcı katkılara sahip olanlara bölünebilse de, yaygın olarak bahsedilen birkaç kovalent olmayan etkileşim türü vardır: iyonik bağ, hidrojen bağ, van der Waals kuvvetleri ve hidrofobik etkileşimler.[2]
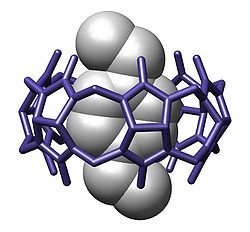

Genel bakış[değiştir | kaynağı değiştir]
Konukçu-konuk kimyası, bir konukçu molekülün bir konuk molekül veya iyon ile kimyasal bir bileşik oluşturduğu supramoleküler kimyanın bir dalıdır. Bileşiğin iki bileşeni kovalent olmayan kuvvetlerle, en yaygın olarak hidrojen bağıyla bir arada tutulur. Konuçu ve konuk arasındaki bağlanma genellikle ilgili iki gruba özeldir. Bu komplekslerin oluşumu, moleküler tanıma konusunun merkezindedir.
Konukçu ve konukun birbirinden ayrı olduğu bağlanmamış durum arasında bir denge vardır ve yapısal olarak tanımlanmış bir konukçu-konuk kompleksinin bulunduğu bağlı durum:
- H = "konukçu", G = "konuk", HG = "konukçu-konuk kompleksi"
"Konukçu" bileşeni, daha büyük molekül olarak kabul edilebilir ve daha küçük olan "konuk" molekülünü kapsar. Biyolojik sistemlerde benzer konukçu ve konuk terimleri, genellikle sırasıyla enzim ve substrat olarak adlandırılır.[5]
Belirli işlevleri ve görevleri yerine getiren sentetik sistemler tasarlamak için konukçu ile konuk arasındaki bağlanmanın termodinamiğini anlamak çok önemlidir. Kimyagerler, farklı bağlanma etkileşimlerinin enerji alışverişine odaklanıyor ve NMR spektroskopisi, UV spektroskopi ve izotermal titrasyon kalorimetrisi gibi çeşitli teknikleri kullanarak bu kovalent olmayan etkileşimlerin temel kökenlerini ölçmek için bilimsel deneyler geliştirmeye çalışıyorlar.[6] Bağlanma sabit değerlerinin kantitatif analizi, faydalı termodinamik bilgiler sağlar.[5]
Konukçu-konuk etkileşimlerinin termodinamik prensipleri[değiştir | kaynağı değiştir]
Konukçu-konuk kimyasının termodinamik faydaları, konukçu ve konuk moleküller arasındaki etkileşime bağlı olarak genel Gibbs serbest enerjisinin daha düşük olduğu fikrinden kaynaklanmaktadır. Kimyacılar, supramoleküler kimyada bulunan bu kovalent olmayan etkileşimlerin enerjisini ve termodinamik özelliklerini kapsamlı bir şekilde ölçmeye çalışıyorlar ve bunu yaparak, supramoleküler yapı üzerinde genel bir etki yaratmak için kullanılan bu çok sayıda, küçük ve kovalent olmayan kuvvetin birleşimsel sonucu hakkında daha fazla bilgi edinmeyi umuyorlar.
Bir ilişki sabiti, ifadesi ile tanımlanabilir.
Buradaki {HG}, kompleksin dengedeki termodinamik aktivitesidir. {H} konukçu aktivitesini ve {G} konuğun aktivitesini temsil eder. , ve gösterimleri konsantrasyonlara karşılık gelir ve aktivite katsayılarının bir bölümüdür.
Pratikte denge sabiti genellikle konsantrasyonlar olarak tanımlanır.
Bu tanım kullanıldığında, aktivite katsayılarının bölümünün sayısal bir değeri olduğu ima edilmektedir. Daha sonra denge sabiti boyutunun 1/konsantrasyona sahip olduğu ancak standart Gibbs serbest enerjisi değiştiği için bu doğru olamaz ve , K'nın logaritması ile orantılıdır.
Bu bariz paradoks, boyutu konsantrasyonlar bölümünün boyutunun karşılığı olarak tanımlandığında çözülür. Bunun anlamı, 'nın ilgili tüm deneysel koşullar altında sabit bir değere sahip olduğunun kabul edilmesidir. Bununla birlikte, deneysel olarak belirlenen bir K değerine litre başına milimol veya litre başına mikromol gibi bir boyut eklemek yaygın bir uygulamadır.
Büyük bir değeri, konukçu ve konuk moleküllerin, konukçu-konuk kompleksini oluşturmak için güçlü bir şekilde etkileşime girdiğini gösterir.
Bağlanma sabit değerlerinin belirlenmesi[değiştir | kaynağı değiştir]
Basit konukçu-konuk kompleksi[değiştir | kaynağı değiştir]
Konukçu ve konuk moleküller bir kompleks oluşturmak için birleştiğinde denge şu şekilde temsil edilir:
ve denge sabiti K şu şekilde tanımlanır:
Burada [X], X kimyasal türünün konsantrasyonunu gösterir (tüm aktivite katsayılarının sayısal değerlerinin 1 olduğu varsayılır). Herhangi bir veri noktasındaki kütle dengesi denklemleri,
ve konukçu ve konuğun toplam konsantrasyonlarını temsil ettiği yerlerde, örneğin [G] 'de tek bir ikinci dereceden denkleme indirgenebilir ve böylece herhangi bir K değeri için analitik olarak çözülebilir. [H] ve [HG] konsantrasyonları daha sonra türetilebilir.
Hesaplamadaki bir sonraki adım, gözlemlenen ifadesine karşılık gelen miktarın değerini hesaplamaktır. Daha sonra kareler toplamı U ve tüm veri noktalarında np şu şekilde tanımlanabilir:
ve bu, stabilite sabiti değeri K ve HG türünün kimyasal kayması (nmr verileri) veya molar emilimi (uv/vis verileri) gibi bir parametre ile ilgili olarak en aza indirilebilir. Küçültme, dahili SOLVER yardımcı programı kullanılarak EXCEL gibi bir elektronik tablo uygulamasında gerçekleştirilebilir.
Bu prosedür, yalnızca 1:1 eklentisinin oluşan tek karmaşık tür olduğu kesin olduğunda kullanılmalıdır. Bu iddianın geçerliliğine ilişkin basit bir kontrol, kalıntıların rastgele bir dağılım göstermesi gerektiğidir, aksi takdirde ikinci bir türün oluşumu dikkate alınmalıdır.
Nükleer manyetik rezonans (NMR) verileri[değiştir | kaynağı değiştir]
Nükleer manyetik rezonans (NMR) spektrumları ile, bir reaktif molekülünde bulunan belirli bir atomdan ve bu reaktifin bir veya daha fazla kompleksinden kaynaklanan gözlenen kimyasal kayma değeri δ, bu kimyasal türlerin tüm kaymalarının konsantrasyon ağırlıklı ortalaması olacaktır. NMR zaman ölçeğinde kimyasal değişimin hızlı olduğu varsayılır. Mol fraksiyonları terimleri,
, çekirdeği içeren i'nci kimyasal türlerin kimyasal kaymasıdır ve , bu türlerin konsantrasyonu/mol fraksiyonudur ( c bir konsantrasyon/mol dm−3'tür).
Bu ifade, Beer'in yasası ile aynı matematiksel forma sahiptir. Kimyasal kayma değerleri, emmenin birden fazla dalga boyunda ölçülebilmesine benzer bir şekilde birden fazla çekirdek için elde edilebilir. Bu bağlamda kullanılabilecek tipik izotoplar 1H 13C ve 31P'dir. 1H kimyasal kayma değerlerini ölçerken döteryumlanmış bir çözücü kullanmak olağandır.
Absorbans verileri[değiştir | kaynağı değiştir]

Beer-Lambert yasasına göre her türün absorbansının o türün konsantrasyonu ile orantılı olduğu varsayılmaktadır.
Burada λ bir dalga boyudur; , N bileşiklerinin (kromoforlar) çözeltisini içeren küvetin optik yol uzunluğudur; , λ dalga boyundaki i'inci kimyasal türün molar absorbansıdır (yok olma katsayısı olarak da bilinir); ci ise konsantrasyonudur. Konsantrasyonlar yukarıdaki gibi hesaplandığında ve çeşitli konukçu-konuk konsantrasyonlarına sahip numuneler için absorbans ölçüldüğünde Beer-Lambert yasası, belirli bir dalga boyunda, o dalga boyundaki bilinmeyen sönme katsayısı değerleri için doğrusal en küçük kareler işlemiyle çözülebilen bir dizi denklem sağlar.
Floresans verileri[değiştir | kaynağı değiştir]
Bu tür verilerin işlenmesi, absorbans verilerinin işlenmesine benzer. Aslında floresan yoğunluğu ve tür konsantrasyonları arasındaki ilişkiyi tanımlayan denklem çok benzerdir.
Burada , birim konsantrasyondaki i'inci türün floresan yoğunluğudur.
Kalorimetre[değiştir | kaynağı değiştir]
Konuku içeren çözeltiye bir miktar konukçu çözeltisi eklendiğinde ortaya çıkan ısı, her reaksiyondan gelen katkıların toplamıdır.
Burada; , j veri noktasında ölçülen ısı değişim değeridir (tüm yabancı ısı katkıları için düzeltildi); , i'nci reaksiyon ürününün 1 molü oluştuğunda emilen veya yayılan ısı miktarıdır; , o ürünün o veri noktasındaki mol sayısındaki gerçek değişimdir. , kütle-denge denklemlerinin verilen denge sabitlerinin değerleri ile çözülmesiyle hesaplanır. Denge sabit değerleri biliniyorsa, standart entalpi değişimi doğrusal en küçük kareler işlemiyle hesaplanabilir, aksi takdirde doğrusal olmayan bir veri uydurma yöntemi kullanılmalıdır.
İzotermal titrasyon kalorimetrisi, hem bir denge sabitinin hem de karşılık gelen standart reaksiyon entalpisinin değerlerini belirlemek için yaygın olarak kullanılır. ITC aletlerinin üreticileri, bu miktarların deneysel veri değerlerinden elde edilebileceği bazı yazılımları tedarik etmektedir.
Genel kompleksleşme reaksiyonu[değiştir | kaynağı değiştir]
Bir konukçu, H ve bir konuk G'yi içeren her denge için
denge sabiti , şu şekilde tanımlanır:
Serbest konsantrasyonların ve değerleri, kütle dengesi denklemlerinin kararlılık sabitleri için bilinen veya tahmin edilen değerlerle çözülmesiyle elde edilir.
Daha sonra, her bir kompleks türünün konsantrasyonları da olarak hesaplanabilir. Bir türün konsantrasyonu ile ölçülen miktar arasındaki ilişki, yukarıdaki her bölümde belirtildiği gibi ölçüm tekniğine özgüdür. Bu ilişkiyi kullanarak, molar absorptivite veya belirli kimyasal kaymalar gibi parametrelerin seti, stabilite sabiti değerleri ve özelliklerin değerleri, doğrusal olmayan en küçük kareler rafine edilebilir.
Standart entalpi ve entropi değişim değerlerinin belirlenmesi[değiştir | kaynağı değiştir]
İlk olarak, bir çözümün tek kompleks HG ile dengede olan belirli miktarlarda bir konukçu H ve bir konuk G içerdiği sistem düşünülür.
Sonra, dengede bir konukçu ve konuk karışımına az miktarda konuk eklendiği varsayılır. Bu durumda yeni bir denge kurulacak ve bir miktar Q ısısı gelişecektir. Bu miktar, araçsal faktörler için ölçüldüğünde ve düzeltildiğinde, çözelti içinde mevcut olan kompleks HG miktarındaki değişiklikle ilgilidir.
ΔH⊖, standart oluşum entalpisidir, yani kompleksin 1 mol oluşumu için entalpidir; HG ve çözeltideki HG türlerinin mol sayısındaki değişimdir.
Denge sabitinin değeri , biliniyorsa , kütle dengesi denklemlerinin toplamadan önce ve sonra çözülmesiyle hesaplanabilir. Daha sonra ΔH⊖ değeri, bir dizi Q deneysel değeri ile uydurulan doğrusal en küçük kareler yöntemi kullanılarak elde edilebilir.
K'nin değeri bilinmiyorsa, ve olmak üzere iki parametreyi elde etmek için doğrusal olmayan en küçük kareler ayrıntılandırması yapılmalıdır. Veriler bir izotermal titrasyon kalorimetresi kullanılarak elde edildiğinde, hesaplamalar için gerekli olan yazılım cihaz üreticisi tarafından sağlanır.
Not: Standart entalpi değişimini hesaplamak için van 't Hoff denklemi artık kullanılmamaktadır, çünkü bu yöntem kullanılarak elde edilen değer büyük olasılıkla aşırı hataya maruz kalacaktır.
Genel olarak, m kompleksleri oluştuğunda, k'inci titrasyon noktasında geliştirilen ısı, bir reaksiyon ürününün konsantrasyonundaki bir değişiklikten kaynaklanan katkıların toplamıdır.
Her reaksiyon ürününün oluşumu için standart bir entalpi değişimi ve bir denge sabiti belirlenecek 2m parametresi vardır. ITC cihaz üreticileri, birden çok parametre değerinin hesaplanabileceği birkaç özel yazılım ürünü tedarik etmektedir. HypΔH gibi genel durum için bilgisayar programları Afinimetre ITC'de mevcuttur.
Her bir standart entalpi değişiminin ve denge sabitinin değerleri belirlendiğinde, karşılık gelen standart entropi değişiminin değeri şu ifadeden türetilebilir.
T verilen sıcaklığında.
Deneysel teknikler[değiştir | kaynağı değiştir]
Nükleer manyetik rezonans[değiştir | kaynağı değiştir]
Nükleer manyetik rezonans (NMR), analitik kimyadaki en güçlü spektroskopik tekniklerden biridir. Agregalar, iyon çifti veya kapsüllenmiş sistemler şeklinde var olan çeşitli komplekslerin yapılarını aydınlatmak için konukçu-konuk kompleksleri çalışmaları için önemli bir araçtır. Adından da anlaşılacağı gibi NMR, moleküllerdeki farklı çekirdekleri (en yaygın olarak proton) kimyasal kaymalarını ölçerek tanımlar. İki molekülün bağlanma aktivitesi, elektronik ortamlarında önemli bir değişikliğe neden olur. Bu, NMR spektrumundaki sinyallerde bir kaymaya yol açar ve bu temel ilkeden, konukçu-konuk kimyası fenomenini incelemek için kullanılır. Konukçu-konuk bağlanmasının itici güçleri, hidrojen bağı ve pi-pi etkileşimi gibi moleküller arasındaki çeşitli ikincil etkileşimlerdir. Böylelikle NMR, bir konukçu-konuk kompleksinde bu etkileşimlerin varlığını tespit etmek için önemli bir teknik olarak hizmet eder.[7]

Önceki NMR çalışmaları, farklı konukların konuçulara bağlanması hakkında yararlı bilgiler vermiştir. Fox vd.[8] piridin molekülleri ile poliamidoamin (PAMAM) dendrimeri arasındaki hidrojen bağı etkileşimlerini amin ve amid gruplarının kimyasal kaymasına göre hesapladı. Benzer bir çalışmada Xu ve vd.[9] titre edilmiş karboksilat bazlı G4 PAMAM dendrimer (konukçu) çeşitli amin bazlı ilaçlar (konuklar) ile ve dendrimerin kimyasal kaymalarını izledi. 2D-NOESY NMR teknikleriyle bağlantılı olarak, ilaçların dendrimerler üzerindeki konumunu ve işlevselliğin ilaçların bağlanma afinitesi üzerindeki etkisini tam olarak tespit edebildiler. Katyonik ilaç moleküllerinin anyonik dendrimerlerin yüzeyine elektrostatik etkileşimlerle bağlandığını, oysa anyonik bir ilacın dendrimerlerin hem çekirdeğinde hem de yüzeyinde lokalize olduğunu ve bu etkileşimlerin gücünün moleküllerin pKa değerlerine bağlı olduğunu gösteren kesin kanıtlar buldular.
Farklı bir çalışmada Sun ve vd.[9] cucurbituril ile rutenyum trisbipiridil-viologen moleküllerinin konukçu-konuk kimyasını inceledi. Viologen üzerindeki piridin protonlarının kimyasal değişimlerini izlerken, 1:1 komplekslerinin bağlanma modlarının farklı cucurbituril molekülleri için tamamen farklı olduğunu bulmuşlardır.
Konukçu ve konuk arasındaki bağlanmayı analiz ederken akılda tutulması gereken önemli bir faktör, bağlanma olayının zamanına kıyasla veri toplama için geçen zamandır. Çoğu durumda, bağlanma olayları, veri edinme zaman ölçeğinden çok daha hızlıdır; bu durumda çıktı, ayrı moleküller ve kompleks için ortalama bir sinyaldir. NMR zaman ölçeği milisaniye mertebesinde olup, bazı durumlarda bağlanma reaksiyonunun hızlı olduğu durumlarda tekniğin doğruluğunu sınırlar.[5]
Ultraviyole-görünür spektroskopi[değiştir | kaynağı değiştir]

Ultraviyole ile görülebilir spektroskopi, çeşitli moleküllerin bağlanma aktivitesini araştırmanın en eski ve en hızlı yöntemlerinden biridir. UV ışığının absorpsiyonu pikosaniye zaman ölçeğinde gerçekleşir, bu nedenle türlerden gelen bireysel sinyaller gözlemlenebilir. Aynı zamanda, absorpsiyonun yoğunluğu, türlerin konsantrasyonu ile doğrudan ilişkilidir, bu da ilişki sabitinin kolay hesaplanmasını sağlar.[5] En yaygın olarak, ya konukçu ya da konuk, UV-ışığına karşı saydam iken, diğer molekül UV-duyarlıdır. UV'ye duyarlı moleküllerin konsantrasyonundaki değişiklik böylece izlenir ve birleşme sabitinin doğrudan hesaplanabildiği Benesi-Hildebrand yöntemi kullanılarak düz bir çizgiye yerleştirilir.
Benesi-Hilderbrand yöntemi, konukçu ve konuk arasında 1:1'lik bir stoikiometri varsaydığından, komplekslerin stokiyometrisi hakkında ek bilgi de elde edilir. Veriler, ancak kompleks oluşumu da benzer bir 1:1 stokiyometrisini takip ederse düz bir çizgi verecektir. Benzer hesaplamanın yakın tarihli bir örneği Sun vd. tarafından yapıldı,[9] burada rutenyum trisbipiridil-viologen moleküllerini kabakturillerle titre ettiler ve kabakgil moleküllerinin göreceli absorbansını belirli bir dalga boyundaki toplam konsantrasyonunun bir fonksiyonu olarak çizdiler. Veriler, 'nın bağlanma sabitine sahip bir 1:1 bağlama modeline güzel bir şekilde uymuştur.
Bir uzantı olarak, konukçu ve konuk arasındaki bağlanma olaylarının kinetiğini anlamak için veriler farklı stokiyometrilere sığdırılabilir.[10] Bu sonuç, diğer parametrelerle birlikte çeşitli konuk imidazoller ve amino asit metil esterleri ile baryum içeren kron eter köprülü kiral heterotrinükleer salen Zn(II) kompleksi arasındaki kompleksleşme reaksiyonunun sırasını elde etmek için geleneksel Benesi-Hilderbrand grafiğini biraz değiştirmek için kullanıldı. 368 nm'de pi'den pi'ye* geçiş bandının absorbansındaki değişiklikleri izlerken, değişen miktarlarda imidazoller ve metil esterler ile sabit bir çinko kompleksi konsantrasyonu titre ettiler. Veriler, komplekste konuk-konukçu oranının 2 olduğu bir modele uyar. Bu deneyleri, van 't Hoff denklemini kullanarak çeşitli termodinamik parametreleri hesaplamalarını sağlayan çeşitli sıcaklıklarda gerçekleştirdiler.
İzotermal titrasyon kalorimetrisi[değiştir | kaynağı değiştir]
Spektroskopik teknikler bağlanma sabiti ve Gibbs serbest enerjisi hakkında bilgi verir. ve gibi termodinamik parametrelerin tam setini elde etmek için van 't Hoff denklemini kullanan bir van' t Hoff analizi gerekli olacaktır. Bununla birlikte, kalorimetrik tekniklerdeki son gelişmeler, tek bir deneyde ve 'nin ölçülmesine izin verir ve böylece denklem kullanılarak tüm termodinamik parametrelerin belirlenmesini sağlar:
Deneyin izotermal koşullar altında yapılması şarttır; bu nedenle dizotermal kalorimetri adı verilir. Prosedür, konvansiyonel bir titrasyon prosedürüne benzer olup, burada konukçuya sırayla konuka eklenir ve emilen veya gelişen ısı boş bir solüsyonla karşılaştırıldığında ölçülür. Açığa çıkan toplam ısı Q, denklem tarafından ve ilişkilendirme sabitine karşılık gelir:
Herhangi biri şu şekilde basitleştirilebilir:
olmak üzere,
- = Konukçunun ilk molar konsantrasyonu
- = Konukun molar konsantrasyonu
- = Vessel hacmi
Yukarıdaki denklem doğrusal olmayan regresyon analizi ile çözülerek ve '^nin değeri ve ardından bu özel reaksiyon için ve 'nin değeri elde edilebilir.[5] İzotermal titrasyon kalorimetrisinin diğer yaygın olarak kullanılan tekniklere göre avantajları, tüm termodinamik parametreleri vermenin yanı sıra, daha genel olması ve çok çeşitli moleküller için uygun olmasıdır. Isı sinyali, bağlanma reaksiyonlarının evrensel bir özelliği olduğundan, bağlanma sürecini izlemek için kromoforlu veya UV ile görünür fonksiyonel gruplara sahip bileşiklere sahip olmak gerekli değildir. Aynı zamanda, sinyal-gürültü oranı oldukça uygundur, bu da çok seyreltik koşullar altında bile bağlanma sabitlerinin daha doğru belirlenmesine izin verir.[11] Bu tekniğin kullanımının yeni bir örneği, Escherichia coli'yi çevreleyen protein zarının, çeşitli zar mimetik ortamlarında ilaçlarda kullanılan lipofilik katyonlara bağlanma afinitesinin incelenmesi içindi. Yukarıdaki çalışmanın motivasyonu, bu zarların bakterileri, antibakteriyel etkilere sahip olan kuaterner amonyum katyonuna dayanan çoğu bileşiğe dirençli hale getirmesiydi. Bu nedenle bağlanma fenomeninin anlaşılması, E. coli için etkili antibiyotiklerin tasarlanmasını sağlayacaktır. Araştırmacılar, bağlanma reaksiyonunun tamamlanmasına izin vermek için protein üzerinde ligandın büyük bir fazlasını muhafaza ettiler. Araştırmacılar, yukarıdaki denklemleri kullanarak farklı ortamlardaki her ilaç için , , ve 'yi hesaplamaya devam ettiler. Veriler, ilacın zara bağlanma stokiyometrisinin 1:1 mikromolar değerinde olduğunu gösterdi. Negatif , ve değerleri, prosesin her ilaç için 8-12 kcal/mol değerinde entalpi sürüldüğünü gösterdi.[12]
Uygulamalar[değiştir | kaynağı değiştir]
Raman spektroskopisi[değiştir | kaynağı değiştir]
Raman spektroskopisi, üzerine monokromatik ışık geldiğinde bir Raman saçılma etkisi sergileyen moleküllerin çalışmasında kullanılan spektroskopik bir tekniktir. Bir Raman sinyali almanın temel şartı, olay ışığının kimyasal türlerde temel durumundan sanal enerji durumuna elektronik bir geçişe neden olmasıdır, bu da temel duruma döndüğünde bir foton yayar. Emilen ve yayılan foton arasındaki enerji farkı, elektronik ortamına bağlı olarak her kimyasal tür için benzersizdir. Bu nedenle, moleküller arasındaki bağlanma neredeyse her zaman elektronik ortamlarında bir değişiklikle sonuçlandığından, teknik, çeşitli bağlanma olaylarının incelenmesi için önemli bir araç olarak hizmet eder. Bununla birlikte, Raman spektroskopisini benzersiz bir teknik yapan şey, yalnızca molekülün polarizasyonundaki bir değişikliğin eşlik ettiği geçişlerin Raman aktif olmasıdır. Raman spektrumlarından türetilen yapısal bilgiler, kompleksin elektronik konfigürasyonu hakkında, bireysel konukçu ve konuk moleküllere kıyasla çok spesifik bilgiler verir.

Çözelti fazlı Raman spektroskopisi genellikle zayıf bir saçılma enine kesiti ile sonuçlanır. Bu nedenle, yüzeyde geliştirilmiş Raman spektroskopisi ve Rezonans Raman spektroskopisi gibi Raman sinyallerini geliştirmek için son gelişmeler sağlanmıştır. Bu tür teknikler, analit-reseptör bağlanma olaylarının nicelleştirilmesi için ek bir amaca hizmet ederek, gerçekte çözümlerde yer aldıkları konukçu-konuk kompleksleşmesi olgusunun daha ayrıntılı bir resmini verir. Yakın tarihli bir buluşta, Flood vd. Raman spektroskopisi[13] ve SERS kullanılarak tetrathiafulvalene (TTF) ve cyclobis'in (paraquat-p-phenylene) bağlanma gücünü belirledi.[14] Bu alandaki önceki çalışma, ilişki kuvvetlerinin nicel ölçümlerinden ziyade, sonuçta ortaya çıkan kompleksin bağlanması ve yapısı hakkında bilgi sağlamayı amaçlamıştır. Araştırmacılar, 1 mM kadar düşük konsantrasyonlara sahip çözeltilerden tespit edilebilir sinyaller alabilmek için Rezonans Raman spektroskopisi kullanmak zorunda kaldılar. Özellikle, Raman bantlarının yoğunluğunu, foto-uyarılmış durumdaki kompleksin geometrisiyle ilişkilendirdiler. Ultraviyole görünür spektroskopiye dayalı titrasyona benzer şekilde, bağlanma sabitini "Raman titrasyonu" ile hesapladılar ve bağlanma eğrilerini 1:1 modellere uydurarak -5.7±0.6 kcal/mol değerini verdiler. Çalışma şimdi çözümlerde yük transfer komplekslerini içeren benzer çalışmalar için bir temel sağlıyor.
Cooperativity[değiştir | kaynağı değiştir]
Bir ligandın birden fazla bağlanma yeri olan bir reseptöre bağlandığı zaman, ligand gelen ligandlar için afinitede bir azalmaya veya artışa neden olarak tanımlanır. Sonraki ligandların bağlanmasında bir artış varsa, pozitif cooperativity olarak kabul edilir. Bağlanmada bir azalma gözlenirse, bu negatif cooperativity'dir. Pozitif ve negatif cooperativity örnekleri sırasıyla hemoglobin ve aspartat reseptörüdür.[15]

Son yıllarda, pozitif veya negatif cooperativity'i ayırt eden matematiksel parametreleri tanımlamak için cooperativity'in termodinamik özellikleri incelenmiştir. Geleneksel Gibbs serbest enerji denklemi şu şekildedir: . Bununla birlikte, bir konukçu-konuk sistemindeki cooperativity'i ölçmek için bağlayıcı enerjinin dikkate alınması gerekir. Sağdaki şematik, A'nın bağlanmasını, B'nin bağlanmasını, A-B'nin pozitif cooperativity bağını ve son olarak A-B'nin negatif cooperativity'li bağını göstermektedir. Bu nedenle, Gibbs serbest enerji denkleminin alternatif bir biçimi şöyle olacaktır:
olmak üzere,
- = A bağlanmasının serbest enerjisi
- = B bağlanmasının serbest enerjisi
- = A ve B bağlı için serbest bağlanma enerjisi
- = Bağlanmanın serbest enerjilerinin toplamı
'nın ve toplamından daha fazla olması durumunda, pozitif olarak cooperativity yaptığı düşünülmektedir. daha azsa, o zaman negatif cooperativity'dir.[16] Konukçu-konuk kimyası, reseptör-lingu ve etkileşimleriyle sınırlı değildir. İyon eşleştirme sistemlerinde de gösterilmiştir. Son yıllarda, bu tür etkileşimler, sentetik organometalik konukçular ve organik konuk moleküller kullanılarak sulu bir ortamda incelenmiştir. Örneğin, bakır içeren bir poli-katyonik reseptör, tetrakarboksilatlar, trikarbokat, aspartat ve asetat gibi moleküllerle koordine edilir. Bu çalışma, entropinin entropinin negatif cooperativity'ne yol açan sistemin bağlanma enerjisini belirlediğini göstermektedir. Entropideki büyük değişiklik, ligand ve reseptörü çevreleyen çözücü moleküllerin yer değiştirmesinden kaynaklanır. Birden fazla asetat reseptöre bağlandığında, çevreye bir tetrakarboksilattan daha fazla su molekülü salar. Bu, sistemin olumsuz cooperativity yaptığını ima eden serbest enerjide bir azalmaya yol açtı.[17] Guanidinyum ve Cu(II) ve polikarboksilat misafirleri kullanan benzer bir çalışmada, pozitif cooperativity'nin büyük ölçüde entalpi tarafından belirlendiği gösterilmiştir.[18] Termodinamik çalışmalara ek olarak, konukçu-konuk kimyasının biyolojik uygulamaları da vardır.
Süperiletkenlik[değiştir | kaynağı değiştir]
Düşük sıcaklıklarda ve yüksek basınçlarda, bizmutun bir konukçu-konuk yapısı sergilediği bulunmuştur. Bu şaşırtıcı bir şekilde güçlü bir bağlantı süper iletkenliğine yol açar.[19]
Biyolojik uygulama[değiştir | kaynağı değiştir]

İlaç dağıtım sistemlerindeki dendrimerler, çeşitli konukçu-konuk etkileşimlerine bir örnektir. Konukçu ve konuk, sırasıyla dendrimer ve ilaç arasındaki etkileşim, hidrofobik veya kovalent olabilir. Konukçu ve konuk arasındaki hidrofobik etkileşim "kapsüllenmiş" olarak kabul edilirken, kovalent etkileşimlerin konjuge olduğu kabul edilir. Tıpta dendrimerlerin kullanımının, ilacın çözünürlüğünü ve biyoyararlanımını artırarak ilaç dağıtımını iyileştirdiği gösterilmiştir. Bir arada, dendrimerler hem hücresel alımı hem de hedefleme yeteneğini artırabilir ve ilaç direncini azaltabilir.[20]
Çeşitli NSAID'lerin çözünürlüğü, PAMAM dendrimerleri içinde kapsüllendiğinde artar.[21] Bu çalışma, NSAID çözünürlüğünün artmasının, PAMAM'daki yüzey amin grupları ile NSAID'lerde bulunan karboksil grupları arasındaki elektrostatik etkileşimlerden kaynaklandığını göstermektedir. Çözünürlükteki artışa katkıda bulunanlar, ilaçlardaki aromatik gruplar ile dendrimerin iç boşlukları arasındaki hidrofobik etkileşimlerdir.[22] Bir ilaç bir dendrimer içinde kapsüllendiğinde, spesifik olmama ve toksisite dahil olmak üzere fiziksel ve fizyolojik özellikleri değişmeden kalır. Bununla birlikte, dendrimer ve ilaç kovalent olarak birbirine bağlandığında, spesifik doku hedeflemesi ve kontrollü salım oranları için kullanılabilir.[23] Dendrimer yüzeyler üzerinde birden fazla ilacın kovalent konjugasyonu bir çözünmezlik sorunu oluşturabilir.[23][24]
Bu prensip aynı zamanda kanser tedavisi uygulaması için de çalışılmaktadır. Çeşitli gruplar, aşağıdakiler gibi kanser önleyici ilaçları kapsülledi: Camptothecin, Methotrexate ve Doxorubicin. Bu araştırmalardan elde edilen sonuçlar, dendrimerlerin suda çözünürlüğünü artırdığını, salım hızını yavaşlattığını ve muhtemelen ilaçların sitotoksisitesini kontrol ettiğini göstermiştir.[20] Cisplatin, yukarıda listelenenlerle aynı farmakolojik sonuçlara yol açan PAMAM dendrimerlerine konjuge edilmiştir, ancak konjugasyon ayrıca intravenöz uygulamada katı tümörlerde sisplatin birikmesine neden olmuştur.[25]
Algılama[değiştir | kaynağı değiştir]
Geleneksel olarak, kimyasal algılamaya, bir bağlayıcı yoluyla bir reseptöre kovalent olarak bağlı bir gösterge içeren bir sistemle yaklaşılmıştır. Analit bağlandığında, gösterge rengi veya floresanları değiştirir. Bu teknik, gösterge-ayırıcı-alıcı (ISR) yaklaşımı olarak adlandırılır.[26] ISR'nin tersine, Gösterge Yer Değiştirme Testi (IDA) bir reseptör, gösterge ve bir analit arasında kovalent olmayan bir etkileşim kullanır. ISR'ye benzer şekilde, IDA da kolorimetrik (C-IDA) ve floresans (F-IDA) göstergeleri kullanır. Bir IDA tahlilinde, bir reseptör, gösterge ile inkübe edilir. Analit karışıma eklendiğinde gösterge ortama salınır. Gösterge serbest bırakıldığında, rengi veya floresanları değiştirir.[27]
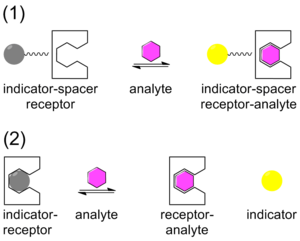
IDA, geleneksel ISR kimyasal algılama yaklaşımına göre çeşitli avantajlar sunar. İlk olarak, göstergenin reseptöre kovalent olarak bağlanmasını gerektirmez. İkincisi, kovalent bağ olmadığı için aynı reseptörle çeşitli göstergeler kullanılabilir. Son olarak, analizin kullanılabileceği ortam çeşitlidir.[28]

C-IDA gibi kimyasal algılama tekniklerinin biyolojik etkileri vardır. Örneğin protamin, herapinin antikoagülan aktivitesine karşı hareket eden, kardiyopulmoner cerrahiden sonra rutin olarak uygulanan bir pıhtılaştırıcıdır. Plazma örneklerindeki protamini ölçmek için kolorimetrik yer değiştirme deneyi kullanılır. Azure A boya bağlı olmadığında mavidir, ancak herapine bağlandığında mor renk gösterir. Azure A ve heparin arasındaki bağlanma zayıf ve tersine çevrilebilir. Bu, protaminin Azure A'nın yerini almasına izin verir. Boya serbest bırakıldığında mor bir renk gösterir. Boyanın yer değiştirme derecesi, plazmadaki protamin miktarı ile orantılıdır.[29]
F-IDA, Kwalczykowski ve meslektaşları tarafından E.coli'deki helikaz aktivitelerini izlemek için kullanılmıştır. Bu çalışmada gösterge olarak tiyazol turuncu kullandılar. Helikaz, ssDNA yapmak için dsDNA'yı çözer. Tiyazol turuncunun floresan yoğunluğu, ssDNA'dan daha büyük bir dsDNA afinitesine sahiptir ve flüoresans yoğunluğu, bağlı olmadığından daha dsDNA'ya bağlandığında artar.[30]
Konformasyonel anahtarlama[değiştir | kaynağı değiştir]
Kristal bir katı, geleneksel olarak, atomik bileşenlerinin hareketlerinin titreşim dengesiyle sınırlı olduğu statik bir varlık olarak görülmüştür. Grafitin elmasa dönüşümünden görüldüğü gibi, fiziksel veya kimyasal basınç altında katıdan katıya dönüşüm gerçekleşebilir. Yakın zamanda, bir kristal düzenlemesinden diğerine dönüşümün işbirliğine dayalı bir şekilde gerçekleştiği öne sürülmüştür.[31][32] Bu çalışmaların çoğu, organik veya metal-organik bir çerçeveyi incelemeye odaklanmıştır.[33][34] Makromoleküler kristalin dönüşüm çalışmalarına ek olarak, organik çözücüler varlığında konformasyonlarını değiştirebilen tek kristal moleküller üzerinde de çalışmalar vardır. Bir organometalik kompleksin, çözücü buharlarına maruz kalıp kalmadığına bağlı olarak çeşitli yönelimlere dönüştüğü gösterilmiştir.[35]
Çevresel uygulamalar[değiştir | kaynağı değiştir]
Tehlikeli maddeleri ortamdan uzaklaştırmak için konukçu-konuk sistemleri kullanılmıştır. Çeşitli kimyasal konukları yakalamak için farklı boyutlarda ve farklı şekillerde yapılabilirler. Uygulama, p-tert-butycalixarene'nin sezyum iyonunu yakalayabilmesidir. Sezyum-137 radyoaktiftir ve onu nükleer atıklardan verimli bir şekilde uzaklaştırma ihtiyacı vardır. Konukçu-konuk kimyası, kanserojen aromatik aminleri ve bunların N-nitroso türevlerini sudan uzaklaştırmak için de kullanılmıştır. Bu atık malzemeler birçok endüstriyel işlemde kullanılır ve pestisitler, ilaçlar ve kozmetikler gibi çeşitli ürünlerde bulunur.[36][37]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Steed, Jonathan W.; Atwood, Jerry L. (2009). Supramolecular Chemistry (2nd. bas.). Wiley. s. 1002. ISBN 978-0-470-51234-0.
- ^ Lodish, H.; Berk, A.; Kaiser, C. (2008). Molecular Cell Biology. ISBN 978-0-7167-7601-7.
- ^ Freeman, Wade A. (1984). "Structures of the p-xylylenediammonium chloride and calcium hydrogensulfate adducts of the cavitand 'cucurbituril', C36H36N24O12". Acta Crystallographica B. 40: 382-387. doi:10.1107/S0108768184002354.
- ^ Valdés, Carlos; Toledo, Leticia M.; Spitz, Urs; Rebek, Julius (1996). Structure and Selectivity of a Small Dimeric Encapsulating Assembly. Chem. Eur. J. 2. ss. 989-991. doi:10.1002/chem.19960020814.
- ^ a b c d e Anslyn, Eric V.; Dougherty, Dennis A. (2005). Modern Physical Organic Chemistry. MacMillan. ISBN 978-1-891389-31-3.
- ^ Piñeiro, Á.; Banquy, X.; Pérez-Casas, S.; Tovar, É.; García, A.; Villa, A.; Amigo, A.; Mark, A. E.; Costas, M. (2007). "On the Characterization of Host–Guest Complexes: Surface Tension, Calorimetry, and Molecular Dynamics of Cyclodextrins with a Non-ionic Surfactant". Journal of Physical Chemistry B. 111 (17): 4383-92. doi:10.1021/jp0688815. PMID 17428087.
- ^ Hu, J; Cheng, Y; Wu, Q; Zhao, L; Xu, T (2009). "Host–Guest Chemistry of Dendrimer-Drug Complexes. 2. Effects of Molecular Properties of Guests and Surface Functionalities of Dendrimers". Journal of Physical Chemistry B. 113 (31): 10650-10659. doi:10.1021/jp9047055.
- ^ Santo, M; Fox, M (1999). "Hydrogen bonding interactions between Starburst dendrimers and several molecules of biological interest". Journal of Physical Organic Chemistry. 12 (4): 293-307. doi:10.1002/(SICI)1099-1395(199904)12:4<293::AID-POC88>3.0.CO;2-Q.
- ^ a b c Sun, S; Zhang, R; Andersson, S; Pan, J; Zou, D; Åkermark, Björn; Sun, Licheng (2007). "Host–Guest Chemistry and Light Driven Molecular Lock of Ru(bpy)3-Viologen with Cucurbit[7-8]urils". Journal of Physical Chemistry B. 111 (47): 13357-13363. doi:10.1021/jp074582j.
- ^ Zhu; Ruan, Wen-Juan; Chen, Jia-Mei; Zhang, Ying-Hui; Zhu, Zhi-Ang (1989). "Spectroscopy, NMR and DFT studies on molecular recognition of crown ether bridged chiral heterotrinuclear salen Zn(II) complex". Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 62 (4–5): 886-895. Bibcode:2005AcSpA..62..886G. doi:10.1016/j.saa.2005.03.021.
- ^ Brandts; Williston, S; Brandts, J; Lin, L (1989). "Rapid measurements of Binding Constants and Heats of binding Using a New Titration Calorimeter". Analytical Biochemistry. 179: 131-137. doi:10.1016/0003-2697(89)90213-3.
- ^ Sikora, C; Turner, R (2005). "Investigation of Ligand Binding to the Multidrug Resistance Protein EmrE by Isothermal Titration Calorimetry". Biophysical Journal. 88 (1): 475-482. Bibcode:2005BpJ....88..475S. doi:10.1529/biophysj.104.049247. PMC 1305024 $2. PMID 15501941.
- ^ Witlicki, Edward H.; Hansen, Stinne W.; Christensen, Martin; Hansen, Thomas S.; Nygaard, Sune D.; Jeppesen, Jan O.; Wong, Eric W.; Jensen, Lasse; Flood, Amar H. (2009). "Determination of Binding Strengths of a Host–Guest Complex Using Resonance Raman Scattering". Journal of Physical Chemistry A. 113 (34): 9450-9457. Bibcode:2009JPCA..113.9450W. doi:10.1021/jp905202x. PMID 19645430.
- ^ Witlicki, Edward H.; Andersen, Sissel S.; Hansen, Stinne W.; Jeppesen, Jan O.; Wong, Eric W.; Jensen, Lasse; Flood, Amar H. (2010). "Turning on Resonant SERRS Using the Chromophore-Plasmon Coupling Created by Host–Guest Complexation at a Plasmonic Nanoarray". Journal of the American Chemical Society. 132 (17): 6099-6107. doi:10.1021/ja910155b. PMID 20387841.
- ^ Koshland, D (1996). "The structural basis of negative cooperativity: receptors and enzymes". Current Opinion in Structural Biology. 6 (6): 757-761. doi:10.1016/S0959-440X(96)80004-2. PMID 8994875.
- ^ Jencks, W. P. (1981). "On the attribution and additivity of binding energies". Proceedings of the National Academy of Sciences, USA. 78 (7): 4046-4050. Bibcode:1981PNAS...78.4046J. doi:10.1073/pnas.78.7.4046. PMC 319722 $2. PMID 16593049.
- ^ Dobrzanska, L; Lloyd, G; Esterhuysen, C; Barbour, L (2003). "Studies into the Thermodynamic Origin of Negative Cooperativity in Ion-Pairing Molecular Recognition". Journal of the American Chemical Society. 125 (36): 10963-10970. doi:10.1021/ja030265o.
- ^ Hughes, A.; Anslyn, E (2007). "A cationic host displaying positive cooperativity in water". Proceedings of the National Academy of Sciences, USA. 104 (16): 6538-6543. Bibcode:2007PNAS..104.6538H. doi:10.1073/pnas.0609144104. PMC 1871821 $2. PMID 17420472.
- ^ Brown, Philip; Semeniuk, Konstantin; Wang, Diandian; Monserrat, Bartomeu; Pickard, Chris J.; Grosche, F. Malte (1 Nisan 2018). "Strong coupling superconductivity in a quasiperiodic host–guest structure". Science Advances (İngilizce). 4 (4): eaao4793. doi:10.1126/sciadv.aao4793. ISSN 2375-2548. PMC 5898833 $2. PMID 29662950. 17 Kasım 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Kasım 2020.
- ^ a b Cheng, Y.; Wang, J.; Rao, T.; He, X.; Xu, T. (2008). "Pharmaceutical applications of dendrimers: promising nanocarriers for drug discovery". Frontiers in Bioscience. 13 (13): 1447-1471. doi:10.2741/2774.
- ^ Cheng, Y.; Xu, T. (2005). "Dendrimers as Potential Drug Carriers. Part I. Solubilization of Non-Steroidal Anti-Inflammatory Drugs in the Presence of Polyamidoamine Dendrimers". European Journal of Medicinal Chemistry. 40 (11): 1188-1192. doi:10.1016/j.ejmech.2005.06.010.
- ^ Cheng, Y.; Xu, T; Fu, R (2005). "Polyamidoamine dendrimers used as solubility enhancers of ketoprofen". European Journal of Medicinal Chemistry. 40 (12): 1390-1393. doi:10.1016/j.ejmech.2005.08.002.
- ^ a b Cheng, Y.; Xu, Z; Ma, M.; Xu, T. (2007). "Dendrimers as drug carriers: Applications in different routes of drug administration". Journal of Pharmaceutical Sciences. 97: 123-143. doi:10.1002/jps.21079.
- ^ D’Emanuele, A; Attwood, D (2005). "Dendrimer–drug interactions". Advanced Drug Delivery Reviews. 57 (15): 2147-2162. doi:10.1016/j.addr.2005.09.012. PMID 16310283.
- ^ Malik, N.; Evagorou, E.; Duncan, R. (1999). "Dendrimer-platinate: a novel approach to cancer chemotherapy". Anti-Cancer Drugs. 10 (8): 767-776. doi:10.1097/00001813-199909000-00010. PMID 10573209.
- ^ de Silva, A.P.; McCaughan, B; McKinney, B.O. F.; Querol, M. (2003). "Newer optical-based molecular devices from older coordination chemistry". Dalton Transactions. 10 (10): 1902-1913. doi:10.1039/b212447p.
- ^ Anslyn, E. (2007). "Supramolecular Analytical Chemistry". Journal of Organic Chemistry. 72 (3): 687-699. doi:10.1021/jo0617971. PMID 17253783.
- ^ Nguyen, B.; Anslyn, E. (2006). "Indicator-displacement assays". Coor. Chem. Rev. 250 (23–24): 3118-3127. doi:10.1016/j.ccr.2006.04.009.
- ^ Yang, V.; Fu, Y.; Teng, C.; Ma, S.; Shanberge, J. (1994). "A method for the quantitation of protamine in plasma" (PDF). Thrombosis Research. 74 (4): 427-434. doi:10.1016/0049-3848(94)90158-9. PMID 7521974.
- ^ Eggleston, A.; Rahim, N.; Kowalczykowski, S; Ma, S.; Shanberge, J. (1996). "A method for the quantitation of protamine in plasma". Nucleic Acids Research. 24 (7): 1179-1186. doi:10.1093/nar/24.7.1179. PMC 145774 $2. PMID 8614617.
- ^ Atwood, J; Barbour, L; Jerga, A; Schottel, L (2002). "Guest Transport in a nonporous Organic Solid via Dynamic van der Waals Cooperativity". Science. 298 (5595): 1000-1002. Bibcode:2002Sci...298.1000A. doi:10.1126/science.1077591. PMID 12411698.
- ^ Kitagawa, S; Uemura, K (2005). "Dynamic porous properties of coordination polymers inspired by hydrogen bonds". Chemical Society Reviews. 34 (2): 109-119. doi:10.1039/b313997m. PMID 15672175.
- ^ Sozzani, P; Bracco, S; Commoti, A; Ferretti, R; Simonutti, R (2005). "Methane and Carbon Dioxide Storage in a Porous van der Waals Crystal". Angewandte Chemie. 44 (12): 1816-1820. doi:10.1002/anie.200461704. PMID 15662674.
- ^ Uemura, K; Kitagawa, S; Fukui, K; Saito, K (2004). "A Contrivance for a Dynamic Porous Framework: Cooperative Guest Adsorption Based on Square Grids Connected by Amide−Amide Hydrogen Bonds". J. Am. Chem. Soc. 126 (12): 3817-3828. doi:10.1021/ja039914m. PMID 15038736.
- ^ Dobrzanska, L; Lloyd, G; Esterhuysen, C; Barbour, L (2006). "Guest-Induced Conformational Switching in a Single Crystal". Angewandte Chemie. 45 (35): 5856-5859. doi:10.1002/anie.200602057. PMID 16871642.
- ^ Eric Hughes; Jason Jordan; Terry Gullion (2001). "Structural Characterization of the [Cs(p-tert-butylcalix[4]arene -H) (MeCN)] Guest–Host System by 13C-133Cs REDOR NMR". Journal of Physical Chemistry B. 105 (25): 5887-5891. doi:10.1021/jp004559x.
- ^ Serkan Erdemir; Mufit Bahadir; Mustafa Yilmaz (2009). "Extraction of Carcinogenic Aromatic Amines from Aqueous Solution Using Calix[n]arene Derivatives as Carriers". Journal of Hazardous Materials. 168 (2–3): 1170-1176. doi:10.1016/j.jhazmat.2009.02.150. PMID 19345489.



![{\displaystyle K_{a}^{\ominus }={\frac {\{HG\}}{\{H\}\{G\}}}={\frac {[HG]}{[H][G]}}\times \Gamma }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9754da7964a0bf1e4808d376020a6e8e25c207f8)
![{\displaystyle [HG]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80fdda7af86666fc9f3342541e225ac292bb9a81)
![{\displaystyle [H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59d2226487b5eb5f8a607d7233b5825b05775db6)
![{\displaystyle [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b230fd410e2cd9ecc472bb1de122c0b523f561c)

![{\displaystyle K_{a}={\frac {[HG]}{[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae235e284e33c2c110956324a712e6c6962507e0)





![{\displaystyle K={\frac {[HG]}{[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0699f3a1a1574661940baea1c8bbfb4a3136447)
![{\displaystyle T_{H}=[H]+K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ef4c10eece3b96f87a168ce59d82e54e4c5d249)
![{\displaystyle T_{G}=[G]+K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1246c000c420a8e140e2ef3450c8ed780b7eea5b)


![{\displaystyle [H]=T_{H}-T_{G}+[G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cab49660f203c07b5f2b895ab2f8c1545cbbd8c)
![{\displaystyle [HG]=K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e88c585a975e89e21c0933648c84b4fdedd50c12)




















![{\displaystyle \beta _{pq}={\frac {[H_{p}G_{q}]}{[H]^{p}[G]^{q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db509ff939d1eb629ba6b10c11abc7b380a95c76)
![{\displaystyle T_{H}=[H]+\sum p\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85683a8e3d63267f6160f59ea79b76f9f87ba74)
![{\displaystyle T_{G}=[G]+\sum q\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/515652e9c3e3cd95a67682abf6e924937de71da8)
![{\displaystyle [H_{p}G_{q}]=\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae16c12c4b85d02e4add18af69d42131945ce0e8)












![{\displaystyle Q={V\Delta H_{0}[H.G]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05741345df5c805bd41d52801bd5df273f77089c)
![{\displaystyle Q={\frac {V\Delta H_{0}K_{a}[H_{0}][G]}{1+K_{a}[G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c72903aa7b75076ad27a613a05847bfcc18e9e)
![{\displaystyle [H_{0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b09a9868564ad3a8fc85cbdf4abab3df406316f8)








