Aktif taşıma
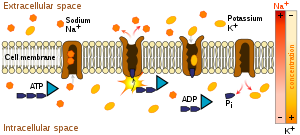
Aktif taşıma, küçük moleküllerin (porlardan geçebilen moleküller), az yoğun ortamdan çok yoğun ortama ATP harcanarak geçişidir. Aktif taşımada, hücre zarı üzerindeki porlardan geçebilecek büyüklükteki moleküller, taşıyıcı protein ve taşıyıcı enzimler yardımıyla taşınır. Taşıma sırasında enerji kullanıldığı için sadece canlı hücrelerde gerçekleşebilir. Hücre içinden hücre dışına, hücre dışından hücre içine olmak üzere her iki yönde de gerçekleşebilir.[1]
Canlılığını devam ettiren bir hücrenin aktif taşıma yapması zorunludur. Aktif taşımanın gerçekleştiği ortamdaki sıcaklık artışı, taşımayı önce hızlandırır. Fakat sıcaklık artışı devam ettikçe taşıma hızı azalır. Bunun nedeni aktif taşımada kullanılan taşıyıcı protein ve enzimlerin yüksek sıcaklıkta denatüre olmasıdır.[2]
İkincil aktif taşıma
[değiştir | kaynağı değiştir]İkincil aktif taşıma Birlikte taşıma veya eşleştirilmiş taşıma olarak da bilinen ikincil aktif taşımada, molekülleri bir zar boyunca taşımak için enerji kullanılır; bununla birlikte, birincil aktif taşımanın aksine, ATP'nin doğrudan bağlanması yoktur. Bunun yerine, iyonların hücre içine/dışına pompalanmasıyla oluşturulan elektrokimyasal potansiyel farkına dayanır.[3] Bir iyonun veya molekülün bir elektrokimyasal gradyanı aşağı doğru hareket etmesine izin vermek, ancak muhtemelen daha konsantre olduğu yerde daha az konsantre olduğu konsantrasyon gradyanına karşı, entropiyi arttırır ve metabolizma için bir enerji kaynağı olarak hizmet edebilir (örneğin, ATP sentazında). Bir hücre zarı boyunca protonların pompalanmasından elde edilen enerji, sıklıkla ikincil aktif taşımada enerji kaynağı olarak kullanılır. İnsanlarda sodyum (Na+), plazma zarı boyunca yaygın olarak birlikte taşınan bir iyondur ve elektrokimyasal gradyanı daha sonra ikinci bir iyonun veya molekülün gradyanına karşı aktif taşınmasına güç vermek için kullanılır.[4] Bakterilerde ve küçük maya hücrelerinde, yaygın olarak birlikte taşınan bir iyon hidrojendir.[4] Hidrojen pompaları ayrıca, hücrenin mitokondrisinde meydana gelen hücresel solunumun önemli bir işlevi olan elektron taşıma zinciri gibi hücreler içindeki işlemleri yürütmek için elektrokimyasal bir gradyan oluşturmak için kullanılır.[5]
Ağustos 1960'ta, Prag'da, Robert K. Crane ilk kez bağırsak glikoz emiliminin mekanizması olarak sodyum-glikoz birlikte taşınmasını keşfini sundu.[21] Crane'in cotransport keşfi, biyolojide akış eşleşmesinin ilk önerisiydi.[6] Crane's discovery of cotransport was the first ever proposal of flux coupling in biology.[7][8]
Yardımcı taşıyıcılar, maddelerin aynı yönde mi yoksa zıt yönlerde mi hareket ettiğine bağlı olarak simporterler ve antiporterler olarak sınıflandırılabilir.
Ayrıca bakınız
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- ^ "Arşivlenmiş kopya". 14 Eylül 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2016.
- ^ "Arşivlenmiş kopya". 1 Eylül 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2016.
- ^ Nosek, Thomas M. "Section 7/7ch05/7ch05p12". Essentials of Human Physiology. 24 Mart 2016 tarihinde kaynağından arşivlendi.
- ^ a b Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002. Carrier Proteins and Active Membrane Transport 6 Mayıs 2021 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. New York: Garland Science; 2002. Electron-Transport Chains and Their Proton Pumps 1 Mayıs 2021 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ Crane, Robert K.; Miller, D.; Bihler, I. (1961). "The restrictions on possible mechanisms of intestinal transport of sugars". Kleinzeller, A.; Kotyk, A. (Ed.). Membrane Transport and Metabolism. Proceedings of a Symposium held in Prague, August 22–27, 1960. Prag: Czech Academy of Sciences. ss. 439-449.
- ^ Wright EM, Turk E (February 2004). "The sodium/glucose cotransport family SLC5". Pflügers Arch. 447 (5). ss. 510-8. doi:10.1007/s00424-003-1063-6. PMID 12748858.
Crane in 1961 was the first to formulate the cotransport concept to explain active transport [7]. Specifically, he proposed that the accumulation of glucose in the intestinal epithelium across the brush border membrane was coupled to downhill Na+ transport cross the brush border. This hypothesis was rapidly tested, refined and extended [to] encompass the active transport of a diverse range of molecules and ions into virtually every cell type.
- ^ Boyd CA (March 2008). "Facts, fantasies and fun in epithelial physiology". Exp. Physiol. 93 (3). ss. 303-14 (304). doi:10.1113/expphysiol.2007.037523
 . PMID 18192340.
. PMID 18192340. the insight from this time that remains in all current text books is the notion of Robert Crane published originally as an appendix to a symposium paper published in 1960 (Crane et al. 1960). The key point here was 'flux coupling', the cotransport of sodium and glucose in the apical membrane of the small intestinal epithelial cell. Half a century later this idea has turned into one of the most studied of all transporter proteins (SGLT1), the sodium–glucose cotransporter.
| Biyoloji ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. |
