Hemoglobin
Bu madde hiçbir kaynak içermemektedir. (Eylül 2012) (Bu şablonun nasıl ve ne zaman kaldırılması gerektiğini öğrenin) |
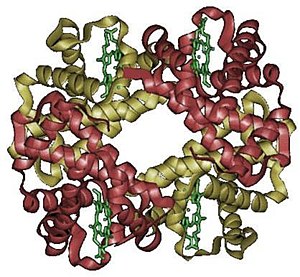
Hemoglobin, solunum organından dokulara oksijen, dokulardan solunum organına ise karbondioksit ve proton taşıyan protein. Eritrositlerin içerisinde bulunur. Oksijeni +2 değerlikli demir içeren hem molekülleri ile bağlar. Başlıca sentez yeri eritrosit üretimi sırasında kemik iliğidir. Yaş, cinsiyet ve türe göre küçük farklılıklarla da olsa kanda belli bir değerin altında bulunmasına Anemi, yüksek miktarda bulunmasına ise polisitemi denir. Hemoglobinin prostetik grubu hem, proteiniyse globulindir.

Kimyasal özellikleri
[değiştir | kaynağı değiştir]Hemoglobin, bir oligometaloproteindir. Yapısında 4 hem halkası olduğundan (4 tane) demir atomu bulunur. Bu demir miktarı hemoglobinin %0,33'üne karşılık gelir ama yine de bu oran az olsa da fark edebilir. Yapısında bazik aminoasitler -özellikle histidin- bulunur. Hemoglobin; α (alfa), β (beta), ɣ (gama) ve δ (delta) olmak üzere birbirine kovalent olmayan bağlarla bir arada tutunmuş 4 polipeptid zinciri içerir. Yetişkin bir insanın hemoglobini, hemoglobin A olarak adlandırılır ve %97,5 (α2β2), %2,5 (α2δ2)'den ibaret bir polipeptid zinciridir. α zinciri 141, β, ɣ ve δ zincirleri 146 aminoasidden oluşmuştur. Fetustaki hemoglobin olan hemoglobin F ise α2ɣ2 zincirlerinden oluşur. α ve β zincirlerindeki hatalı bir sentez çeşitli hastalıklara neden olur. Örneğin; β zincirinin altıncı durumundaki glutamik asit yerine valinin geçmesiyle hücreler orak şeklinde kıvrılır ve oksijeni yeterli miktarda bağlayamaz. Böylece hemoglobinin dalakta çok hızlı olarak yıkılmasıyla Anemizma oluşur. Fetus hemoglobinindeki ɣ zincirinin doğumdan sonra β zinciri şekline dönüşmesi gerekir. ɣ zincirinin β zinciri şekline dönüşememesi Akdeniz anemisi (β-talasemi) meydana getirir.
İşlev mekanizması ve çeşitleri
[değiştir | kaynağı değiştir]Hemoglobin O2 taşınmasında görevlidir ve vücudun en önemli tamponudur. Hemoglobindeki Fe2+'in koordinasyon sayısı 6 olup bu koordinasyon yerlerinden dördüne pirol halkasının azotu, beşincisine globin molekülünün histidininin imidozol grubunun azotu, altıncısına ise su molekülü bağlanarak hemoglobin teşekkül eder. Suyun yerine O2 geçerse bu hemoglobine oksihemoglobin adı verilir. Hemoglobin molekülünde dört hem grubu bulunduğuna göre oksijen için dört birleşme yeri vardır. Hemoglobinin oksijen yerine CO2 ile birleşmesine karbaminohemoglobin (karbhemoglobin) adı verilir. Dayanıksız bir bileşiktir. Hemoglobinin altıncı koordinasyon yerine CO gelirse buna da karboksihemoglobin adı verilir. Hemoglobinin CO'e ilgisi O2'den daha fazladır. Hemoglobindeki demirin Fe3+ haline yükseltgenmesiyle elde edilen maddeye hemin adı verilir ve bu hemoglobin çeşidine de methemoglobin adı verilir. Hemoglobindeki altıncı koordinasyon yerine CN- bağlanırsa buna da siyanohemoglobin adı verilir ve bu tür zehirlenme gören kimselere sodyum tiyosülfat acil olarak verilmelidir.
Sentezi
[değiştir | kaynağı değiştir]
Vücutta her gün yıkıma uğrayan hemoglobin miktarını yerine koymak üzere yaklaşık 5-6 gram kadar hemoglobin sentez edilir. Hemoglobin sentezi hücrenin mitokondri ve sitoplazmasında olur. Hemoglobin sentezi için protoporfirin IX, Fe2+ ve globuline ihtiyaç vardır. Pantotenik asit, piridoksal fosfat, B12 vitamini ve intrinsik faktör bu sentez için gereklidir. Proeritroblastlar hemoglobin sentezinin önemli kısmını gerçekleştirirler; retikülositte hemoglobin sentez etme oldukça düşmüştür. Olgun Eritrositler, hemoglobin sentez edemezler. Hemoglobin sentezi için protoporfirin IX endojen olarak vücutta sentez edilir. Eğer organizmaya protoporfirin şırınga edilirse veya besinlerle eksojen olarak verilirse organizma bundan yararlanamaz. Dışkı ve idrarla dışarı atar. Hemoglobin retiküloendeteryal sistemin ribozomlarında sentez edilir.
Yıkımı
[değiştir | kaynağı değiştir]Hemoglobin Eritrositlerin kemik iliğinden dolaşıma geçişinin 120-130. günü retiküloendeteryal sistem hücrelerini ihtiva eden dalak, karaciğer ve kemik iliğinde yıkılıma uğrar. Hemoglobinin iki yolla yıkıma uğradığı düşünülmektedir.
Fetus hemoglobini
[değiştir | kaynağı değiştir]Fetus hemoglobini erişkin insan hemoglobininden farklıdır. Fetusta hemoglobin sentezi proeritroblast, normoblast ve retikülositlerde olur. 12. haftadan önceki hemoglobin gower tip 1 ve gower tip 2 ve Hb Portland'dır. 2. ve 3. trimestır boyunca fetuste ana hemoglobinolarak HbF bulunurur. HbF iki alfa ve iki gama alt zincirinden oluşur. HbF'in oksijene aflinitesi erişkin tip hemoglobinden yani HbA'dan %50 daha fazladır.
