İkili bağ: Revizyonlar arasındaki fark
"Double bond" sayfasının çevrilmesiyle oluşturuldu. Etiketler: İçerik Çevirmeni İçerik Çevirmeni 2 |
(Fark yok)
|
Sayfanın 18.56, 5 Nisan 2024 tarihindeki hâli
Kimyada ikili bağ, iki atom arasında, tekli bağdaki iki elektrona karşılık dört bağ elektronu içeren kovalent bir bağdır. İkili bağlar en yaygın olarak iki karbon atomu arasında, örneğin alkenlerde meydana gelir. Birçok çift bağ iki farklı element arasında bulunur: örneğin, bir karbon atomu ile bir oksijen atomu arasındaki bir karbonil grubunda. Diğer yaygın çift bağlar azo bileşiklerinde (N=N), iminlerde (C=N) ve sülfoksitlerde (S=O) bulunur. Bir iskelet formülünde, bir çift bağ, bağlı iki atom arasında iki paralel çizgi (=) olarak çizilir; tipografik olarak bunun için eşittir işareti kullanılır.[1][2] İkili bağlar kimyasal gösterimde Rus kimyager Alexander Butlerov tarafından tanıtılmıştır.[kaynak belirtilmeli]
Karbon içeren ikili bağlar, tekli bağlardan daha güçlü ve daha kısadır. Bağ sırası ikidir. İkili bağlar elektron bakımından da zengindir, bu da onları güçlü bir elektron alıcısının varlığında potansiyel olarak daha reaktif hale getirir (halojenlerin katılma reaksiyonlarında olduğu gibi).
- Çift bağ içeren kimyasal bileşikler
-
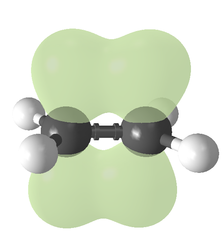
Etilen Karbon-karbon çift bağı
-
Aseton Karbon-oksijen çift bağı
-
Dimetil sülfoksit Sülfür-oksijen çift bağı
-
Diazen Azot-azot çift bağı
Alkenlerde çift bağlar

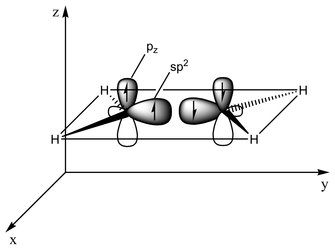
Bağlanma türü orbital hibridizasyonu açısından açıklanabilir. Etilende her karbon atomunun üç sp2 orbitali ve bir p-orbitali vardır. Üç sp2 orbitali ~120° açılı bir düzlemde yer alır. p-orbitali bu düzleme diktir. Karbon atomları birbirine yaklaştığında, sp2 orbitallerinden ikisi bir sigma bağı oluşturmak üzere üst üste biner. Aynı zamanda, iki p-orbitali yaklaşır (yine aynı düzlemde) ve birlikte bir pi bağı oluştururlar. Maksimum örtüşme için p-orbitallerinin paralel kalması gerekir ve bu nedenle merkezi bağ etrafında dönme mümkün değildir. Bu özellik cis-trans izomerizmine yol açar. Çift bağlar tek bağlardan daha kısadır çünkü p-orbital örtüşmesi maksimize edilmiştir.
-
2 sp2 orbitali (toplam 3 orbital) bir sp2-sp2 sigma bağı oluşturmak üzere yaklaşır
-
İki p-orbitali sigma düzlemine paralel bir düzlemde bir pi-bağı oluşturmak üzere üst üste biner
133 pm ile etilen C=C bağ uzunluğu, 154 pm ile etandaki C-C uzunluğundan daha kısadır. Çift bağ da daha güçlüdür, 368 kJ mol-1'e karşılık 636 kJ mol-1, ancak pi-bağı daha az etkili pi-örtüşmesi nedeniyle sigma bağından daha zayıf olduğundan iki kat daha fazla değildir.
Alternatif bir gösterimde, çift bağ, bükülmüş bir bağda olduğu gibi üst üste binen iki sp3 orbitalinden kaynaklanır.[3]
Varyasyonlar
Alternatif çift bağ ve tek bağ içeren moleküllerde, bir zincirdeki birden fazla atom üzerinde p-orbital örtüşmesi olabilir ve bu da konjuge bir sistemin ortaya çıkmasına neden olur. Konjugasyon dienler ve enonlar gibi sistemlerde bulunabilir. Halkalı moleküllerde konjugasyon aromatikliğe yol açabilir. Kümülenlerde iki çift bağ bitişiktir.
Çift bağlar 2. periyot elementleri karbon, azot ve oksijen için yaygındır ve daha yüksek periyotlardaki elementlerde daha az yaygındır. Metaller de bir metal ligand çoklu bağında çoklu bağ yapabilir.
Grup 14 alken homologları
Çift bağlı bileşikler, alken homologları, R2E=ER2 artık tüm ağır grup 14 elementleri için bilinmektedir. Alkenlerden farklı olarak bu bileşikler düzlemsel değil, bükülmüş ve/veya trans bükülmüş yapıları benimserler. Bu etkiler daha ağır elementler için daha belirgin hale gelir. (Me3Si)2CHSn=SnCH(SiMe3)2 distanneni, tek bir bağdan biraz daha kısa bir kalay-kalay bağ uzunluğuna, her bir kalay atomunda piramidal koordinasyona sahip trans bükülmüş bir yapıya sahiptir ve çözeltide kolayca ayrışarak (Me3Si)2CHSn: (stannanedil, bir karben analoğu) oluşturur. Bağlanma, her bir kalay atomu üzerindeki yalnız çiftin diğerindeki boş p orbitali ile örtüştüğü iki zayıf donör alıcı bağından oluşur.[4][5] Bunun aksine, disilenlerde her bir silikon atomu düzlemsel koordinasyona sahiptir ancak sübstitüentler bükülmüştür, böylece molekül bir bütün olarak düzlemsel değildir. Diplumbenlerde Pb=Pb bağ uzunluğu, karşılık gelen birçok tek bağdan daha uzun olabilir.[5] Plumbenler ve stannenler genellikle çözeltide karşılık gelen tek bağların sadece bir kısmı olan bağ entalpilerine sahip monomerlere ayrışır. Bazı çift bağlar plumbenler ve stannenler hidrojen bağlarına benzer güçtedir.[4] Carter-Goddard-Malrieu-Trinquier modeli, bağın doğasını tahmin etmek için kullanılabilir.[4]
Atomlar arasındaki çift bağ türleri
| C | Ö | N | S | Si | Ge | sn | kurşun | |
|---|---|---|---|---|---|---|---|---|
| C | alken | karbonil grubu | imin | tiyoketon, tial | ||||
| O | dioksijen | nitrozo bileşiği | sülfoksit, sülfon, sülfinik asit, sülfonik asit | |||||
| N | azo bileşiği | |||||||
| S | kükürt disülfür | |||||||
| Si | alkidensilanlar | sessizler | ||||||
| Ge | germenler | |||||||
| Sn | stannenes | |||||||
| Pb | tesisatçılar |
Kaynakça
- ^ March, Jerry, 1929-1997. (1985). Advanced organic chemistry : reactions, mechanisms, and structure (3rd bas.). New York: Wiley. ISBN 0-471-88841-9. OCLC 10998226. 2019-12-10 tarihinde kaynağından arşivlendi. Erişim tarihi: 2020-12-12.
- ^ McMurry, John. Organic chemistry (Ninth bas.). Boston, MA, USA. ISBN 978-1-305-08048-5. OCLC 907259297. 2024-04-04 tarihinde kaynağından arşivlendi. Erişim tarihi: 2020-12-12.
- ^ Carey, Francis A., 1937- (2007). Advanced organic chemistry. Sundberg, Richard J., 1938- (5th bas.). New York: Springer. ISBN 978-0-387-44897-8. OCLC 154040953. 2024-04-04 tarihinde kaynağından arşivlendi. Erişim tarihi: 2020-12-12.
- ^ a b c Power, Philip P. (1999). "π-Bonding and the Lone Pair Effect in Multiple Bonds between Heavier Main Group Elements". Chemical Reviews. 99 (12): 3463–3504. doi:10.1021/cr9408989. PMID 11849028.
- ^ a b Wang, Yuzhong; Robinson, Gregory H. (2009). "Unique homonuclear multiple bonding in main group compounds". Chemical Communications. Royal Society of Chemistry (35): 5201–5213. doi:10.1039/B908048A. PMID 19707626.
- Pyykkö, Pekka; Riedel, Sebastian; Patzschke, Michael (2005). "Triple-Bond Covalent Radii". Chemistry: A European Journal. 11 (12): 3511–20. doi:10.1002/chem.200401299. PMID 15832398.