Difüz gliom: Revizyonlar arasındaki fark
DrSorrowMD (mesaj | katkılar) Sayfa yeni oluşturuldu |
(Fark yok)
|
Sayfanın 13.27, 13 Nisan 2020 tarihindeki hâli
Diffüz gliomlar Dünya sağlık örgütünün en son 2016 yılında tanımladığı, bir çok farklı alt tipe sahip glial tümörün genel ismidir.[1]Beynin kendi dokusu olan glial tümörlerden kaynaklanan tümör alt tiplerinden biridir. Daha önceki glial tümör sınıflandırılması sadece histopatolojik incelemeye göre yapılırken son sınıflamada moleküler ve genetik incelemeler sınıflamaya dahil edilmiştir. Artık hem astrositik ehm de oligodendroglial tümörler bu sınıflamaya dahil edilmiştir. Bunun nedeni büyüme paternlerinin benzerlik göstermesiyle birlikte benzer genetik mutasyonlar göstermelerinden kaynaklanmaktadır. Bu sınıftaki tümörler hem fenotipik hem de genetik özelliklerine göre sınıflandırılmıştır. Hastalığın seyrinin belirlenmesi, genel veya hedefe yönelik tedavilerin belirnmesi açısından bu sınıflamanın önermi çok fazladır.
Son sınıflamaya göre Difüz gliomlar, derece II ve III astrositik tümörler, derece II ve III oligodendroglial tümörler, derece IV glioblastomlar ve çocukluk çağı difüz gliomlardan oluşur.
Sınıflandırma
| Diffüz astrosistik ve oligondendroglial tümörler | Diffüz astrositom, ''IDH-mutant''
|
|
| Gemistositik astrositom, ''IDH-mutant'' | ||
| Diffüz astrositom, ''IDH- wild tip'' | ||
| Diffüz astrositom, ''NOS'' | ||
| Anaplastik astrositom | IDH-mutant | |
| IDH-wilt tip | ||
| NOS | ||
| Glioblastom, ''IDH wild-tip'' | Dev hücreli glioblastom | |
| Gliosarkom | ||
| Epiteloid glioblastom | ||
| Glioblastom | IDH mutant | |
| NOS | ||
| Diffüz Orta Hat Gliomu (midline glioma) | H3 K27M-mutant | |
| Oligodendroglioma | IDH-mutant ve 1p-19q co-deletion | |
| Oligodendrogliom | NOS | |
| Anaplastik oligodendrogliom | IDH-mutant ve 1p/19q co-deletion | |
| Anaplastik oligodendrogliom | NOS | |
| Oligoastrositom | NOS | |
| Anaplastik oligoastrositom | NOS |
Difüz astrositomlar ve Anaplastik astrositomlar
WHO derece II astrositomlar ve WHO derece III anaplastik astrositomlar ayrı ayrı IDH-mutant, IDH-wild tip (vahşi tip) ve NOS kategorilerine ayrıldı. Eğer IDH testi yapılabiliyorsa derece II ve derece III tümörler çoğunlukla IDH-mutant'tır. Eğer immünohistokimyasal olarak R132H IDH1 codon 132 ve IDH2 codon 172 gen proteinleri negatif ise veya IDH1 codon 132 ve IDH2 codon 172 genlerinden herhangi biri negatif ise mevcut lezyon IDH-wild (vahşi) tip olarak sınıflandırılır. Akılda tutulmalıdır ki IDH-wild tip diffüz astrositom nadir konulardan tanılardan biridir. Difüz astrositomlar içerisinde IDH mutant alt tiplerin tedaviye daha iyi yanıt verdiği ve prognozun daha iyi olduğu görülmektedir. 2016 yılında yapılan son güncellemede önceki sınıflamada olan protoplazmik astrositom ve fibriler astrositom sınıflandırmadan çıkarılmıştır.
Gliomatosis cerebri son sınıflandırmadan çıkarılmıştır. Bunun nedeni aslında bu durumun ister IDH mutant ister IDH-wild tip olsun tüm alt sınıflarda gözlenebilen bir büyüme paterni olmasından kaynaklanmaktadır.[3][4] gliomatosis serebri terimi bir tümör sınıflandırmasından ziyade artık tüm tümör tipleri için tümörün üç ve daha fazla loba yayılması anlamında kullanılmaktadır.
Glioblastom
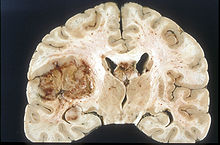

Glioblastomlar derece IV tümörler olarak tanımlanır. Daha önceki sınıflandırmada sadece histopatolojik değerlendirme ile sınıflandırılırken, son sınıflamada IDH mutasyonunun varlığı gibi moleküler farklar gösterilmiştir. Bu farklılıklar Glioblastomun kendi alt tiplerinde prognozun belirlenmesinde oldukça büyük öneme sahiptir. Glioblastomlar WHO 2016 sınıflandırmasında iki ana başlık altında değerlendirilmektedir. Birincisi en sık 55 yaş üstünde görülen, de-novo glioblastom olarak da bilinen, vakaların %90'ını oluşturan IDH-wild (vahşi) tip glioblastomdur.[5] İkinicisi ise vakaların kalan %10'unu oluşturan, daha önceden düşük dereceli difüz gliom olarak bilinen ve daha genç yaşlarda ortaya çıkan IDH-mutant alt tipidir.[5] Eğer tam IDH testi yapılamıyorsa glioblastom, NOS olarak sınıflandırılır.
İlkel nöronal komponenti olan Glioblastom (Glioblastoma with primitive neuronal component sınıflandırmaya dahil edilmiştir. Bu tanımlama daha önce PNET benzeri içeriğe sahip glioblastom (Glioblastoma with PNET-like component) olarak bilinmekteydi. Bu tanımlama diffüz astrositomlar hatta nadir olarak oligodendrogliomlar ile karışabilmekteydi. Bu sınıflamanın önemi, bu alt tipteki tümörlerde Beyin omurilik sıvısı yoluyla omuriliğe yayılım görülebileceğinden dolayı takiplerde omuriliğin de takip edilmesi önerilir.
Oligodendrogliom
Oligodenrogliomlar WHO 2016[1] sınıflamasına göre derece II veya derece III tümörler olarak sınıflandırılırlar. Derece II olan oligodendrogliom ve derece III olan anaplastik oligodendrogliom ayrımı, IDH mutasyonu ile birlikte 1p/19q genlerinin ikisinin birden delesyon varlıklarına göre yapılır. IDH-mutant sınıflaması için IDH1 codon 132 ve IDH2 codon 172 genlerinin her ikisinde de mutasyon olmalıdır. Eğer genetik test yapılamıyorsa veya anlamlı sonuç alınamıyorsa Oligodendrogliom, NOS olarak isimlendirilmelidir.
Oligoastrositom
Oligoastrositom 2016 WHO sınıflaması oldukça problemlidir.[1] Bunun nedeni histolojik özellik olarak neredeyse tüm astrositik ve oligodendroglial varlık gösteren tümörler genetik testler kullanıldığında astrositom veya oligodendrogliom olarak değerlendirilebilirler.[6][7] Derece II oligoastrositom ve derecce III anaplastik oligoastrositom tanısı NOS tanımalamasına bağlıdır ve ancak uygun tanısal moleküler testlerin negatif olduğu durumlarda tanı alabilir. Literatürde oligodendrogliom ve astrositom komponentinin her ikisinin fenotipik ve genetik özelliklerinin birlikte bulunduğu gerçek oligoastrositomlar nadir olarak bulunur.[8]
Çocukluk çağı difüz gliomları
Geçmişte çocukluk çağı gliomlar, davranışsal farklarına rağmen erişkin tip gliomlar gibi sınıflandırılırdı. Altta yatan genetik farklılıklardan dolayı çocukluk çağı difüz gliomları erişkin tiplerinden ayrılırlar.[9][10][11] Sınıflandırılmış gruplardan biri çocukluk çağında (nadir olarak erişkinde de izlenebilir) bir Histon geni olan H3 H3F3A'da K27M mutasyonu izlenir. Bu yapıya sahip tümörler yaygın büyüme paterni, orta hat yerleşimi (talamus, beyin sapı, omurilik) gibi özellikler gösterirler.[12][13] Daha önce Difüz intrinsik pontin gliom (DIPG) olarak tanımlanan bu tümör artık Difüz Orta Hat gliomu, H3 K27M-mutant olarak isimlendirilmektedir.
Diğer astrositomlar
2016 WHO sınıflamasında[1] daha önce naplastik özellik gösteren Pleomorfik ksantoastrositom olarak bilinen tümör artık Anaplastik pleomorfik ksantoastrositom, WHO grade III olarak sınıflandırılmaktadır. Pleomorfik ksantorastrositomu anaplastik olarak sınıflandırmak için ışık mikroskopunda 10 kat büyütmede sahada beş ve daha fazla mitoz izlenmesi gereklidir. Nekroz izlenebilir ama mitozun düşük olduğu durumlarda nekrız varlığının anlamı tartışmalıdır.[14] Anaplatik alt tipte sağ kalım derece II tümöre göre kısadır.
pilomiksoid astrositom derecelendirilmesi de 2016 WHO sınıflandırmasında değişmiştir. daha önce WHO derece II olarak sınıflandırılmış olan bu tümör, bir varyantı olan pilositik astrositomlardan farklı olarak, özellikle erişkinlerde daha agresif seyir göstermektedir. Bu nedenle pilomiksoid astrositom sınıflandırılmasının direk olarak derece II olması konusu halen tartışmalıdır.
Ependimomlar
Daha önceki ependimomlarda ki sınıflandırma klinik kullanımda zorluklara sebep olduğu gibi prognozun belirlenmesinde ve tedavi algoritmalarının oluşturulmasında faydası olmadığı biliniyordu.[15] Beklenti daha ileri çalışmalarla genetik olarak ependimomların daha fazla sınıflandırılması yönünde. Son sınıflandırmada kabul edilen tek genetik alt tip Ependimom, RELA fusion-pozitiftir. [16][17] Bu tümör tipi çocukluk çağı supratentorial tümörlerin büyük bir çoğunluğunu oluşturmaktadır. L1CAM proteinin ekspresyonundaki artışbu tümör için uygun bir immuno-histokimyasal tetkik olabilir.[16] Daha önce mevcut olan ve standart ependimomlar ile karışan selüler ependimomlar sınıflandırmadan çıkarılmıştır.
Nöronal ve nöronal-glial tümörler
Yeni tanımlanmış Difüz leptomeningeal glionöronal tümör daha önce literatürde farklı benzer isimli tümörlerle anılmış olsa da en sık Çocukluk çağının oligodendroglial benzeri leptomeningeal tümörü olarak var olmuştur.[18] Bu tümör daha çok omurilikte olmak üzere parankimal komponenti olmayan difüz leptomeningeal tutulum gösterir. Daha çok çocuk ve adelosanlarda görülür. Bu tümör grubu IDH mutasyonu göstermez. Prognoz değişkenlik gösterir. Yavaş büyüyen bir tümör olmasına rağmen hidrosefaliye bağlı komplikasyonlar izlenebilir.
Ganglion hücreli tümör ile benzerlik gösteren, multinodüler ve vakuollu yapıya sahip yeni bir alt tip tanımlanmıştır. Serebrumun multinodüler ve vakuollü tümörü olarak sınıflandırılmıştır.[19] Düşük dereceli tümörlerdir, glial ve nöronal farklılaşmalar gösterebilirler.
Medulloblastom


Medulloblastomlar histolojik ve genetik olmak üzere iki şekilde sınıflandırılırlar. Histolojik olarak: desmoplastik/nodüler, nodüler yayılım, dev hücreli, anaplastik sınıflandırılır. Genetik (moleküler) olarak ise: WNT-aktif, SHH-aktif ve numerik olarak Grup 3 ve Grup 4.[20] Bu histolojik ve genetik alt tipler dramatik olarak sağ kalım farklılıkları gösterirler.
Medulloblastom sınıflandırılması
| Genetik profil | Histoloji | Prognoz |
|---|---|---|
| Medulloblastom, WNT-akrif | Klasik
Büyük hücreler / anaplatik (nadir) |
Düşük riskli tümör, tüm WNT aktif tümörlerde aynı klasik morfolojik
yapı bulunmaktadır. |
| Medulloblastom, SHH-aktif,
TP53-mutant |
Klasik
Büyük hücreler/ anaplastik Desmoplastik/nodüler (çok nadir) |
Nadir görülen yüksek riskli tümör
En sık 7-17 yaş arasında izlenir |
| Medulloblastom, SHH-aktif,
TP53-wild tip |
Klasik
Büyük hücre/anaplastik Desmoplastik/nodüler Artmış nodülarite |
Standart riskli tümör
İnfantlarda düşük riskli tümör |
| Medulloblastom, non-WNT, non-SHH
Grup 3 |
Klasik
Büyük hücre/anaplastik |
Standart risk
Yüksek riskli tümör |
| Medulloblastom, non-WNT, non-SHH
Grup 4 |
Klasik
Büyük hücre /anaplastik (nadir) |
Standart risk
Bilinmeyen klinikopatolojik farklılık |
Diğer embriyonal tümörler
Medulloblastom dışındaki embriyonel tümörlerden Primitif nöroektodermal Tümör (PNET) tanımı kaldırılmıştır.[1]. Yeni sınıflama 19. kromozomun (19q13.42) C19MC bölgesinin amplifikasyonuna göre yapılmıştır. Daha önceden ETANTR, ependimoblastom, medulloepitelyoma şeklinde isimlendirilen tümörler artık C19MC-amplifiye tümörler olarak sınıflandırılmaktadır.[9]
Atipik teratoid/rabdoid tümörler (AT/RT) artık INI1 ve daha nadir olarak BRG1 gen mutasyonlarına göre sınıflandırılmakta.[21][22][23][24] Bu genlerdeki farklılıklar karşışığı olan proteinlerin immünohistokimyasal olarak ölçülen değişiklikleri üzerinden değerlendirilmektedir. Eğer bir tümör histolojik olarak AT/RT gibi görünüp, genetik değişiklikler tespit edilemez ise merkezi sinir sisteminin rabdoid özzellik gösteren embriyonel tümörü (CNS embriyonal tumor with rhabdoid features olarak isimlendirilir. Sonuç olarak AT/RT tanısı konabilmesi için genetik mutasyonun gösterilmesi şarttır.
Sinir kılıfı tümörleri
Sinir kılıfı tümörleri sınıflandırılması 2007 sınıflandırılması ile ufak farklar dışında benzerlik gösterir. Melanositik schwannom artık klasik schwannomlardan tamamen ayrı bir sınıf olarak değerlendirilmektedir. Hibrit sinir kılıfı tümörleride 2016 sınıflandırmasına dahil edilmiştir. malin periferik sinir kılıfı tümörlerine (MPNST) iki yeni alt tip eklenmiştir: ""Epiteloid MPNST ve perinöral farklılaşma gösteren MPNST.
Referanslar
- ^ a b c d e Louis, Louis (1 Haziran 2016). "The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary". Acta Neuropathologica (İngilizce). 131 (6). ss. 803–820. doi:10.1007/s00401-016-1545-1. ISSN 1432-0533.
- ^ Kaynak hatası: Geçersiz
<ref>etiketi;who2106isimli refler için metin sağlanmadı (Bkz: Kaynak gösterme) - ^ Broniscer, Broniscer (7 Ocak 2016). "Gliomatosis cerebri in children shares molecular characteristics with other pediatric gliomas". Acta Neuropathologica. 131 (2). ss. 299–307. doi:10.1007/s00401-015-1532-y.
- ^ Herrlinger, Herrlinger (22 Ekim 2015). "Gliomatosis cerebri: no evidence for a separate brain tumor entity". Acta Neuropathologica. 131 (2). ss. 309–319. doi:10.1007/s00401-015-1495-z.
- ^ a b Ohgaki, Ohgaki (3 Aralık 2012). "The Definition of Primary and Secondary Glioblastoma". Clinical Cancer Research. 19 (4). ss. 764–772. doi:10.1158/1078-0432.CCR-12-3002.
- ^ Sahm, Sahm (21 Ağustos 2014). "Farewell to oligoastrocytoma: in situ molecular genetics favor classification as either oligodendroglioma or astrocytoma". Acta Neuropathologica. 128 (4). ss. 551–559. doi:10.1007/s00401-014-1326-7.
- ^ Wiestler, Wiestler (10 Temmuz 2014). "Integrated DNA methylation and copy-number profiling identify three clinically and biologically relevant groups of anaplastic glioma". Acta Neuropathologica. 128 (4). ss. 561–571. doi:10.1007/s00401-014-1315-x.
- ^ Huse, Huse (31 Ekim 2014). "Mixed glioma with molecular features of composite oligodendroglioma and astrocytoma: a true "oligoastrocytoma"?". Acta Neuropathologica. 129 (1). ss. 151–153. doi:10.1007/s00401-014-1359-y.
- ^ a b Korshunov, Korshunov (10 Mart 2015). "Integrated analysis of pediatric glioblastoma reveals a subset of biologically favorable tumors with associated molecular prognostic markers". Acta Neuropathologica. 129 (5). ss. 669–678. doi:10.1007/s00401-015-1405-4. Kaynak hatası: Geçersiz
<ref>etiketi: ":24" adı farklı içerikte birden fazla tanımlanmış (Bkz: Kaynak gösterme) - ^ Ramkissoon, Ramkissoon (30 Nisan 2013). "Genomic analysis of diffuse pediatric low-grade gliomas identifies recurrent oncogenic truncating rearrangements in the transcription factor MYBL1". Proceedings of the National Academy of Sciences. 110 (20). ss. 8188–8193. doi:10.1073/pnas.1300252110.
- ^ "Whole-genome sequencing identifies genetic alterations in pediatric low-grade gliomas". Nature Genetics. 45 (6). 14 Nisan 2013. ss. 602–612. doi:10.1038/ng.2611.
- ^ "Somatic histone H3 alterations in pediatric diffuse intrinsic pontine gliomas and non-brainstem glioblastomas". Nature Genetics. 44 (3). 29 Ocak 2012. ss. 251–253. doi:10.1038/ng.1102.
- ^ Khuong-Quang, Khuong-Quang (3 Haziran 2012). "K27M mutation in histone H3.3 defines clinically and biologically distinct subgroups of pediatric diffuse intrinsic pontine gliomas". Acta Neuropathologica. 124 (3). ss. 439–447. doi:10.1007/s00401-012-0998-0.
- ^ Ida, Ida (Eylül 2015). "Pleomorphic Xanthoastrocytoma: Natural History and Long-Term Follow-Up". Brain Pathology. 25 (5). ss. 575–586. doi:10.1111/bpa.12217.
- ^ Ellison, Ellison (31 Mayıs 2011). "Histopathological grading of pediatric ependymoma: reproducibility and clinical relevance in European trial cohorts". Journal of Negative Results in BioMedicine. 10 (1). doi:10.1186/1477-5751-10-7.
- ^ a b Parker, Parker (19 Şubat 2014). "C11orf95–RELA fusions drive oncogenic NF-κB signalling in ependymoma". Nature. 506 (7489). ss. 451–455. doi:10.1038/nature13109.
- ^ Pietsch, Pietsch (22 Şubat 2014). "Supratentorial ependymomas of childhood carry C11orf95–RELA fusions leading to pathological activation of the NF-κB signaling pathway". Acta Neuropathologica. 127 (4). ss. 609–611. doi:10.1007/s00401-014-1264-4.
- ^ Rodriguez, Rodriguez (1 Eylül 2012). "Disseminated oligodendroglial-like leptomeningeal tumor of childhood: a distinctive clinicopathologic entity". Acta Neuropathologica. 124 (5). ss. 627–641. doi:10.1007/s00401-012-1037-x.
- ^ Huse, Huse (Eylül 2013). "Multinodular and Vacuolating Neuronal Tumors of the Cerebrum: 10 Cases of a Distinctive Seizure-Associated Lesion". Brain Pathology. 23 (5). ss. 515–524. doi:10.1111/bpa.12035.
- ^ Taylor, Taylor (2 Aralık 2011). "Molecular subgroups of medulloblastoma: the current consensus". Acta Neuropathologica. 123 (4). ss. 465–472. doi:10.1007/s00401-011-0922-z.
- ^ Woehrer, Woehrer (15 Aralık 2010). "Incidence of atypical teratoid/rhabdoid tumors in children". Cancer. 116 (24). ss. 5725–5732. doi:10.1002/cncr.25540.
- ^ Judkins, Judkins (Eylül 2007). "Immunohistochemistry of INI1 Expression: A New Tool for Old Challenges in CNS and Soft Tissue Pathology". Advances in Anatomic Pathology. 14 (5). ss. 335–339. doi:10.1097/PAP.0b013e3180ca8b08.
- ^ Hasselblatt, Hasselblatt (Haziran 2011). "Nonsense Mutation and Inactivation of SMARCA4 (BRG1) in an Atypical Teratoid/Rhabdoid Tumor Showing Retained SMARCB1 (INI1) Expression". The American Journal of Surgical Pathology. 35 (6). ss. 933–935. doi:10.1097/PAS.0b013e3182196a39.
- ^ Biegel, Biegel (Ocak 2006). "Molecular genetics of atypical teratoid/rhabdoid tumors". Neurosurgical Focus. 20 (1). ss. 1–7. doi:10.3171/foc.2006.20.1.12.
