Benzen: Revizyonlar arasındaki fark
| [kontrol edilmiş revizyon] | [kontrol edilmiş revizyon] |
Değişiklik özeti yok |
Khutuck Bot (mesaj | katkılar) k Kaynak düzenleme |
||
| 132. satır: | 132. satır: | ||
| Solvent1 = ethanediol |
| Solvent1 = ethanediol |
||
| Solubility2 = 20 °C, solution in water:<br> 1.2 mL/L (20% v/v)<ref name = sioc> |
| Solubility2 = 20 °C, solution in water:<br> 1.2 mL/L (20% v/v)<ref name = sioc> |
||
{{Kitap kaynağı| |
{{Kitap kaynağı| yazar1 = Atherton Seidell| yazar2 = William F. Linke| başlık = Solubilities of Inorganic and Organic Bileşikler: A Compilation of Solubility Data from the Periodical Literature. Supplement| url = https://books.google.com/books?id = k2e5AAAAIAAJ| yıl = 1952| yayıncı = Van Nostrand |
||
}}</ref> |
}}</ref> |
||
| Solvent2 = etanol |
| Solvent2 = etanol |
||
Sayfanın 19.25, 21 Mayıs 2020 tarihindeki hâli
| |||

| |||
| Adlandırmalar | |||
|---|---|---|---|
Tercih edilen IUPAC adı Benzene | |||
Diğer adlar | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.685 | ||
| EC Numarası |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Kimyasal formül | C6H6 | ||
| Molekül kütlesi | 78,11 g mol−1 | ||
| Görünüm | renksiz sıvı | ||
| Koku | benzin gibi | ||
| Yoğunluk | 0.8765(20) g/cm3[2] | ||
| Erime noktası | 553 °C (1.027 °F; 826 K) | ||
| Kaynama noktası | 801 °C (1.474 °F; 1.074 K) | ||
| Çözünürlük (su içinde) | 1.53 g/L (0 °C) 1.81 g/L (9 °C) 1.79 g/L (15 °C)[3][4][5] 1.84 g/L (30 °C) 2.26 g/L (61 °C) 3.94 g/L (100 °C) 21.7 g/kg (200 °C, 6.5 MPa) 17.8 g/kg (200 °C, 40 MPa)[6] | ||
| Çözünürlük (ethanediol içinde) | 5.83 g/100 g (20 °C) 6.61 g/100 g (40 °C) 7.61 g/100 g (60 °C)[6] | ||
| Çözünürlük (etanol içinde) | 20 °C, solution in water: 1.2 mL/L (20% v/v)[8] | ||
| Çözünürlük (acetone içinde) | 20 °C, solution in water: 7.69 mL/L (38.46% v/v) 49.4 mL/L (62.5% v/v)[8] | ||
| Çözünürlük (diethylene glycol içinde) | 52 g/100 g (20 °C)[6] | ||
| log P | 2.13 | ||
| Buhar basıncı | 12.7 kPa (25 °C) 24.4 kPa (40 °C) 181 kPa (100 °C)[7] | ||
| UV-vis (λmax) | 255 nm | ||
| 54.8·10ÿ6 cm3/mol | |||
| Kırınım dizimi (nD) | 1.5011 (20 °C) 1.4948 (30 °C)[6] | ||
| Akmazlık | 0.7528 cP (10 °C) 0.6076 cP (25 °C) 0.4965 cP (40 °C) 0.3075 cP (80 °C) | ||
| Yapı | |||
| Trigonal düzlem | |||
| Dipol momenti | 0 D | ||
| Termokimya | |||
Isı sığası (C)
|
134.8 J/mol·K | ||
Standart molar entropi (S⦵298)
|
173.26 J/mol·K[7] | ||
Standart formasyon entalpisi (ΔfH⦵298)
|
48.7 kJ/mol | ||
Standart yanma entalpisi (ΔcH⦵298)
|
3267.6 kJ/mol[7] | ||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | potential occupational carcinogen, flammable | ||
| GHS etiketleme sistemi: | |||
| Piktogramlar | 
| ||
| İşaret sözcüğü | Danger | ||
| Tehlike ifadeleri | H225, H304, H315, H319, H340, H350, H372[9] | ||
| Önlem ifadeleri | P201, P210, P301+P310, P305+P351+P338, P308+P313, P331[9] | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | [dönüştürme: geçersiz sayı] | ||
| 49.778 °C (89.632 °F; 50.051 K) | |||
| Patlama sınırları | 1.2-7.8% | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
930 mg/kg (rat, oral) | ||
LCLo (yayınlanan en düşük)
|
44,000 ppm (rabbit, 30 min) 44,923 ppm (dog) 52,308 ppm (cat) 20,000 ppm (human, 5 min)[11] | ||
| NIOSH ABD maruz kalma limitleri: | |||
| PEL (izin verilen) | TWA 1 ppm, ST 5 ppm[10] | ||
| REL (tavsiye edilen) | Ca TWA 0.1 ppm ST 1 ppm[10] | ||
| IDLH (anında tehlike) | 500 ppm[10] | ||
| Güvenlik bilgi formu (SDS) | HMDB | ||
| Benzeyen bileşikler | |||
Benzeyen bileşikler
|
Toluen Borazine | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
| Bilgi kutusu kaynakları | |||

Benzen, aren veya aromatik hidrokarbonlar olarak adlandırılan organik bileşikler sınıfının en basit üyesidir. Renksiz, alevlenebilen, kaynama noktası 80,1 °C, erime noktası 5,5 °C olan bir sıvıdır. Moleküler formülü C6H6'dır. Benzen, endüstriyel bakımdan kıymetli olduğu gibi yapısı bakımından da kimya çalışmalarında önemlidir. Kan hücrelerini öldürme etkisi olduğundan kanser yapan bileşikler arasına girer. Eskiden balina yağının ısı etkisiyle bozunmasından elde edilen gaz, basınçla evlere gönderilir ve aydınlatmada kullanılırdı. Bu gazdan yağımsı bir kısım kalırdı. Benzen, 1825 yılında Michael Faraday tarafından bu yağımsı kısımda keşfedildi. Yaklaşık sekiz sene sonra başka araştırmacılar aynı maddeyi benzoik asidin kireçle oksidasyonundan elde ettiler. 1845'te August Wilhelm von Hofmann benzen diye adlandırdığı aynı maddeyi elde etmek için kömür katranı kullandı.

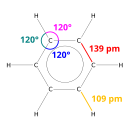
Benzen, karbon atomlarının düzlemde düzgün altıgen şeklinde dizilmesinden meydana gelen bir yapıya sahiptir. Karbonlar arasında mesafe 1397 angströmdür. Köşelerde bulunan her karbon atomuna bir hidrojen atomu bağlıdır. Ayrıca değişik konformasyon yapılarında bulunabilir. Uzaysal olarak şekli düzlemsel şekline oranla oldukça farklıdır
Tepkime yeteneği
Benzenin yapısının kimyasal tepkimelere ne şekilde bir tepki gösterdiği üzerine yapılan çalışmaların, organik kimya teorilerinin gelişmesinde önemi büyük olmuştur. Hidrojen atomlarının karbon atomlarına oranının böyle düşük olduğu bir bileşikten umulan katılma tepkimeleri benzende olmaz. Benzenin gösterdiği tipik tepkimelerden biri, substitüsyon tepkimeleridir. Bu tepkime bir aktif grubun benzendeki bir hidrojeni çıkarıp onun yerine geçmesi şeklinde gerçekleşir. Bu davranışı izah etmek altı elektronun (benzende varmış gibi gösterilen 3 tane çifte bağdan ileri gelen) belli karbonlarda değil bütün benzen karbonlarına dağılmış olduğunu düşünmekle mümkün olur. Elektronların böyle dağılmış olması (belli karbonlarda olmaması) molekülün kararlı olmasını sağlar ve yine bu molekülün fiziksel ve kimyasal özelliklerini belirler.
Elde edilişi
Benzenin sübstitüsyon (yer değiştirme) tepkimeleri oldukça önemlidir. Çünkü, aromatik bileşiklerin pek çoğu bu tepkimelerle oluşturulur. İkinci Dünya Savaşı'ndan önce benzenin önemli kaynağı maden kömüründen elde edilen katran idi. İkinci Dünya Savaşı sırasında benzen ve bununla ilgili aromatik hidrokarbonlara (toluen, ksilen vb.) duyulan büyük ihtiyaç sebebiyle başka kaynaklar aranmaya başlandı. Bugün Amerika'da üretilen benzenin % 75'i petrolden olup, toluenin (C6H5-CH3) veya toluen içeren petrolün dealkilizasyonu işlemi ile yapılmaktadır. Bu işlem hidrojen kullanmayı, yüksek sıcaklığı, basıncı ve bir de katalizörü gerektirmektedir. İkinci bir metot naftence zengin petrolün yüksek sıcaklık ve basınçta dehidrojenlenmesidir. Benzen, fenol'ün indirgenmesiyle ve asetilenin trimerizasyonundan elde edilir.
Kullanılışı
Benzen, sanayide plastik imalinde kullanılan stiren ve fenolun sentezinde başlangıç maddesi olarak, naylon bileşenlerinde, sentetik deterjan üretiminde kullanılır. Uçak benzinlerinde, boya yapmaya yarayan anilinin başlangıç maddesi ve böcek öldürücü olarak da benzen kullanılır. Benzen aynı zamanda iyi bir çözücüdür
Kaynakça
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Adlar 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. ss. 138, 577. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Lide, D. R., (Ed.) (2005). CRC Handbook of Chemistry and Physics (86. bas.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Arnold, D.; Plank, C.; Erickson, E.; Pike, F. (1958). "Solubility of Benzene in Water". Industrial & Engineering Chemistry Chemical & Engineering Data Series. 3 (2). ss. 253-256. doi:10.1021/i460004a016.
- ^ Breslow, R.; Guo, T. (1990). "Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers". Proceedings of the National Academy of Sciences of the United States of America. 87 (1). ss. 167-9. Bibcode:1990PNAS...87..167B. doi:10.1073/pnas.87.1.167. PMC 53221 $2. PMID 2153285.
- ^
Coker, A. Kayode; Ludwig, Ernest E. (2007). = N8RcH8juG_YC&pg = PA114 Ludwig's Applied Process Design for Chemical And Petrochemical Plants
|url=değerini kontrol edin (yardım). 1. Elsevier. s. 114. ISBN 0-7506-7766-X. Erişim tarihi: 2012-05-31. - ^ a b c d e http://chemister.ru/Database/properties-en.php?dbid = 1&id = 644
- ^ a b c Benzene in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD)
- ^ a b
Atherton Seidell; William F. Linke (1952). = k2e5AAAAIAAJ Solubilities of Inorganic and Organic Bileşikler: A Compilation of Solubility Data from the Periodical Literature. Supplement
|url=değerini kontrol edin (yardım). Van Nostrand. - ^ a b c Sigma-Aldrich Co., Benzene. Retrieved on 2014-05-29.
- ^ a b c
NIOSH Pocket Guide to Chemical Hazards. [https://www.cdc.gov/niosh/npg/npgd 0049
.html "# 0049"]
|url=değerini kontrol edin (yardım). National Institute for Occupational Safety and Health (NIOSH). 40. harf sırasında bulunan|url=parametresi line feed character içeriyor (yardım) - ^
71432.html "Benzen"
|url=değerini kontrol edin (yardım). Immediately Dangerous to Life or Health Concentrations (IDLH). Ulusal İş Sağlığı ve Güvenliği Enstitüsü (NIOSH). - ^ August Kekulé: Ueber einige Condensationsproducte des Aldehyds, Liebigs Ann. Chem. 1872, 162 (1), S. 77–124; DOI:10.1002/jlac.18721620110.