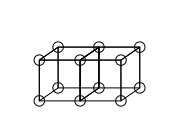
Kübik atom
Kübik atom modeli Elektronların kutupsuz atomlar veya moleküller olarak bir küpün 8 köşesine sıralandığı bir atom modelidir. Bu teori 1902'de Gilbert Newton Lewis tarafından geliştirilmiştir.1916'da "The Atom and Molecule" (Atom ve Molekül" adlı makalede yayınlanmıştır ve Değerlik olgusunu açıklamak için kullanılmıştır. Lewis'in teorisi Abegg'in kuralına dayanıyordu. Irving Langmuir bunu 1919'da geliştirerek "cubical octet atom" (Kübik oktet atom) modeli haline getirmiştir.[1] Aşağıdaki resim, Periyodik tablonun ikinci satırındaki elementler için yapısal gösterimleri göstermektedir.
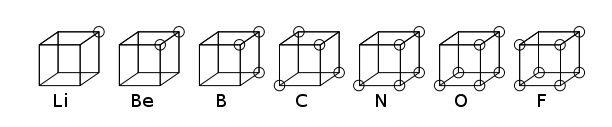
Atomun kübik modeli kısa sürede Schrödinger denklemine dayanan kuantum mekaniği modeli olarak değiştirilmiş olsa da, kimyasal bağın anlaşılmasına yönelik önemli bir adımdır. Gilbert Newton Lewis tarafından 1916'da yayınlanan makalede, kovalent bağ, oktet kuralı ve şu anda adı verilen Lewis yapısında elektron çifti kavramı da tanıtıldı.
Kübik atom modelinde bağlanma[değiştir | kaynağı değiştir]
Aşağıdaki yapı C'de olduğu gibi, iki atom bir kenarı paylaştığında tekli kovalent bağlar oluşur. İyonik bağlar, bir kenarı (A) paylaşmadan, bir küpten diğerine bir elektron aktarımı ile oluşturulur. Lewis, yalnızca bir köşenin paylaşıldığı bir ara durum olarak B'yi de öne sürdü.
İki kübik atom arasında bir yüz paylaşılırsa bu, çift bağ oluşur. Bu dört elektron paylaşımı ile sonuçlanır;
Üçlü bağlar kübik atom modeli tarafından hesaplanamaz, çünkü iki kübün üç paralel kenarı paylaşmasının herhangi bir yolu yoktur. Lewis, atomik bağlardaki elektron çiftlerinin, aşağıdaki şekilde olduğu gibi tetrahedral bir yapıya sahip olan özel bir çekime sahip olduklarını öne sürdü (elektronların yeni konumu, kalın kenarların ortasındaki noktalı dairelerle temsil edildi). Bu, bir kenarı paylaşarak bir köşe, bir çift bağ ve bir yüz paylaşarak üçlü bir bağ paylaşarak tek bir bağ oluşturulmasını sağlar.Aynı zamanda, tekli bağlar çevresinde ve metanın dört yüzlü geometrisi için serbest dönüşü kavramını da açıklar.
Ayrıca bakınız[değiştir | kaynağı değiştir]
Kaynakça[değiştir | kaynağı değiştir]
- ^ Langmuir, Irving (1 Haziran 1919). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6). ss. 868-934. doi:10.1021/ja02227a002.