G proteini
Bu madde, Vikipedi biçem el kitabına uygun değildir. (Haziran 2011) |


G proteinleri (guanin nükleotid-bağlayıcı proteinler) hücrenin dışından gelen sinyalleri hücre içine ileten ve hücre içinde değişiklikler oluşturan bir protein ailesidir.Birçok hormonlar,nörotransmitterler ve diğer sinyal iletim molekülleri sinyallerini hücre içine bu yolla iletir.[1]
G proteini kenetli reseptörler transmembran almaçlardır. Sinyal molekülleri hücrenin dışına yerleşen bir alanına bağlanır. Hücre içi bir alan da G proteinini etkinleştir. G proteini de pek çok farklı bileşiği etkinleştirir. Sonuçta hücre içinde değişikliklerin oluşması sağlanır.
G proteinleri moleküler düğmeler gibi işlev görürler...GTP molekülüne bağlandıklarında etkindirler ve GDP molekülüne bağlandıklarında devredışı kalırlar..
Metabolik enzimleri,iyon kanallarını,taşıyıcıları ve hücrenin transkripsiyon,motilite,kontraktilite,salgı gibi diğer işlevleriyle ilgili parçalarını düzenlerler...Böylelikle embryonik gelişim,öğrenme ve bellek,homeostazi gibi büyük işlevler düzenlenmiş olur.. [2]
G proteinleri Alfred G. Gilman ve Martin Rodbell hücreleri adrenalin ile uyarmaya çalıştıkları sırada keşfedilmişlerdir.Adrenalinin almacına bağlandığında doğrudan enzimleri uyarmadığını gördüler.Bunun yerine almaç bir G proteinini uyarıyordu o da enzimleri uyarıyordu.Örneğin bir ikinci ulak olan cAMP üretimini arttıran adenilat siklaz enzimi gibi.[3] Bu keşiften dolayı 1994 Nobel Fizyoloji ve Tıp Ödülünü aldılar.[4]
G proteinleri GTPazlar denen geniş bir enzim ailesinin üyeleridirler.
İşlev[değiştir | kaynağı değiştir]
G proteinleri önemli sinyal iletimi molekülleridir.GPEA[G Protein Eşlenik Almaç]ların işlev bozukluğu diabetes mellitus, körlük,alerjiler,depresyon,kardiyovasküler defektler ve pek çok kanser formu gibi birçok hastalıkla ilişkilidir..Günümüzde kullanılan modern ilaçların çoğu GPEA'ları hedeflemektedir.[5]
İnsan genomu kabaca 950 G proteini eşlenik almaç kodlar,bunlar fotonları,hormonları,büyüme faktörlerini, ilaçları ve diğer endojen ligandları tanırlar.Yaklaşık 150 tanesinin işlevi hala bilinmemektedir.
G proteini sinyal iletim tipleri[değiştir | kaynağı değiştir]
G proteinleri iki aileye ayrılır:Heterotrimerik G proteinleri bazen büyük G proteinleri olarak da anılır ve alfa,beta,gama altbirimlerinden oluşan G protein eşlenik almaçlarca aktif hale getirilir. Ayrıca 20-25 kDa boyutunda ufak G proteinleri de vardır.Bunlar Ufak GTPazların Ras süper ailesine ait olanlarıdır.Bunlar heterotrimerik G proteinlerinin alfa altbirimleri ile homologdur ama monomerik haldedir.Bunlar da sinyal iletiminde görevli GTP ve GDP leri bağlarlar.
Heterotrimerik G proteinleri[değiştir | kaynağı değiştir]
Farklı heterotrimerik G proteini tipleri aynı ortak yolu kullanır.G proteini eşlenik almaçtaki bir konformasyon değişikliğine yanıt olarak aktiflenirler.GDP yi GTP ile değiştirirler.Sinyal iletim yolundaki diğer proteinleri aktiflerler.Fakat özel mekanizmaları da vardır.
Ortak yol[değiştir | kaynağı değiştir]
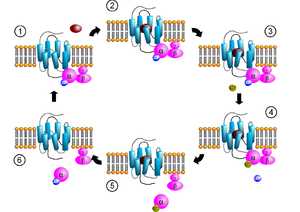
Almaçla aktiflenen G proteinleri hücre zarının iç yüzeyinde bulunurlar.Gα ve Gβγ altbirimleri içerirler.Gα altbiriminin pek çok alt birimi vardır:Gsα (G stimulan), Giα (G inhibitör), Goα (G diğer), Gq/11α, ve G12/13α gibi.Aynı aktivasyon mekanizmasını kullanarak farklı effektörlere etki ederler.
Aktivasyon[değiştir | kaynağı değiştir]
Bir ligand G protein eşlenik almaçları aktiflediğinde, reseptörde konformasyonel bir değişiklik oluşturarak onu bir GEF yani guanin exchange faktörü haline getirir bu da Gα altbirimini Gβγ altbiriminden ayırır.[6][7] Hem Gα-GTP hem de Gβγ başka sinyal yolaklarını etkinleştirebilir. (ikincil ulak yolakları)[8]
Terminasyon[değiştir | kaynağı değiştir]
Gα altbirimi enzimatik etkinlikle GTP yi GDP ye parçalar.Yeniden Gβγ ile ilişki kurmasını sağlar ve döngü tamamlanır.G protein sinyal regülatörü denen ve GTPAZ-aktifleştiren proteinler bu tepkimeyi hızlandırır.Gα altbirimine özeldirler.Bazen efektör kendisi GAP etkinliğine yol açar..Böylece etki hızlı sonlandırılır.
Özel mekanizmalar[değiştir | kaynağı değiştir]
- Gαs cAMP-bağımlı-yolu ATPden cAMP üretimini arttırarak etkinleştirir.Bu doğrudan zarla ilişkide olan adenilat siklaz enziminin uyarılmasıyla olur. cAMP bir ikinci ulak gibi etki ederek protein kinaz Ayı uyarır. PKA daha sonra diğer yolları etkinleştirir.
- GαiATP'den cAMP üretimini inhibe eder.
- Gαq/11 zara bağlı Fosfolipaz C betayı uyarır o da PIP2 yi IP3 ve DAG adlı iki tane ikinci ulağa parçalar.
- Gα12/13 Rho ailesi GTPazlardandır ve hücre iskeleti ve göçünü düzenler.
- Gβγ de bazen işlev kazanır örneğin G protein eşlenik inwardly-rectifying potasyum kanalını açar.
Ufak GTPazlar[değiştir | kaynağı değiştir]
Ufak GTPazlar da GTP ve GDP ye bağlanır ve sinyal iletiminde rol alır.Bunlar heterotrimerlerdeki alfa subunit ile homologdurlar ama monomer halinde bulunurlar.20-25kDa ufak proteinlerdir.GTP bağlarlar.Ras ailesine olan benzerliklerinden ötürü Ras ailesi GTPazlar da denir.
Lipidasyon[değiştir | kaynağı değiştir]
Plazma zarının iç veya dış yaprağıyla ilişki kurabilmek için birçok G proteini ve ufak GTPazlar lipidasyona uğrar,yağ uzantıları kovalent bağla balanır.Miristol,palmitoile ya da prenile halde olabilir..
Kaynakça[değiştir | kaynağı değiştir]
- ^ Reece, Jane; Campbell, Neil (2002). Biology. San Francisco: Benjamin Cummings. ISBN 0-8053-6624-5.
- ^ "G Protein Yolları -- Neves et al. 296 (5573): 1636 -- Science". 31 Mayıs 2002. 17 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Nisan 2011.
- ^ 1994 Nobel Tıp ve Fizyoloji Ödülü 12 Nisan 2011 tarihinde Wayback Machine sitesinde arşivlendi., Illustrated Lecture.
- ^ Basın Açıklaması: 7 Haziran 2011 tarihinde Wayback Machine sitesinde arşivlendi. Karolinska Enstitüsündeki Nobel Kuruluşu bu iki bilim adamını G proteinleri ve onların hücre içindeki sinyal iletimindeki rolleri ile ilgili bu çalışmalarından ötürü 10 Ekim 1994 tarihinde Nobel Fizyoloji ve Tıp ödülüyle ödüllendirildi.
- ^ Wu, Ge (2010). "Assays with GPCRs". Assay Development: Fundamentals and Practices. John Wiley and Sons. ss. 265-285. ISBN 0470191155.
- ^ Digby GJ, Lober RM, Sethi PR, Lambert NA. (2006). "Bazı G protein heterotrimerleri yaşayan hücrelerde fiziksel olarak altbirimlere ayrılır". Proc Natl Acad Sci USA. 103 (47). ss. 17789-94. doi:10.1073/pnas.0607116103. PMC 1693825 $2. PMID 17095603.
- ^ Khafizov, K.; Lattanzi, G.; Carloni, P. (2009). "Simulasyon metotlarıyla araştırılan G proteininin etkin ve pasif formları". PROTEINS : Structure, Function, and Bioinformatics. 75 (4). ss. 919-30. doi:10.1002/prot.22303. PMID 19089952.
- ^ Yuen, Jessie W.F. (2010). "Activation of STAT3 by specific G[alpha] subunits and multiple G[beta][gamma] dimers". The International Journal of Biochemistry & Cell Biology. 42 (6). ss. 1052-1059. doi:10.1016/j.biocel.2010.03.017. ISSN 1357-2725.
| Wikimedia Commons'ta G proteini ile ilgili ortam dosyaları bulunmaktadır. |
