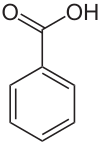
Benzoik asit
| |||

| |||
| Adlandırmalar | |||
|---|---|---|---|
Tercih edilen IUPAC adı Benzoik asit[1] | |||
Benzenkarboksilik asit | |||
Diğer adlar
| |||
| Özellikler | |||
| Kimyasal formül | C7H6O2 | ||
| Molekül kütlesi | 122,12 g mol−1 | ||
| Görünüm | Renksiz kristalimsi katı | ||
| Koku | Hafif, hoş bir koku | ||
| Yoğunluk | 1,2659 g/cm3 (15 °C) 1,0749 g/cm3 (130 °C)[2] | ||
| Erime noktası | 122 °C (252 °F; 395 K)[7] | ||
| Kaynama noktası | 250 °C (482 °F; 523 K)[7] | ||
| Çözünürlük (su içinde) | 1,7 g/L (0 °C) 2,7 g/L (18 °C) 3,44 g/L (25 °C) 5,51 g/L (40 °C) 21,45 g/L (75 °C) 56,31 g/L (100 °C)[2][3] | ||
| Çözünürlük | aseton, benzen, CCl4, CHCl3, alkol, etil eter, hekzan, feniller, sıvı amonyak, asetatlar içinde çözünür | ||
| Çözünürlük (metanol içinde) | 30 g/100 g (−18 °C) 32,1 g/100 g (−13 °C) 71,5 g/100 g (23 °C)[2] | ||
| Çözünürlük (etanol içinde) | 25,4 g/100 g (−18 °C) 47,1 g/100 g (15 °C) 52,4 g/100 g (19,2 °C) 55,9 g/100 g (23 °C)[2] | ||
| Çözünürlük (aseton içinde) | 54,2 g/100 g (20 °C)[2] | ||
| Çözünürlük (zeytinyağı içinde) | 4,22 g/100 g (25 °C)[2] | ||
| Çözünürlük (1,4-dioksan içinde) | 55,3 g/100 g (25 °C)[2] | ||
| log P | 1,87 | ||
| Buhar basıncı | 0,16 Pa (25 °C) 0,19 kPa (100 °C) 22,6 kPa (200 °C)[4] | ||
| Asitlik (pKa) | |||
| −70,28·10−6 cm3/mol | |||
| Kırınım dizimi (nD) | 1,5397 (20 °C) 1,504 (132 °C)[2] | ||
| Akmazlık | 1,26 mPa (130 °C) | ||
| Yapı | |||
| Monoklinik | |||
| Düzlemsel | |||
| Dipol momenti | Dioksan içinde 1,72 D | ||
| Termokimya | |||
Isı sığası (C)
|
146,7 J/mol·K[4] | ||
Standart molar entropi (S⦵298)
|
167,6 J/mol·K[2] | ||
Standart formasyon entalpisi (ΔfH⦵298)
|
−385,2 kJ/mol[2] | ||
Standart yanma entalpisi (ΔcH⦵298)
|
−3228 kJ/mol[4] | ||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | Irritant | ||
| GHS etiketleme sistemi: | |||
| Piktogramlar |   [8] [8]
| ||
| İşaret sözcüğü | Tehlike | ||
| Tehlike ifadeleri | H318, H335[8] | ||
| Önlem ifadeleri | P261, P280, P305+P351+P338[8] | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | 121,5 °C (250,7 °F; 394,6 K)[7] | ||
| 571 °C (1.060 °F; 844 K)[7] | |||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
1700 mg/kg (rat, oral) | ||
| Güvenlik bilgi formu (SDS) | JT Baker | ||
| Benzeyen bileşikler | |||
Diğer katyonlar
|
Sodyum benzoat, Potasyum benzoat | ||
Benzeyen karboksilik asitler
|
Hidroksibenzoik asitler Aminobenzoik asitler, Nitrobenzoik asitler, Fenilasetik asit | ||
Benzeyen bileşikler
|
Benzaldehit, Benzil alkol, Benzoil klorür, Benzilamin, Benzamid, Benzonitril | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Benzoil asit, beyaz kristaller hâlinde bir karboksilik asit; uzun süre saklanacak besinlerin korunmasında, çeşitli kozmetiklerin, boyarmaddelerin, plastiklerin ve böcek ilaçlarının yapımında yaygın olarak kullanılır.
İçerik/Üretim[değiştir | kaynağı değiştir]
İlk kez 16. yüzyılda tanımlanan benzoik asit, doğada birçok birçok bitkinin yapısında bulunur; bazı sebzelerdeki reçinemsi maddenin (benzoin zamkı) yüzde 20'sini oluşturur. İlk kez 1860'larda kömür katranından ayrılan bileşiklerden birleşim yoluyla elde edilen benzoik asit, bugün sanayide toluenin, yaklaşık 200 °C'de ve katalizör olarak kullanılan kobalt ve manganez tuzları eşliğinde oksijenle tepkimesinden üretilir. Saf benzoik asit 122 °C'de erir ve suda çok az çözünür.
Benzoik asitin en önemli türevleri, besinlerin saklanmasında kullanılan sodyum benzoat tuzu, kenelere karşı kullanılan benzil benzoat esteri ve bâzı plastiklerin üretiminde tepkime başlatıcı ya da dokumalaarı ağartma tozu olarak kullanılan benzoil peroksittir.
Kaynakça[değiştir | kaynağı değiştir]
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. s. 745. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ a b c d e f g h i j "benzoic acid". chemister.ru. 23 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Ekim 2018.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. 14 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Ağustos 2023.
- ^ a b c Benzoic acid in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD) (23 Mayıs 2014 tarihinde erişilmiştir)
- ^ Harris, Daniel (2010). Quantitative Chemical Analysis (8 bas.). New York: W. H. Freeman and Company. ss. AP12. ISBN 9781429254366.
- ^ Olmstead, William N.; Bordwell, Frederick G. (1980). "Ion-pair association constants in dimethyl sulfoxide". The Journal of Organic Chemistry. 45 (16): 3299-3305. doi:10.1021/jo01304a033.
- ^ a b c d Alman İş Güvenliği ve Sağlığı Enstitüsü'nün GESTIS Madde Veritabanındaki [1]
- ^ a b c Sigma-Aldrich Co., Benzoic acid. Retrieved on 23 Mayıs 2014.