Aşı (tıp)
| Aşı | |
|---|---|
 Çiçek aşısı ve aşıyı uygulamak için gerekli ekipman | |
| MeSH | D014612 |
| seri |
| Aşılama |
|---|
Aşı, belirli bir bulaşıcı veya malign hastalığa karşı aktif kazanılmış bağışıklık sağlayan biyolojik bir preparattır.[1][2] Aşıların güvenliği ve etkinliği geniş çapta incelenmiş ve doğrulanmıştır.[3][4] Bir aşı tipik olarak hastalığa neden olan bir mikroorganizmaya benzeyen bir ajan içerir ve genellikle mikrobun zayıflatılmış veya öldürülmüş formlarından, toksinlerinden veya yüzey proteinlerinden yapılır. Vücudun bağışıklık sistemi ajanı bir tehdit olarak tanır, yok eder ve bu sayede gelecekte karşılaşabileceği bu ajanla ilişkili mikroorganizmaları daha fazla tanır ve yok eder.
Aşılar profilaktik (doğal veya "vahşi" bir patojen tarafından gelecekteki bir enfeksiyonun etkilerini önlemek veya iyileştirmek için) veya terapötik (kanser gibi zaten meydana gelmiş bir hastalıkla savaşmak için) olabilir.[5][6][7][8] Bazı aşılar, enfeksiyonun tamamen önlendiği tam sterilize edici bağışıklık sunar.[9]
Aşıların uygulanmasına aşılama denir. Aşılama, bulaşıcı hastalıkların önlenmesinde en etkili yöntemdir;[10] çiçek hastalığının dünya çapında ortadan kaldırılmasından ve çocuk felci, kızamık ve tetanos gibi hastalıkların dünyanın büyük bir bölümünden sınırlandırılmasından büyük ölçüde aşılama sayesinde oluşturulan yaygın bağışıklık sorumludur. Dünya Sağlık Örgütü (DSÖ) şu anda yirmi beş farklı önlenebilir enfeksiyon için lisanslı aşıların mevcut olduğunu bildirmektedir.[11]
Çiçek hastalığını önlemek için inokülasyonun kayıtlara geçen ilk kullanımı 16. yüzyılda Çin'de gerçekleşmiş olup, Çin'deki uygulamanın ilk ipuçları 10. yüzyılda ortaya çıkmıştır.[12] Bu, aynı zamanda aşısı üretilen ilk hastalıktı.[13][14] Çiçek hastalığına karşı halk arasında uygulanan inokülasyon 1721 yılında Mary Wortley Montagu tarafından Osmanlı İmparatorluğu'ndan İngiltere'ye getirilmiştir.[15] Vaccine (aşı) ve vaccination (aşılama) terimleri, hem aşı kavramını geliştiren hem de ilk aşıyı yaratan Edward Jenner tarafından inek çiçeğini ifade etmek için geliştirilen Variolae vaccinae (inek çiçeği) teriminden türetilmiştir. Jenner bu ifadeyi 1798 yılında inek çiçeğinin çiçek hastalığına karşı koruyucu etkisini anlattığı Variolae vaccinae Known as the Cow Pox adlı kitabının uzun başlığı için kullanmıştır.[16] 1881 yılında Louis Pasteur, Jenner'ı onurlandırmak için bu terimlerin o dönemde geliştirilmekte olan yeni koruyucu aşıları da kapsayacak şekilde genişletilmesini önermiştir.[17] Aşı geliştirme ve üretme bilimi aşı bilimi olarak adlandırılır.

Etkiler[değiştir | kaynağı değiştir]
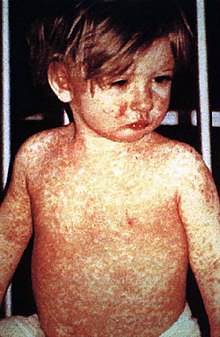
Aşıların bulaşıcı hastalıklarla mücadele etmenin ve bu hastalıkları ortadan kaldırmanın çok güvenli ve etkili bir yolu olduğu konusunda büyük bir bilimsel görüş birliği vardır.[19][20][21][22] Bağışıklık sistemi aşı ajanlarını yabancı olarak tanır, onları yok eder ve "hatırlar". Bir ajanın virülan versiyonuyla karşılaşıldığında, vücut virüsün üzerindeki protein kabuğunu tanır ve böylece ilk olarak hedef ajanı hücrelere girmeden önce nötralize ederek ve ikinci olarak bu ajan çok sayıda çoğalmadan önce enfekte olmuş hücreleri tanıyıp yok ederek yanıt vermeye hazırlanır.[23][24]
Bununla birlikte, aşıların etkinliklerine yönelik sınırlamalar mevcuttur.[25] Bazen, aşı zayıflaması, aşılama rejimleri veya uygulamadaki başarısızlıklar gibi aşı ile ilgili nedenlerden dolayı koruma başarısız olmaktadır.[26]
Başarısızlık, konakçının bağışıklık sisteminin yeterli veya hiç yanıt vermemesi durumunda konakçıya bağlı nedenlerle de ortaya çıkabilir. Konakçıya bağlı yanıt eksikliği, genetik, bağışıklık durumu, yaş, sağlık ve beslenme durumu gibi faktörlere bağlı olarak bireylerin tahmini %2-10'unda görülür.[26] Genetik başarısızlıkla sonuçlanan birincil immün yetmezlik bozukluğunun bir türü, B hücresi gelişimi için gerekli olan bir enzimin yokluğunun, konağın bağışıklık sisteminin bir patojene karşı antikor üretmesini engellediği X'e bağlı agamaglobulinemidir.[27][28]
Konak-patojen etkileşimleri ve enfeksiyona verilen yanıtlar, bağışıklık sistemindeki çoklu yolları içeren dinamik süreçlerdir.[29][30] Bir konakçı anında antikor geliştirmez: vücudun doğuştan gelen bağışıklığı on iki saat gibi kısa bir sürede aktive olabilirken, adaptif bağışıklığın tam olarak gelişmesi 1-2 hafta sürebilir. Bu süre zarfında konakçı hâlâ enfekte olabilir.[31]
Antikorlar üretildikten sonra, ilgili antikor sınıfına bağlı olarak çeşitli yollardan herhangi biriyle bağışıklık desteklenebilir. Bir patojeni temizlemedeki veya etkisiz hale getirmedeki başarı, üretilen antikorların miktarına ve bu antikorların ilgili patojen türüne karşı ne ölçüde etkili olduğuna bağlı olacaktır, çünkü farklı türler belirli bir bağışıklık reaksiyonuna farklı şekilde duyarlı olabilir.[30] Bazı durumlarda aşılar tam veya kalıcı bağışıklık yerine kısmi bağışıklık koruması (bağışıklığın %100'den daha az etkili olduğu ancak yine de enfeksiyon riskini azalttığı) veya geçici bağışıklık koruması (bağışıklığın zaman içinde azaldığı) ile sonuçlanabilir. Yine de aşılar bir bütün olarak popülasyon için yeniden enfeksiyon eşiğini yükseltebilir ve önemli bir etki yaratabilir.[32] Ayrıca aşılar enfeksiyonun şiddetini azaltarak daha düşük ölüm oranı, daha düşük morbidite, hastalıktan daha hızlı iyileşme ve çok çeşitli başka etkilere neden olabilir.[33][34]
Daha yaşlı olanlar genellikle daha genç olanlara göre daha az tepki gösterirler, bu da immünosenesans olarak bilinen bir modeldir.[35] Adjuvanlar, özellikle basit bir aşıya karşı bağışıklık tepkisi zayıflamış olabilecek yaşlı kişilerde bağışıklık tepkisini artırmak için yaygın olarak kullanılır.[36]
Aşının etkinliği veya performansı çeşitli faktörlere bağlıdır:
- Hastalığın kendisi (bazı hastalıklarda aşılama diğerlerine göre daha iyi performans gösterir)
- Aşı türü (bazı aşılar hastalığın belirli türlerine özgüdür veya en azından bu türlere karşı en etkilidir)[37]
- Aşı takvimine uygun şekilde uyulup uyulmadığı.
- Aşıya verilen kendine özgü yanıt; bazı bireyler belirli aşılara "yanıt vermezler", yani doğru şekilde aşılandıktan sonra bile antikor üretmezler.
- Etnik köken, yaş veya genetik yatkınlık gibi çeşitli faktörler.
Aşılanmış bir birey aşılanan hastalığa yakalanırsa (atılım enfeksiyonu) hastalığın aşılanmamış vakalara göre daha az öldürücü olması muhtemeldir.[38]
Etkili bir aşılama programında dikkat edilmesi gereken önemli hususlar şunlardır:[39]
- Bir bağışıklama kampanyasının orta ve uzun vadede hastalığın epidemiyolojisi üzerinde yaratacağı etkiyi öngörmek için dikkatli bir modelleme
- Yeni bir aşının piyasaya sürülmesini takiben ilgili hastalık için devam eden gözetim
- Bir hastalık nadir hale geldiğinde bile yüksek aşılama oranlarının sürdürülmesi
1958 yılında Amerika Birleşik Devletleri'nde 763.094 kızamık vakası görülmüş ve 552 kişi hayatını kaybetmiştir.[40][41] Yeni aşıların kullanılmaya başlanmasından sonra vaka sayısı yılda 150'nin altına düşmüştür (medyan 56).[41] 2008 yılının başlarında 64 şüpheli kızamık vakası görülmüştür. Bu enfeksiyonların elli dördü başka bir ülkeden ithalatla ilişkilendirilmiştir, ancak sadece yüzde on üçü gerçekten Amerika Birleşik Devletleri dışında edinilmiştir; 64 kişiden 63'ü ya hiç kızamık aşısı olmamıştır ya da aşı olup olmadıkları belirsizdir.[41]
Aşılar, insanlardaki en bulaşıcı ve ölümcül hastalıklardan biri olan çiçek hastalığının ortadan kaldırılmasını sağlamıştır.[42] Kızamıkçık, çocuk felci, kızamık, kabakulak, suçiçeği ve tifo gibi diğer hastalıklar, yaygın aşılama programları sayesinde artık yüz yıl önceki kadar yaygın değildir. İnsanların büyük çoğunluğu aşılandığı sürece bir hastalık salgınının ortaya çıkması çok daha zordur. Bu etkiye sürü bağışıklığı denmektedir. Sadece insanlar arasında bulaşan çocuk felci, endemik çocuk felcinin sadece üç ülkenin (Afganistan, Nijerya ve Pakistan) bazı bölümleriyle sınırlandırıldığı kapsamlı bir eradikasyon kampanyasının hedefidir.[43] Ancak, tüm çocuklara ulaşmanın zorluğu, kültürel yanlış anlamalar ve dezenformasyon, öngörülen eradikasyon tarihinin birkaç kez kaçırılmasına neden olmuştur.[44][45][46][47]
Aşılar ayrıca antibiyotik direncinin gelişmesini önlemeye de yardımcı olur. Örneğin, aşı programları Streptococcus pneumoniae'nin neden olduğu zatürre vakalarını büyük ölçüde azaltarak penisilin veya diğer birinci basamak antibiyotiklere dirençli enfeksiyonların yaygınlığını büyük ölçüde azaltmıştır.[48]
Kızamık aşısının her yıl bir milyon ölümü önlediği tahmin edilmektedir.[49]
Yan etkiler[değiştir | kaynağı değiştir]
Çocuklara, ergenlere veya yetişkinlere yapılan aşılar genellikle güvenlidir.[50][51] Yan etkiler - eğer varsa - genellikle hafiftir.[52] Yan etkilerin oranı söz konusu aşıya göre değişir.[52] Bazı yaygın yan etkiler arasında ateş, enjeksiyon bölgesi çevresinde ağrı ve kas ağrıları yer alır.[52] Ayrıca, bazı kişiler aşıdaki bileşenlere karşı alerjik olabilir.[53] KKK aşısı nadiren ateşli nöbetlerle ilişkilendirilir.[51]
Genetik, sağlık durumu (altta yatan hastalık, beslenme, hamilelik, hassasiyetler veya alerjiler), bağışıklık yeterliliği, yaş ve ekonomik etki veya kültürel çevre gibi bir kişiyi enfeksiyona duyarlı hale getiren konakçı ("aşı") ile ilgili belirleyiciler, enfeksiyonun şiddetini ve aşıya yanıtı etkileyen birincil veya ikincil faktörler olabilir.[26] Yaşlı (60 yaş üstü), alerjene aşırı duyarlı ve obez kişiler, aşı etkinliğini önleyen veya engelleyen, muhtemelen bu spesifik popülasyonlar için ayrı aşı teknolojileri veya virüs bulaşmasını sınırlamak için tekrarlayan takviye aşıları gerektiren tehlikeye atılmış immünojenisiteye duyarlıdır.[26]
Ciddi yan etkiler son derece nadirdir.[51] Suçiçeği aşısı bağışıklık sistemi yetersiz bireylerde nadiren komplikasyonlarla ilişkilidir ve rotavirüs aşıları orta derecede intussusepsiyon ile ilişkilidir.[51]
En az 19 ülkede, aşılamanın ciddi olumsuz etkilerine maruz kalanlara tazminat sağlamak için hatasız tazminat programları bulunmaktadır.[54] Amerika Birleşik Devletleri'nin programı Ulusal Çocukluk Çağı Aşı Yaralanmaları Yasası olarak bilinmektedir ve Birleşik Krallık'ta Aşı Hasar Ödemesi uygulanmaktadır.
Türler[değiştir | kaynağı değiştir]

Aşılar tipik olarak zayıflatılmış, inaktive edilmiş veya ölü organizmalar veya bunlardan elde edilen saflaştırılmış ürünler içerir. Kullanımda olan çeşitli aşı türleri vardır.[55] Bunlar, yararlı bir bağışıklık tepkisi oluşturma yeteneğini korurken hastalık riskini azaltmaya çalışmak için kullanılan farklı stratejileri temsil etmektedir.
Zayıflatılmış[değiştir | kaynağı değiştir]
Bazı aşılar canlı, zayıflatılmış mikroorganizmalar içerir. Bunların çoğu, virülan özelliklerini devre dışı bırakan koşullar altında yetiştirilen veya geniş bir bağışıklık tepkisi üretmek için yakından ilişkili ancak daha az tehlikeli organizmaları kullanan aktif virüslerdir. Zayıflatılmış aşıların çoğu viral olmasına rağmen, bazıları doğası gereği bakteriyeldir. Örnekler arasında sarıhumma, kızamık, kabakulak ve kızamıkçık gibi viral hastalıklar ve tifo gibi bakteriyel hastalıklar yer almaktadır. Calmette ve Guérin tarafından geliştirilen canlı Mycobacterium tuberculosis aşısı bulaşıcı bir suştan yapılmamıştır, ancak aşıya karşı bir bağışıklık tepkisi ortaya çıkarmak için kullanılan "BCG" adı verilen virülan olarak değiştirilmiş bir suş içerir. Yersinia pestis EV suşu içeren canlı zayıflatılmış aşı veba bağışıklaması için kullanılır. Zayıflatılmış aşıların bazı avantajları ve dezavantajları vardır. Zayıflatılmış aşılar tipik olarak daha dayanıklı immünolojik yanıtlara neden olur. Ancak bağışıklık sistemi baskılanmış bireylerde kullanım için güvenli olmayabilir ve nadir durumlarda virülan bir forma mutasyona uğrayarak hastalığa neden olabilirler.[56]
İnaktif[değiştir | kaynağı değiştir]
Bazı aşılar daha önce virülan olan ancak kimyasallar, ısı veya radyasyonla inaktive edilmiş mikroorganizmalar içerir.[57][58] Örnekler arasında IPV (çocuk felci aşısı), hepatit A aşısı, kuduz aşısı ve çoğu grip aşısı bulunmaktadır.[59]
Toksoit[değiştir | kaynağı değiştir]
Toksoit aşılar, mikroorganizma yerine hastalığa neden olan inaktive edilmiş toksik bileşiklerden yapılır.[60] Toksoit bazlı aşılara örnek olarak tetanos ve difteri verilebilir.[59] Tüm toksoitler mikroorganizmalar için değildir; örneğin Crotalus atrox toksoidi köpekleri çıngıraklı yılan ısırıklarına karşı aşılamak için kullanılır.[61]
Alt ünite[değiştir | kaynağı değiştir]
Bir bağışıklık sistemine inaktive edilmiş veya zayıflatılmış bir mikroorganizma sunmak yerine (ki bu bir "bütün-ajan" aşısı teşkil eder), bir alt ünite aşısı bir bağışıklık yanıtı oluşturmak için onun bir parçasını kullanır. Buna bir örnek, virüsün sadece yüzey proteinlerinden oluşan (daha önce kronik olarak enfekte olmuş hastaların kan serumundan elde edilen, ancak şimdi viral genlerin mayada rekombinasyonu ile üretilen) hepatit B'ye karşı alt ünite aşısıdır.[62] Bir başka örnek, viral majör kapsit proteininden oluşan insan papilloma virüsüne (HPV) karşı virüs benzeri parçacık (VLP) aşısı gibi yenilebilir alg aşılarıdır.[63] Bir başka örnek de influenza virüsünün hemagglutinin ve nöraminidaz alt birimleridir.[59] Veba bağışıklaması için bir alt ünite aşısı kullanılmaktadır.[64]
Konjuge[değiştir | kaynağı değiştir]
Bazı bakteriler, immünojenik açıdan zayıf olan polisakkarit bir dış kaplamaya sahiptir. Bu dış kaplamalar proteinlere (örn. toksinler) bağlanarak, bağışıklık sisteminin polisakkariti bir protein antijeniymiş gibi tanıması sağlanabilir. Bu yaklaşım Haemophilus influenzae tip B aşısında kullanılmaktadır.[65]
Dış zar vezikül[değiştir | kaynağı değiştir]
Dış membran vezikülleri (OMV'ler) doğal olarak immünojeniktir ve güçlü aşılar üretmek için manipüle edilebilir. En iyi bilinen OMV aşıları serotip B meningokok hastalığı için geliştirilenlerdir.[66][67]
Heterotipik[değiştir | kaynağı değiştir]
"Jenner aşıları" olarak da bilinen heterolog aşılar, tedavi edilen organizmada hastalığa neden olmayan ya da hafif hastalığa neden olan diğer hayvanların patojenleri olan aşılardır. Klasik örnek Jenner'ın çiçek hastalığına karşı korunmak için inek çiçeği aşısını kullanmasıdır. Güncel bir örnek ise Mycobacterium bovis'ten yapılan BCG aşısının tüberkülozdan korunmak için kullanılmasıdır.[68]
Genetik aşı[değiştir | kaynağı değiştir]
Genetik aşıların alt grubu viral vektör aşılarını, RNA aşılarını ve DNA aşılarını kapsar.
Viral vektör[değiştir | kaynağı değiştir]
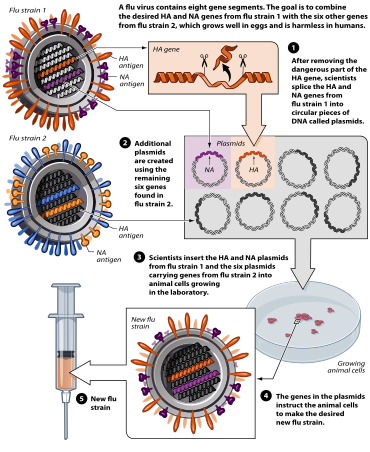
Viral vektör aşıları, bağışıklık tepkisini uyarmak için yüzey proteinleri gibi spesifik antijenler üretmek üzere vücuda patojen genleri yerleştirmek için güvenli bir virüs kullanır.[69][70]
RNA[değiştir | kaynağı değiştir]
Bir mRNA aşısı (veya RNA aşısı), lipid nanopartiküller gibi bir vektör içinde paketlenmiş nükleik asit RNA'dan oluşan yeni bir aşı türüdür.[71] COVID-19 aşıları arasında COVID-19 pandemisiyle mücadele etmek için bir dizi RNA aşısı bulunmaktadır ve bazıları onaylanmış veya bazı ülkelerde acil kullanım izni almıştır. Örneğin, Pfizer-BioNTech aşısı ve Moderna mRNA aşısı ABD'de yetişkinlerde kullanım için onaylanmıştır (Pfizer aşısı 16-17 yaş arası gençler için de tamamen onaylanmıştır).[72][73][74]
DNA[değiştir | kaynağı değiştir]
DNA aşılamasında önerilen mekanizma, viral veya bakteriyel DNA'nın insan veya hayvan hücrelerine yerleştirilmesi ve ifade edilmesi (elektroporasyon kullanımıyla geliştirilmiş) ve bağışıklık sistemi tarafından tanınmasının tetiklenmesidir. İfade edilen proteinleri tanıyan bazı bağışıklık sistemi hücreleri, bu proteinlere ve onları ifade eden hücrelere karşı bir saldırı başlatacaktır. Bu hücreler çok uzun bir süre yaşadıkları için, normalde bu proteinleri ifade eden patojenle daha sonra karşılaşılırsa bağışıklık sistemi tarafından anında saldırıya uğrayacaklardır. DNA aşılarının potansiyel bir avantajı, üretilmelerinin ve saklanmalarının çok kolay olmasıdır.
Ağustos 2021'de Hint yetkililer ZyCoV-D'ye acil onay verdi. Cadila Healthcare tarafından geliştirilen bu aşı, insanlar için onaylanan ilk DNA aşısıdır.
Deneysel[değiştir | kaynağı değiştir]

Birçok yenilikçi aşı da geliştirilmekte ve kullanılmaktadır.
- Dendritik hücre aşıları, antijenleri vücudun beyaz kan hücrelerine sunmak için dendritik hücreleri antijenlerle birleştirir ve böylece bir bağışıklık reaksiyonunu uyarır. Bu aşılar beyin tümörlerinin tedavisinde bazı olumlu ön sonuçlar göstermiştir[75] ve malign melanomda da test edilmektedir.[76]
- Rekombinant vektör - bir mikro organizmanın fizyolojisi ile diğerinin DNA'sı birleştirilerek, karmaşık enfeksiyon süreçlerine sahip hastalıklara karşı bağışıklık oluşturulabilir. Buna bir örnek, 2018 yılında Kongo'da ebola ile mücadele etmek için kullanılmakta olan Merck lisanslı rVSV-ZEBOV aşısıdır.[77]
- T-hücresi reseptörü peptit aşıları, koksidioidomikoz, stomatitis ve atopik dermatit modelleri kullanılarak çeşitli hastalıklar için geliştirilmektedir. Bu peptitlerin sitokin üretimini modüle ettiği ve hücre aracılı bağışıklığı geliştirdiği gösterilmiştir.
- Kompleman inhibisyonunda rol oynayan tanımlanmış bakteriyel proteinlerin hedeflenmesi, temel bakteriyel virülans mekanizmasını etkisiz hale getirecektir.[78]
- Plazmidlerin kullanımı preklinik çalışmalarda kanser ve bulaşıcı hastalıklar için koruyucu bir aşı stratejisi olarak doğrulanmıştır. Ancak, insan çalışmalarında bu yaklaşım klinik olarak anlamlı bir fayda sağlayamamıştır. Plazmid DNA immünizasyonunun genel etkinliği, plazmidin immünojenisitesinin artırılmasına ve aynı zamanda immün efektör hücrelerin spesifik aktivasyonunda rol oynayan faktörlerin düzeltilmesine bağlıdır.[79]
- Bakteriyel vektör - Prensip olarak viral vektör aşılarına benzer, ancak bunun yerine bakteri kullanılır.[66]
- Antijen sunan hücre[66]
Aşıların çoğu mikroorganizmalardan elde edilen inaktive veya zayıflatılmış bileşikler kullanılarak oluşturulurken, sentetik aşılar esas olarak veya tamamen sentetik peptitler, karbonhidratlar veya antijenlerden oluşur.
Diğer aşı türleri[değiştir | kaynağı değiştir]
- Androvax
- MMRV aşısı
- Zoster aşısı
- Meningokok aşısı
- DNA aşısı
- Tüberküloz aşısı
- Şarbon aşısı
- Çürük aşısı
- Çikungunya aşısı
- Sitomegalovirüs aşısı
- Dang aşısı
- Genetik aşı
- Laktobasil aşısı
- Kolera aşısı
- Konjuge aşı
- Leishmaniasis aşısı
- Pnömokok aşısı
- Şistozomiyaz aşısı
- Alt ünite aşı
- Sentetik aşı
- Tifüs aşısı
- Ebola aşısı
- Rotavirüs aşısı
- HPV aşısı
- Hepatit C aşısı
- Çiçek aşısı
- RNA aşısı
- Hepatit B aşısı
- Kanser aşısı
- Sıtma aşısı
- İnaktif aşı
- Bruselloz aşısı
- Zayıflatılmış aşı
- Hantavirüs aşısı
- Veba aşısı
- COVID-19 aşısı
- Tetanos aşısı
- Çocuk felci aşısı
- Moderna COVID-19 aşısı
- Hib aşısı
- Hepatit A aşısı
- Viral vektör aşısı
- Kuduz aşısı
- Pandemrix aşısı
- Suçiçeği aşısı
- Boğmaca aşısı
- Difteri aşısı
- H5N1 aşısı
- Kabakulak aşısı
- Grip aşısı
- KKK aşısı
- Kızamık aşısı
- BCG aşısı
- Kızamıkçık aşısı
Değerlik[değiştir | kaynağı değiştir]
Aşılar tek değerlikli (univalan veya monovalan olarak da adlandırılır) veya çok değerlikli (polivalan veya multivalan olarak da adlandırılır) olabilir. Tek değerlikli aşı, tek bir antijene veya tek bir mikroorganizmaya karşı bağışıklık kazandırmak için tasarlanmıştır.[80] Multivalent veya polivalent aşı ise aynı mikroorganizmanın iki veya daha fazla suşuna veya iki veya daha fazla mikroorganizmaya karşı bağışıklık sağlamak üzere tasarlanmıştır.[81] Çok değerlikli bir aşının değerliği Yunanca veya Latince bir ön ek ile gösterilebilir (örneğin, bivalan, trivalan veya tetravalan/quadrivalan). Bazı durumlarda, tek değerlikli bir aşı hızlı bir şekilde güçlü bir bağışıklık yanıtı geliştirmek için tercih edilebilir.[82]
Etkileşimler[değiştir | kaynağı değiştir]
İki veya daha fazla aşı aynı formülasyonda karıştırıldığında, iki aşı birbiriyle etkileşime girebilir. Bu durum en sık olarak, aşı bileşenlerinden birinin diğerlerinden daha güçlü olduğu ve diğer bileşenlerin büyümesini ve bağışıklık yanıtını baskıladığı canlı zayıflatılmış aşılarda görülür.[83]
Bu fenomen ilk olarak, aşıdaki serotip 2 virüs miktarının, aşıdaki serotip 1 ve 3 virüslerinin "alımına" müdahale etmesini engellemek için azaltılması gereken üç değerlikli Sabin çocuk felci aşısında görülmüştür.[84] Bu fenomenin, DEN-3 serotipinin baskın olduğu ve DEN-1, -2 ve -4 serotiplerine verilen yanıtı baskıladığı tespit edilen,[85] şu anda araştırılmakta olan dang aşılarında da bir sorun olduğu görülmüştür.[ne zaman?]
Diğer içerikler[değiştir | kaynağı değiştir]

Bir aşı dozu, çok azı aktif bileşen olan immünojen olmak üzere birçok bileşen içerir. Tek bir dozda sadece nanogram virüs partikülü veya mikrogram bakteriyel polisakkarit olabilir. Bir aşı enjeksiyonu, oral damla veya burun spreyi çoğunlukla sudur. Bağışıklık yanıtını güçlendirmek, güvenliği sağlamak veya depolamaya yardımcı olmak için diğer bileşenler eklenir ve üretim sürecinden arta kalan çok az miktarda malzeme bulunur. Çok nadiren, bu malzemeler kendilerine karşı çok hassas olan kişilerde alerjik reaksiyona neden olabilir.
Adjuvanlar[değiştir | kaynağı değiştir]
Aşılar tipik olarak bağışıklık tepkisini güçlendirmek için kullanılan bir veya daha fazla adjuvan içerir. Örneğin tetanoz toksoidi genellikle şap üzerine adsorbe edilir. Bu, antijeni basit sulu tetanoz toksoidinden daha büyük bir etki yaratacak şekilde sunar. Adsorbe tetanoz toksoidine karşı ters reaksiyon gösteren kişilere, rapel zamanı geldiğinde basit aşı uygulanabilir.[86]
Tüm hücre boğmaca aşısı, 1990 Basra Körfezi harekâtına hazırlık aşamasında şarbon aşısı için bir adjuvan olarak kullanılmıştır. Bu, sadece şarbon aşısı vermekten daha hızlı bir bağışıklık yanıtı üretir ve maruziyetin yakın olması durumunda bir miktar fayda sağlar.[87]
Koruyucular[değiştir | kaynağı değiştir]
Aşılar ayrıca bakteri veya mantar bulaşmasını önlemek için koruyucu maddeler de içerebilir. Son yıllara kadar, koruyucu tiyomersal (ABD ve Japonya'da Thimerosal olarak da bilinir) canlı virüs içermeyen birçok aşıda kullanılmaktaydı. 2005 yılı itibarıyla, ABD'de eser miktardan daha fazla tiyomersal içeren tek çocukluk aşısı, şu anda yalnızca belirli risk faktörlerine sahip çocuklar için önerilen grip aşısıdır.[88][89] İngiltere'de tedarik edilen tek dozluk grip aşılarının içeriğinde tiyomersal bulunmamaktadır. Koruyucular aşı üretiminin çeşitli aşamalarında kullanılabilir ve en sofistike ölçüm yöntemleri, çevrede ve bir bütün olarak popülasyonda olabileceği gibi, bitmiş üründe de bunların izlerini tespit edebilir.[90]
Birçok aşı, Staphylococcus enfeksiyonu gibi ciddi yan etkileri önlemek için koruyuculara ihtiyaç duyar. 1928'deki bir olayda, koruyucu içermeyen bir difteri aşısı ile aşılanan 21 çocuktan 12'si ölmüştür.[91] Tiyomersal, fenoksietanol ve formaldehit dahil olmak üzere çeşitli koruyucular mevcuttur. Tiyomersal bakterilere karşı daha etkilidir, daha iyi bir raf ömrüne sahiptir ve aşı stabilitesini, gücünü ve güvenliğini artırır; ancak ABD, Avrupa Birliği ve diğer birkaç gelişmiş ülkede, cıva içeriği nedeniyle ihtiyati bir önlem olarak artık çocukluk çağı aşılarında koruyucu olarak kullanılmamaktadır.[92] Tiyomersalin otizme katkıda bulunduğuna dair tartışmalı iddialar ortaya atılmış olsa da bu iddiaları destekleyen ikna edici hiçbir bilimsel kanıt bulunmamaktadır.[93] Ayrıca, 657.461 çocuk üzerinde yapılan 10-11 yıllık bir çalışma, KKK aşısının otizme neden olmadığını ve aslında otizm riskini yüzde yedi oranında azalttığını ortaya koymuştur.[94][95]
Yardımcı maddeler[değiştir | kaynağı değiştir]
Aktif aşının yanı sıra, aşı preparatlarında aşağıdaki yardımcı maddeler ve artık üretim bileşikleri bulunur veya bulunabilir:[96]
- Alüminyum tuzları veya jeller adjuvan olarak eklenir. Adjuvanlar, aşıya karşı daha erken, daha güçlü bir yanıt ve daha kalıcı bir bağışıklık yanıtı sağlamak için eklenir; daha düşük bir aşı dozajına izin verirler.
- Aşının üretimi ve saklanması sırasında bakteri üremesini önlemek için bazı aşılara antibiyotikler eklenir.
- Tavuk yumurtası kullanılarak hazırlandıkları için grip aşısında ve sarı humma aşısında yumurta proteini bulunur. Başka proteinler de mevcut olabilir.
- Formaldehit, toksoit aşılarda bakteriyel ürünleri inaktive etmek için kullanılır. Formaldehit ayrıca istenmeyen virüsleri inaktive etmek ve üretim sırasında aşıyı kontamine edebilecek bakterileri öldürmek için de kullanılır.
- Monosodyum glutamat (MSG) ve 2-fenoksietanol, aşı ısıya, ışığa, asitliğe veya neme maruz kaldığında aşının değişmeden kalmasına yardımcı olmak için birkaç aşıda stabilizatör olarak kullanılır.
- Tiyomersal, potansiyel olarak zararlı bakterilerin kontaminasyonunu ve büyümesini önlemek için birden fazla doz içeren aşı şişelerine eklenen cıva içeren bir antimikrobiyaldir. Tiyomersal ile ilgili tartışmalar nedeniyle, çok kullanımlı grip aşısı hariç çoğu aşıdan çıkarılmış ve tek bir dozun on gram konserve ton balığı yemeye benzer bir seviye olan bir mikrogramdan daha az cıva içerecek seviyelere indirilmiştir.[97]
Adlandırma[değiştir | kaynağı değiştir]
Aşı isimleri için oldukça standartlaşmış çeşitli kısaltmalar geliştirilmiştir, ancak standardizasyon hiçbir şekilde merkezi veya küresel değildir. Örneğin, Amerika Birleşik Devletleri'nde kullanılan aşı isimlerinin, başka yerlerde de yaygın olarak bilinen ve kullanılan köklü kısaltmaları vardır. Bunların sıralanabilir bir tablo halinde sunulan ve serbestçe erişilebilen kapsamlı bir listesi ABD Hastalık Kontrol ve Korunma Merkezleri internet sayfasında mevcuttur.[98] Sayfada şu açıklama yer almaktadır: "Bu tablodaki kısaltmalar (Sütun 3) Hastalık Kontrol ve Korunma Merkezleri personeli, ACIP Çalışma Grupları, Haftalık Morbidite ve Mortalite Raporu (MMWR) editörü, Aşı ile Önlenebilir Hastalıkların Epidemiyolojisi ve Önlenmesi (Pembe Kitap) editörü, ACIP üyeleri ve ACIP irtibat kuruluşları tarafından ortaklaşa standartlaştırılmıştır."[98]
Bazı örnekler difteri ve tetanoz toksoidleri ve aselüler boğmaca aşısı için "DBT", difteri ve tetanoz toksoitleri için "DT" ve tetanoz ve difteri toksoidleri için "Td" şeklindedir. CDC, tetanos aşısı ile ilgili sayfasında ayrıca şu açıklamayı yapmaktadır:[99] "Bu kısaltmalardaki büyük harfler, difteri (D) ve tetanos (T) toksoitleri ile boğmaca (B) aşısının tam dozlarını ifade etmektedir. Küçük harfli "d" ve "b", ergen/yetişkin formülasyonlarında kullanılan azaltılmış difteri ve boğmaca dozlarını ifade etmektedir.[99]
Yerleşik aşı kısaltmalarının bir başka listesi de CDC'nin ABD bağışıklama kayıtlarında kullanılan kısaltmaları içeren "Aşı Kısaltmaları" adlı sayfasındadır.[100]
Lisanslama[değiştir | kaynağı değiştir]
Aşı ruhsatı, geliştirme döngüsünün başarılı bir şekilde sonuçlanmasından ve Aşama I-III'te yer alan klinik çalışmaların ve diğer programların güvenlik, immünoaktivite, belirli bir spesifik dozda immünogenetik güvenlik, hedef popülasyonlar için enfeksiyonu önlemede kanıtlanmış etkinlik ve kalıcı önleyici etkiyi (zaman dayanıklılığı veya yeniden aşılama ihtiyacı tahmin edilmelidir) göstermesinden sonra gerçekleşir.[101] Koruyucu aşılar ağırlıklı olarak sağlıklı nüfus kohortlarında değerlendirildiğinden ve genel nüfusa dağıtıldığından, yüksek bir güvenlik standardı gereklidir.[102] Bir aşının çok uluslu ruhsatlandırılmasının bir parçası olarak, Dünya Sağlık Örgütü Biyolojik Standardizasyon Uzman Komitesi, ulusal düzenleyici kurumların kendi ruhsatlandırma süreçlerine başvurmaları için bir platform olarak tasarlanan bir süreç olan aşıların üretimi ve kalite kontrolü için uluslararası standartlar kılavuzunu geliştirmiştir.[101] Aşı üreticileri, Avrupa İlaç Ajansı (EMA) veya ABD Gıda ve İlaç Dairesi (FDA) gibi çok uluslu veya ulusal bir düzenleyici kuruluş tarafından bilimsel incelemeyi takiben, aşının güvenli ve uzun vadeli etkinliğe sahip olduğunu kanıtlayan eksiksiz bir klinik geliştirme ve deneme döngüsüne kadar ruhsat almazlar.[103][104]
Gelişmekte olan ülkelerin aşı geliştirme ve ruhsatlandırma için DSÖ kılavuzlarını benimsemesinin ardından, her ülkenin ulusal bir ruhsat verme ve aşıyı her ülkede kullanımı boyunca yönetme, dağıtma ve izleme sorumluluğu vardır.[101] Ruhsatlı bir aşının halk arasında güven ve kabul görmesi, aşılama kampanyasının sorunsuz bir şekilde ilerlemesini, hayat kurtarmasını ve ekonomik iyileşmeyi sağlamak için hükûmetlerin ve sağlık personelinin iletişim kurması gereken bir görevdir.[105][106] Bir aşı ruhsatlandırıldığında, değişken üretim, dağıtım ve lojistik faktörler nedeniyle başlangıçta sınırlı tedarikte olacaktır, bu da sınırlı tedarik için bir tahsisat planı ve aşıyı ilk olarak hangi nüfus kesimlerinin almasına öncelik verilmesi gerektiğini gerektirir.[105]
Dünya Sağlık Örgütü[değiştir | kaynağı değiştir]
Birleşmiş Milletler Çocuklara Yardım Fonu (UNICEF) aracılığıyla çok uluslu dağıtım için geliştirilen aşılar, çok sayıda ülke tarafından benimsenmesi için uluslararası kalite, güvenlik, immünojenisite ve etkinlik standartlarını sağlamak üzere DSÖ tarafından ön yeterlilik gerektirir.[101]
Süreç, DSÖ ile anlaşmalı laboratuvarlarda İyi Üretim Uygulamalarına (GMP) uygun üretim tutarlılığı gerektirmektedir.[101] BM kuruluşları aşı ruhsatlandırmasına dahil olduğunda, ülkeler 1) aşı, üreticileri ve dağıtım ortakları için pazarlama izni ve ulusal bir lisans vererek ve 2) aşılama programından sonra advers olayların kayıtları da dahil olmak üzere pazarlama sonrası gözetim gerçekleştirerek işbirliği yaparlar. DSÖ, GMP ve düzenleyici gözetime uygunluk açısından üretim tesislerinin ve distribütörlerin denetimlerini izlemek için ulusal kurumlarla birlikte çalışmaktadır.[101]
Bazı ülkeler EMA, FDA veya diğer zengin ülkelerdeki ulusal ajanslar gibi saygın ulusal kuruluşlar tarafından ruhsatlandırılmış aşıları satın almayı tercih etmektedir, ancak bu tür alımlar genellikle daha pahalıdır ve gelişmekte olan ülkelerdeki yerel koşullara uygun dağıtım kaynaklarına sahip olmayabilir.[101]
Avrupa Birliği[değiştir | kaynağı değiştir]
Avrupa Birliği'nde (AB), mevsimsel grip gibi pandemik patojenlere yönelik aşılar, tüm üye devletlerin uyduğu AB çapında ruhsatlandırılır ("merkezi"), yalnızca bazı üye devletler için ruhsatlandırılır ("merkezi olmayan") veya bireysel ulusal düzeyde ruhsatlandırılır.[103] Genel olarak, tüm AB ülkeleri, Avrupa İlaç Ajansının (EMA) aşı ruhsatından sorumlu bilimsel bir paneli olan Avrupa Beşeri Tıbbi Ürünler Komitesi (CHMP) tarafından tanımlanan düzenleyici rehberliği ve klinik programları takip etmektedir.[103] CHMP, ruhsatlandırma ve dağıtımdan önce ve sonra bir aşının ilerlemesini değerlendiren ve izleyen birkaç uzman grup tarafından desteklenmektedir.[103]
Amerika Birleşik Devletleri[değiştir | kaynağı değiştir]
FDA kapsamında, aşıların klinik güvenliği ve etkinliği için kanıt oluşturma süreci, reçeteli ilaçların onay süreciyle aynıdır.[107] Klinik geliştirme aşamalarında başarılı olunması halinde, aşı ruhsatlandırma sürecini, bilimsel bir inceleme ekibi (doktorlar, istatistikçiler, mikrobiyologlar, kimyagerler gibi farklı disiplinlerden) ve aşı adayının gelişimi boyunca etkinlik ve güvenliğe sahip olduğuna dair kapsamlı belgeler sunması gereken bir biyolojik lisans başvurusu takip eder. Ayrıca bu aşamada, önerilen üretim tesisi GMP uyumluluğu açısından uzman gözden geçiriciler tarafından incelenir ve etiketin, sağlık hizmeti sağlayıcılarının aşının olası riskleri de dahil olmak üzere aşıya özgü kullanım tanımını halka iletmek ve ulaştırmak için uyumlu bir açıklamaya sahip olması gerekir.[107] Ruhsat verildikten sonra, GMP uyumluluğu için periyodik denetimler de dahil olmak üzere aşının ve üretiminin izlenmesi, üretici lisansını koruduğu sürece devam eder ve bu, her aşı üretim aşaması için FDA'ya potens, güvenlik ve saflık testleri için ek sunumları içerebilir.[107]
Hindistan[değiştir | kaynağı değiştir]
Hindistan İlaç Genel Kontrolörü, Hindistan'da aşılar, kan ve kan ürünleri, IV sıvılar ve serumlar gibi belirli ilaç kategorilerinin ruhsatlarının onaylanmasından sorumlu Hindistan Hükûmeti Merkezi İlaç Standart Kontrol Örgütünün daire başkanıdır.[108]
Pazarlama sonrası gözetim[değiştir | kaynağı değiştir]
Bir aşı genel nüfus için kullanılana kadar, aşıdan kaynaklanan tüm potansiyel olumsuz olaylar bilinmeyebilir, bu da üreticilerin aşı halk arasında yaygın olarak kullanılırken pazarlama sonrası gözetim için Faz IV çalışmaları yapmasını gerektirir.[101][107] DSÖ, ruhsatlandırma sonrası gözetimi uygulamak için BM üye devletleriyle birlikte çalışmaktadır.[101] FDA, Amerikan halkında kullanımı boyunca bir aşıyla ilgili güvenlik endişelerini izlemek için bir Aşı Olumsuz Olay Raporlama Sistemine güvenmektedir.[107]
Takvimleme[değiştir | kaynağı değiştir]

En iyi korumayı sağlamak için, çocukların bağışıklık sistemleri belirli aşılara yanıt verecek kadar gelişir gelişmez aşı olmaları tavsiye edilir ve "tam bağışıklık" elde etmek için genellikle ek "güçlendirici" aşılar gerekir. Bu durum, karmaşık aşılama programlarının geliştirilmesine yol açmıştır. Küresel aşı takvimi önerileri Stratejik Uzmanlar Danışma Grubu tarafından yayınlanır ve hastalık epidemiyolojisi, aşılamanın kabul edilebilirliği, yerel popülasyonlarda eşitlik ve programatik ve finansal kısıtlamalar gibi yerel faktörler göz önünde bulundurularak ülke düzeyinde danışma komitesi tarafından daha da aktarılır.[109] Amerika Birleşik Devletleri'nde, Hastalık Kontrol ve Korunma Merkezleri için program eklemeleri öneren Bağışıklama Uygulamaları Danışma Komitesi, çocukların hepatit A, hepatit B, çocuk felci, kabakulak, kızamık, kızamıkçık, difteri, boğmaca, tetanos, HiB, suçiçeği, rotavirüs, grip, meningokok hastalığı ve zatürreye karşı rutin aşılanmasını önermektedir.[110][111]
Önerilen çok sayıda aşı ve takviye (iki yaşında 24 enjeksiyona kadar) tam uyumun sağlanmasında sorunlara yol açmıştır. Azalan uyum oranlarıyla mücadele etmek için çeşitli bildirim sistemleri oluşturulmuş ve artık birden fazla hastalığa karşı koruma sağlayan birçok karma enjeksiyon (örneğin Pentavalan aşı ve KKKV aşısı) piyasaya sürülmüştür.
Bebek aşıları ve takviyeleri için önerilerin yanı sıra, diğer yaşlar için veya yaşam boyunca tekrarlanan enjeksiyonlar için birçok spesifik aşı önerilir - en yaygın olarak kızamık, tetanoz, grip ve zatürre için. Hamile kadınlar genellikle kızamıkçığa karşı direncin devam edip etmediği konusunda taranmaktadır. İnsan papilloma virüsü aşısı ABD'de (2011 itibarıyla)[112] ve Birleşik Krallık'ta (2009 itibarıyla) önerilmektedir.[113] Yaşlılar için aşı önerileri, bu grup için daha ölümcül olan zatürre ve influenza üzerinde yoğunlaşmaktadır. 2006 yılında, suçiçeği virüsünün neden olduğu bir hastalık olan ve genellikle yaşlıları etkileyen zonaya karşı bir aşı piyasaya sürülmüştür.[114]
Bir aşının zamanlaması ve dozu, bir bireyin bağışıklık yeterlilik düzeyine göre[115] ve örneğin bir pandemi ortamında arzın sınırlı olduğu durumlarda bir aşının nüfus genelinde uygulanmasını optimize etmek için uyarlanabilir.[116]
Kalkınma ekonomisi[değiştir | kaynağı değiştir]
Aşı geliştirmede karşılaşılan zorluklardan biri de ekonomidir: HIV, sıtma ve tüberküloz dahil olmak üzere aşıya en çok ihtiyaç duyulan hastalıkların birçoğu esas olarak yoksul ülkelerde görülmektedir. İlaç firmaları ve biyoteknoloji şirketlerinin bu hastalıklar için aşı geliştirme konusunda çok az teşviki var çünkü gelir potansiyeli çok az. Daha varlıklı ülkelerde bile, finansal getiriler genellikle asgari düzeydedir ve finansal ve diğer riskler büyüktür.[117]
Bugüne kadarki aşı geliştirme çalışmalarının çoğu hükûmet, üniversiteler ve kâr amacı gütmeyen kuruluşlar tarafından sağlanan "itme" fonlarına dayanmaktadır.[118] Birçok aşı son derece uygun maliyetli ve halk sağlığı için faydalı olmuştur.[119] Gerçekte uygulanan aşıların sayısı son yıllarda önemli ölçüde artmıştır.[120] Bu artış, özellikle de çocuklara okula başlamadan önce uygulanan farklı aşıların sayısındaki artış, ekonomik teşvikten ziyade hükûmet zorunlulukları ve desteğinden kaynaklanıyor olabilir.[121]
Patentler[değiştir | kaynağı değiştir]
Dünya Sağlık Örgütüne göre, az gelişmiş ülkelerde aşı üretiminin önündeki en büyük engel patentler değil, pazara giriş için gereken önemli finansal, altyapı ve işgücü gereksinimleri olmuştur. Aşılar biyolojik bileşiklerin karmaşık karışımlarıdır ve reçeteli ilaçların aksine, gerçek jenerik aşılar yoktur. Yeni bir tesis tarafından üretilen aşı, üretici tarafından güvenlik ve etkinlik açısından eksiksiz klinik testlerden geçirilmelidir. Çoğu aşı için, teknolojideki belirli süreçler patentlidir. Bunlar alternatif üretim yöntemleriyle aşılabilir, ancak bu Ar-Ge altyapısı ve uygun vasıflı işgücü gerektirir. İnsan papilloma virüsü aşısı gibi nispeten yeni birkaç aşı söz konusu olduğunda, patentler ek bir engel oluşturabilir.[122]
2021'deki COVID-19 pandemisi sırasında aşı üretiminin artırılmasına acilen ihtiyaç duyulduğunda, Dünya Ticaret Örgütü ve dünyanın dört bir yanındaki hükûmetler, COVID-19 aşıları üzerindeki fikri mülkiyet hakları ve patentlerden feragat edilip edilmeyeceğini değerlendirdi; bu da "aşılar ve ilaçlar da dahil olmak üzere uygun fiyatlı COVID-19 tıbbi ürünlerinin zamanında sunulmasının önündeki tüm potansiyel engelleri ortadan kaldıracak ve temel tıbbi ürünlerin üretimini ve tedarikini artıracaktı".[123]
Üretim[değiştir | kaynağı değiştir]

Aşı üretimi, normal ilaç üretimi de dahil olmak üzere diğer üretim türlerinden temelde farklıdır, çünkü aşıların büyük çoğunluğu tamamen sağlıklı olan milyonlarca insana uygulanması amaçlanmaktadır.[124] Bu gerçek, diğer ürünler için gerekli olanın çok ötesine geçen katı uyumluluk gereklilikleri ile olağanüstü titiz bir üretim sürecini yönlendirir.[124]
Antijene bağlı olarak, son derece uzmanlaşmış ekipman, temiz odalar ve muhafaza odaları gerektiren bir aşı üretim tesisi kurmak 50 ile 500 milyon ABD dolarına mal olabilir.[125] Aşı üretim hatlarında çalışacak doğru beceri, uzmanlık, bilgi, yetkinlik ve kişilik kombinasyonuna sahip personel konusunda küresel bir kıtlık söz konusudur.[125] Brezilya, Çin ve Hindistan gibi önemli istisnalar dışında, gelişmekte olan ülkelerin çoğunun eğitim sistemleri yeterli sayıda kalifiye aday sağlayamamakta ve bu ülkelerde yerleşik aşı üreticileri, üretimi devam ettirebilmek için yabancı uyruklu personel istihdam etmek zorunda kalmaktadır.[125]
Aşı üretiminin birkaç aşaması vardır. İlk olarak antijenin kendisi üretilir. Virüsler ya tavuk yumurtası gibi birincil hücrelerde (örneğin influenza için) ya da kültürlenmiş insan hücreleri gibi sürekli hücre hatlarında (örneğin hepatit A için) yetiştirilir.[126] Bakteriler biyoreaktörlerde yetiştirilir (örneğin Haemophilus influenzae tip b). Benzer şekilde, virüslerden veya bakterilerden türetilen bir rekombinant protein maya, bakteri veya hücre kültürlerinde üretilebilir.[127][128]
Antijen üretildikten sonra, onu üretmek için kullanılan hücrelerden izole edilir. Bir virüsün inaktive edilmesi gerekebilir, muhtemelen daha fazla saflaştırma gerekmez. Rekombinant proteinler, ultrafiltrasyon ve kolon kromatografisini içeren birçok işleme ihtiyaç duyar. Son olarak, aşı gerektiğinde adjuvan, stabilizatörler ve koruyucular eklenerek formüle edilir. Adjuvan antijene karşı bağışıklık tepkisini artırır, stabilizatörler saklama ömrünü uzatır ve koruyucular çok dozlu flakonların kullanımına izin verir.[127][128] Kombine aşıların geliştirilmesi ve üretilmesi, antijenler ve diğer bileşenler arasındaki potansiyel uyumsuzluklar ve etkileşimler nedeniyle daha zordur.[129]
Aşı üretiminde dağıtımdan önceki son aşama, flakonların aşılarla doldurulması ve dağıtım için paketlenmesi işlemi olan doldur ve bitir aşamasıdır. Bu aşı üretim sürecinin kavramsal olarak basit bir parçası olmasına rağmen, aşıların dağıtımı ve uygulanması sürecinde genellikle bir darboğaz oluşturmaktadır.[130][131][132]
Aşı üretim teknikleri gelişmektedir. Kültürlenmiş memeli hücrelerinin, tavuk yumurtası gibi geleneksel seçeneklere kıyasla, daha fazla üretkenlik ve kontaminasyonla ilgili sorunların düşük insidansı nedeniyle giderek daha önemli hale gelmesi beklenmektedir. Toksoit kullanan bakteriyel aşıların üretimi için genetik olarak detoksifiye edilmiş aşılar üreten rekombinasyon teknolojisinin popülaritesinin artması beklenmektedir. Kombinasyon aşılarının, patojenle ilişkili moleküler kalıpları kullanarak içerdikleri antijen miktarlarını azaltmaları ve böylece istenmeyen etkileşimleri azaltmaları beklenmektedir.[129]
Aşı üreticileri[değiştir | kaynağı değiştir]
Aşı üretiminde en yüksek pazar payına sahip şirketler Merck, Sanofi, GlaxoSmithKline, Pfizer ve Novartis olup aşı satışlarının %70'i AB veya ABD'de yoğunlaşmıştır (2013).[133]:42 Aşı üretim tesisleri büyük sermaye yatırımları gerektirir (50 milyon dolardan 300 milyon dolara kadar) ve inşa edilmesi 4 ile 6 yıl arası sürebilir; aşı geliştirme sürecinin tamamı ise 10 ile 15 yıl arası sürer. [133]:43 Gelişmekte olan ülkelerdeki üretim, bu ülkelerin tedarikinde giderek artan bir rol oynamaktadır. Özellikle de eski aşılarla ilgili olarak Brezilya, Hindistan ve Çin'de. [133]:47 Hindistan'daki üreticiler gelişmekte olan dünyanın en gelişmiş üreticileridir ve doz sayısı bakımından en büyük aşı üreticilerinden biri olan ve yakın zamanda tavuk yumurtası yerine MRC-5 hücre kültürüne geçerek kızamık aşısı üretim verimliliğini 10 ila 20 kat artıran süreçlerde yenilikçi olan Hindistan Serum Enstitüsünü de içermektedir.[133]:48 Çin'in üretim kabiliyetleri kendi iç ihtiyaçlarını karşılamaya odaklanmıştır ve Sinopharm (CNPGC) tek başına Çin'deki 14 farklı aşı için dozların %85'inden fazlasını sağlamaktadır.[133]:48 Brezilya, gelişmiş dünyadan transfer edilen teknolojiyi kullanarak kendi iç ihtiyaçlarını karşılama noktasına yaklaşmaktadır.[133]:49
Uygulama sistemleri[değiştir | kaynağı değiştir]

Aşıların insan vücuduna verilmesinde kullanılan en yaygın yöntemlerden biri enjeksiyondur.
Yeni uygulama sistemlerinin geliştirilmesi, daha güvenli ve daha etkili aşıların üretilmesi ve uygulanması umudunu artırmaktadır. Araştırma alanları arasında lipozomlar ve ISCOM (bağışıklık uyarıcı kompleks) bulunmaktadır.[134]
Aşı uygulama teknolojilerindeki kayda değer gelişmeler arasında oral aşılar da yer almaktadır. Oral aşıların uygulanmasına yönelik ilk girişimler, etkili bir oral antibakteriyel aşı olasılığının tartışmalı olduğu bir dönem olan 20. yüzyılın başlarından itibaren çeşitli derecelerde umut vadetmiştir.[135] Örneğin 1930'lara gelindiğinde, oral tifo aşısının profilaktik değerine yönelik artan bir ilgi vardı.[136]
Oral çocuk felci aşısının, aşılar resmi eğitim almamış gönüllü personel tarafından uygulandığında da etkili olduğu ortaya çıkmıştır; sonuçlar ayrıca aşıların uygulanmasının daha kolay ve verimli olduğunu göstermiştir. Etkili oral aşıların birçok avantajı vardır; örneğin, kan bulaşma riski yoktur. Oral uygulama için tasarlanan aşıların sıvı olması gerekmez ve katı olduklarından genellikle daha stabildirler ve taşıma ve depolama sırasında donarak hasar görmeye veya bozulmaya daha az eğilimlidirler.[137] Bu tür bir stabilite "soğuk zincir" ihtiyacını azaltır.
Henüz geliştirme aşamasında olan mikroiğne yaklaşımı, "deri yoluyla aşı iletim yolları oluşturabilecek diziler halinde imal edilmiş sivri çıkıntılar" kullanmaktadır.[138]
Deneysel bir iğnesiz[139] aşı uygulama sistemi hayvanlar üzerinde test ediliyor.[140][141] Yapışkan bir bandaja benzeyen pul büyüklüğünde bir yama, cm kare başına yaklaşık 20.000 mikroskobik çıkıntı içermektedir.[142] Bu dermal uygulama, enjeksiyondan daha az aşı gerektirirken aşılamanın etkinliğini potansiyel olarak artırmaktadır.[143]
Veterinerlik tıbbında[değiştir | kaynağı değiştir]

Hayvanların aşılanması hem onların hastalıklara yakalanmasını önlemek hem de hastalıkların insanlara bulaşmasını engellemek için kullanılır.[144] Hem evcil hayvan olarak tutulan hem de çiftlik hayvanı olarak yetiştirilen hayvanlar rutin olarak aşılanmaktadır. Bazı durumlarda vahşi popülasyonlar da aşılanabilir. Bu bazen hastalık eğilimli bir bölgede yayılan aşılı yiyeceklerle gerçekleştirilir ve rakunlarda kuduzu kontrol etmeye çalışmak için kullanılmıştır.
Kuduz hastalığının görüldüğü yerlerde, köpeklere kuduz aşısı yapılması kanunen zorunlu olabilir. Diğer köpek aşıları arasında köpek gençlik hastalığı, köpek parvovirüsü, bulaşıcı köpek hepatiti, adenovirüs-2, leptospiroz, Bordetella, köpek parainfluenza virüsü ve Lyme hastalığı bulunmaktadır.
İnsanlarda veteriner aşılarının kullanıldığı vakalar, kasıtlı veya kazara olsun, sonuçta ortaya çıkan bazı hastalık vakalarıyla, özellikle bruselloz ile belgelenmiştir.[145] Bununla birlikte, bu tür vakaların raporlanması nadirdir ve bu tür uygulamaların güvenliği ve sonuçları hakkında çok az çalışma yapılmıştır. Veteriner kliniklerinde aerosol aşılamanın ortaya çıkmasıyla birlikte, Bordetella bronchiseptica gibi insanlarda doğal olarak taşınmayan patojenlere insanların maruz kalması son yıllarda muhtemelen artmıştır.[145] Kuduz başta olmak üzere bazı durumlarda, bir patojene karşı paralel veteriner aşısı, insan aşısından çok daha ekonomik olabilir.
DIVA aşıları[değiştir | kaynağı değiştir]
SIVA (Segregation of Infected from Vaccinated Animals [Enfekte Hayvanların Aşılanmış Hayvanlardan Ayrılması]) olarak da bilinen DIVA (Differentiation of Infected from Vaccinated Animals [Enfekte Hayvanların Aşılanmış Hayvanlardan Ayırt Edilmesi]) aşıları, enfekte ve aşılanmış hayvanlar arasında ayrım yapılmasını mümkün kılar. DIVA aşıları, eşdeğer yabani mikroorganizmadan en az bir epitop daha az taşır. Bu epitopa karşı antikoru tespit eden eşlik eden bir tanı testi, hayvanın aşılanmış olup olmadığının belirlenmesine yardımcı olur.[kaynak belirtilmeli]
İlk DIVA aşıları (eski adıyla işaretleyici aşılar ve 1999'dan beri DIVA aşıları olarak adlandırılmaktadır) ve refakatçi tanı testleri, Hollanda'nın Lelystad kentindeki Merkez Veteriner Enstitüsü'nde J. T. van Oirschot ve meslektaşları tarafından geliştirilmiştir.[146][147] Sahte kuduza (Aujeszky hastalığı olarak da adlandırılır) karşı mevcut bazı aşıların viral genomlarında (aralarında gE geni de bulunan) delesyonlar olduğunu buldular. Bu delesyona karşı monoklonal antikorlar üretildi ve gE'ye karşı antikorları gösteren bir ELISA geliştirmek için seçildi. Buna ek olarak, genetik olarak tasarlanmış yeni gE-negatif aşılar yapılmıştır.[148] Aynı doğrultuda, sığır herpesvirüs 1 enfeksiyonlarına karşı DIVA aşıları ve eşlik eden tanı testleri geliştirilmiştir.[147][149]
DIVA stratejisi, çeşitli ülkelerde sahte kuduz virüsünü bu ülkelerden başarıyla yok etmek için uygulanmıştır. Domuz popülasyonları yoğun bir şekilde aşılanmış ve refakatçi tanı testi ile izlenmiş ve daha sonra enfekte domuzlar popülasyondan uzaklaştırılmıştır.[kaynak belirtilmeli] Bovine herpesvirus 1 DIVA aşıları da uygulamada yaygın olarak kullanılmaktadır. DIVA prensibini klasik domuz ateşi,[150] kuş gribi,[151] Actinobacillus pleuropneumonia[152] ve domuzlarda Salmonella enfeksiyonları[153] gibi çok çeşitli bulaşıcı hastalıklara uygulamak için önemli çabalar devam etmektedir.
Tarihçe[değiştir | kaynağı değiştir]

Sığır çiçeği vakalarından elde edilen materyalle aşılamanın (heterotipik bağışıklama) kullanılmaya başlanmasından önce, çiçek hastalığı çiçek virüsü ile kasıtlı variolasyon yoluyla önlenebiliyordu. Çin'de çiçek hastalığı için variolasyon uygulamasına dair en eski ipuçları onuncu yüzyılda ortaya çıkmıştır.[154][daha geniş açıklama gerekli] Çinliler ayrıca on beşinci yüzyıla kadar uzanan, belgelenmiş en eski variolasyon kullanımını da uygulamışlardır. Toz haline getirilmiş çiçek hastalığı materyalinin - genellikle kabukların - burun deliklerine üflenmesiyle uygulanan bir "nazal insüflasyon" yöntemi uygulamışlardır. Çin'de on altıncı ve on yedinci yüzyıllar boyunca çeşitli aşılama teknikleri kaydedilmiştir.[155]:60 1700 yılında Londra'daki Royal Society'ye Çin'deki inokülasyon uygulamasına ilişkin iki rapor ulaşmıştır; bunlardan biri Çin'de görev yapan Doğu Hindistan Şirketi'nin bir çalışanından rapor alan Martin Lister tarafından, diğeri ise Clopton Havers tarafından hazırlanmıştır.[156] Fransa'da Voltaire, Çinlilerin "bu yüzyıldır" variolasyon uyguladıklarını bildirir.[157]

Osmanlı'da variolasyona tanık olan Mary Wortley Montagu, 1721 yılında İngiltere'ye döndüğünde dört yaşındaki kızına Kraliyet Sarayı doktorlarının huzurunda variolasyon uygulatmıştır.[155] Aynı yılın ilerleyen günlerinde Charles Maitland, Londra'daki Newgate Hapishanesi'nde altı mahkum üzerinde deneysel bir variolasyon gerçekleştirdi.[158] Deney başarılı oldu ve kısa süre sonra variolasyon, prosedürün teşvik edilmesine yardımcı olan kraliyet ailesinin dikkatini çekti. Ancak 1783 yılında, Büyük Britanya Prensi Octavius inolükalasyondan birkaç gün sonra öldü.[159] 1796'da doktor Edward Jenner, sığır çiçeği olan bir sütçünün elinden irin alarak 8 yaşındaki James Phipps adlı bir çocuğun koluna kazıdı ve altı hafta sonra çocuğa çiçek hastalığı variolasyonu yaptı ve daha sonra çocuğun çiçek hastalığına yakalanmadığını gözlemledi.[160][161] Jenner çalışmalarını genişletti ve 1798'de aşısının çocuklarda ve yetişkinlerde güvenli olduğunu ve koldan kola aktarılabildiğini, böylece enfekte ineklerden elde edilen belirsiz kaynaklara olan bağımlılığı azalttığını bildirdi.[159] 1804 yılında İspanya'nın Meksika ve Filipinler'deki kolonilerine çiçek aşısı yapmak üzere yola çıkan İspanyol Balmis ekibi, aşının in vitro ortamda sadece 12 gün hayatta kalabilmesini aşmak için koldan kola nakil yöntemini kullandı. Sığır çiçeği kullandılar.[162] Sığır çiçeği ile aşılama çiçek inokülasyonundan çok daha güvenli olduğu için,[163] İngiltere'de hala yaygın olarak uygulanmasına rağmen, 1840 yılında yasaklandı.[164]

Jenner'in çalışmalarını takiben, ikinci nesil aşılar 1880'lerde Louis Pasteur tarafından tavuk kolerası ve şarbon için geliştirilen aşılarla tanıtıldı[17] ve on dokuzuncu yüzyılın sonlarından itibaren aşılar ulusal bir prestij meselesi olarak kabul edildi. Ulusal aşılama politikaları benimsendi ve zorunlu aşı yasaları çıkarıldı.[160] 1931 yılında Alice Miles Woodruff ve Ernest Goodpasture, kanatlı çiçeği hastalığı virüsünün embriyonlaşmış tavuk yumurtasında yetiştirilebileceğini belgeledi. Kısa süre sonra bilim insanları yumurtalarda başka virüsler de yetiştirmeye başladılar. Yumurtalar, 1935'te sarı humma aşısının ve 1945'te grip aşısının geliştirilmesinde virüs çoğaltımı için kullanıldı. 1959'da besiyeri ve hücre kültürü, aşılar için standart virüs çoğaltma yöntemi olarak yumurtaların yerini aldı.[165]
Aşı bilimi yirminci yüzyılda gelişti ve difteri, kızamık, kabakulak ve kızamıkçığa karşı olanlar da dahil olmak üzere birçok başarılı aşı ortaya çıktı. Başlıca başarılar arasında 1950'lerde çocuk felci aşısının geliştirilmesi ve 1960'lar ve 1970'lerde çiçek hastalığının ortadan kaldırılması yer almaktadır. Maurice Hilleman yirminci yüzyılda aşı geliştirenler arasında en üretken olanıydı. Aşılar daha yaygın hale geldikçe, birçok insan aşıları kanıksamaya başladı. Ancak, herpes simpleks, sıtma, belsoğukluğu ve HIV gibi birçok önemli hastalık için aşı bulmak hâlâ zor.[160][166]
Aşı nesilleri[değiştir | kaynağı değiştir]

Birinci nesil aşılar, canlı ve zayıflatılmış ya da öldürülmüş formları olan tüm organizma aşılarıdır.[167] Çiçek ve çocuk felci aşıları gibi canlı, zayıflatılmış aşılar, öldürücü T-hücresi (TC veya CTL) yanıtlarını, yardımcı T hücresi (TH) yanıtlarını ve antikor bağışıklığını indükleyebilir. Bununla birlikte, bir patojenin zayıflatılmış formları tehlikeli bir forma dönüşebilir ve bağışıklık sistemi baskılanmış aşı alıcılarında (AIDS'liler gibi) hastalığa neden olabilir. Öldürülmüş aşılar bu riske sahip olmamakla birlikte, spesifik öldürücü T hücre yanıtları oluşturamazlar ve bazı hastalıklar için hiç işe yaramayabilirler.[167]
Canlı aşılardan kaynaklanan riskleri azaltmak için ikinci nesil aşılar geliştirilmiştir. Bunlar spesifik protein antijenlerinden (tetanos veya difteri toksoidi gibi) veya rekombinant protein bileşenlerinden (hepatit B yüzey antijeni gibi) oluşan alt birim aşılardır. TH ve antikor yanıtları oluşturabilirler, ancak öldürücü T hücresi yanıtları oluşturamazlar.[kaynak belirtilmeli]
RNA aşıları ve DNA aşıları üçüncü nesil aşılara örnektir.[167][168][169] 2016 yılında Zika virüsü için bir DNA aşısı Ulusal Sağlık Enstitülerinde test edilmeye başlanmıştır. Ayrı olarak Inovio Pharmaceuticals ve GeneOne Life Science, Miami'de Zika'ya karşı farklı bir DNA aşısının testlerine başladı. Aşıların hacimli üretimi 2016 yılı itibarıyla çözülememiştir.[170] HIV'i önlemeye yönelik DNA aşıları için klinik denemeler devam etmektedir.[171] 2020 yılında Warp Speed Operasyonu'nun yardımıyla BNT162b2 gibi mRNA aşıları geliştirilmiş ve COVID-19 pandemisiyle mücadele etmek için kitlesel olarak konuşlandırılmıştır. 2021 yılında Katalin Karikó ve Drew Weissman, mRNA aşı teknolojisindeki öncü araştırmaları nedeniyle Columbia Üniversitesinin Horwitz Ödülü'nü aldı.[172]
Trendler[değiştir | kaynağı değiştir]
Bu bölümün daha doğru ve güvenilir bilgi sunması için güncellenmesi gerekmektedir. Daha fazla bilgi için tartışma sayfasına bakınız. (Nisan 2023) |
Bilim insanları en azından 2013 yılından bu yana, bir virüsün dış yapısını yeniden yapılandırarak sentetik üçüncü nesil aşılar geliştirmeye çalışmaktadır; bunun aşı direncini önlemeye yardımcı olacağı umulmaktadır.[173]
Bağışıklık tepkisini yöneten ilkeler artık kanserler ve otoimmün bozukluklar gibi bulaşıcı olmayan birçok insan hastalığına karşı kişiye özel aşılarda kullanılabilmektedir.[174] Örneğin, deneysel aşı CYT006-AngQb, yüksek tansiyon için olası bir tedavi olarak araştırılmaktadır.[175] Aşı geliştirme eğilimlerini etkileyen faktörler arasında çevirici tıp alanındaki ilerlemeler, demografi, düzenleyici bilim, siyasi, kültürel ve sosyal tepkiler yer almaktadır.[176]
Aşı üretimi için biyoreaktör olarak bitkiler[değiştir | kaynağı değiştir]
Transgenik bitkiler yoluyla aşı üretimi fikri 2003 gibi erken bir tarihte tanımlanmıştır. Tütün, patates, domates ve muz gibi bitkilere, insanlar için kullanılabilir aşılar üretmelerine neden olacak genler yerleştirilebilir.[177] 2005 yılında, hepatit B'ye karşı insan aşısı üreten muzlar geliştirilmiştir.[178]
Aşı karşıtlığı[değiştir | kaynağı değiştir]
Aşı karşıtlığı, aşı hizmetlerinin mevcut olmasına rağmen aşıların kabulünde gecikme veya aşıların reddedilmesidir. Bu terim, aşılamayı açıkça reddetmeyi, aşıları ertelemeyi, aşıları kabul etmeyi ancak kullanımları konusunda kararsız kalmayı veya bazı aşıları kullanıp diğerlerini kullanmamayı kapsar.[179][180][181][182] Aşıların genel olarak güvenli ve etkili olduğu konusunda büyük bir bilimsel fikir birliği vardır.[183][184][185][186] Aşı karşıtlığı genellikle hastalık salgınlarına ve aşıyla önlenebilir hastalıklardan kaynaklanan ölümlere neden olmaktadır.[187][188][189][190][191][192] Bu nedenle Dünya Sağlık Örgütü aşı karşıtlığını 2019'da en önemli on küresel sağlık tehdidinden biri olarak nitelendirmiştir.[193][194]
Ayrıca bakınız[değiştir | kaynağı değiştir]
- Aşıların zaman çizelgesi
- Aşı karşıtlığı
- Viral vektör
- Aşı içerikleri
- İntravenöz tedavi
- Profilaksi
- Epidemiyoloji
- Epidemi
- Pandemi
- İntramüsküler enjeksiyon
- İntradermal enjeksiyon
Kaynakça[değiştir | kaynağı değiştir]
- ^ "Expanded Practice Standards" (PDF). Iowa Administrative Code. 2019. 19 Ocak 2023 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 18 Nisan 2023.
- ^ "Immunization: The Basics". Centers for Disease Control and Prevention. 22 Kasım 2022. 12 Temmuz 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Temmuz 2023.
- ^ Amanna, Ian J.; Slifka, Mark K. (2018). "Successful Vaccines". Current Topics in Microbiology and Immunology. Plant Disease. 428. Springer International Publishing. ss. 1-30. doi:10.1007/82_2018_102. eISSN 2196-9965. ISBN 978-3-030-58003-2. ISSN 0070-217X. PMC 6777997 $2. PMID 34129355.
The effect of vaccines on public health is truly remarkable. One study examining the impact of childhood vaccination on the 2001 US birth cohort found that vaccines prevented 33,000 deaths and 14 million cases of disease (Zhou et al. 2005). Among 73 nations supported by the GAVI alliance, mathematical models project that vaccines will prevent 23.3 million deaths from 2011–2020 compared to what would have occurred if there were no vaccines available (Lee et al. 2013). Vaccines have been developed against a wide assortment of human pathogens.
- ^ Zimmer, Carl (20 Kasım 2020). "2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works". The New York Times. 22 Kasım 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Kasım 2020.
- ^ Melief CJ, van Hall T, Arens R, Ossendorp F, van der Burg SH (September 2015). "Therapeutic cancer vaccines". The Journal of Clinical Investigation. 125 (9): 3401-3412. doi:10.1172/JCI80009. PMC 4588240 $2. PMID 26214521.
- ^ Bol KF, Aarntzen EH, Pots JM, Olde Nordkamp MA, van de Rakt MW, Scharenborg NM, de Boer AJ, van Oorschot TG, Croockewit SA, Blokx WA, Oyen WJ, Boerman OC, Mus RD, van Rossum MM, van der Graaf CA, Punt CJ, Adema GJ, Figdor CG, de Vries IJ, Schreibelt G (March 2016). "Prophylactic vaccines are potent activators of monocyte-derived dendritic cells and drive effective anti-tumor responses in melanoma patients at the cost of toxicity". Cancer Immunology, Immunotherapy. 65 (3): 327-339. doi:10.1007/s00262-016-1796-7. PMC 4779136 $2. PMID 26861670.
- ^ Brotherton J (2015). "HPV prophylactic vaccines: lessons learned from 10 years experience". Future Virology. 10 (8): 999-1009. doi:10.2217/fvl.15.60.
- ^ Frazer IH (May 2014). "Development and implementation of papillomavirus prophylactic vaccines". Journal of Immunology. 192 (9): 4007-4011. doi:10.4049/jimmunol.1490012. PMID 24748633.
- ^ Ledford, Heidi (17 Ağustos 2020). "What the immune response to the coronavirus says about the prospects for a vaccine". Nature (İngilizce). 585 (7823): 20-21. Bibcode:2020Natur.585...20L. doi:10.1038/d41586-020-02400-7. PMID 32811981.
- ^ United States Centers for Disease Control and Prevention (2011). A CDC framework for preventing infectious diseases. 29 Ağustos 2017 tarihinde Wayback Machine sitesinde arşivlendi. Accessed 11 September 2012. "Vaccines are our most effective and cost-saving tools for disease prevention, preventing untold suffering and saving tens of thousands of lives and billions of dollars in healthcare costs each year."
- ^ "Global Vaccine Action Plan". www.who.int (İngilizce). 24 Ocak 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Nisan 2023.
- ^ Williams 2010, s. 60.
- ^ Lombard M, Pastoret PP, Moulin AM (April 2007). "A brief history of vaccines and vaccination". Revue Scientifique et Technique. 26 (1): 29-48. doi:10.20506/rst.26.1.1724. PMID 17633292.
- ^ Behbehani AM (December 1983). "The smallpox story: life and death of an old disease". Microbiological Reviews. 47 (4): 455-509. doi:10.1128/MMBR.47.4.455-509.1983. PMC 281588 $2. PMID 6319980.
- ^ Ferguson, Donna (28 Mart 2021). "How Mary Wortley Montagu's bold experiment led to smallpox vaccine – 75 years before Jenner". the Guardian. 11 Temmuz 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Temmuz 2022.
- ^ Baxby D (January 1999). "Edward Jenner's Inquiry; a bicentenary analysis". Vaccine. 17 (4): 301-307. doi:10.1016/s0264-410x(98)00207-2. PMID 9987167.
- ^ a b Pasteur, Louis (1881). "Address on the Germ Theory". Lancet. 118 (3024): 271-272. doi:10.1016/s0140-6736(02)35739-8.
- ^ "Measles Vaccination CDC". 5 Şubat 2018. 19 Kasım 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ Orenstein WA, Bernier RH, Dondero TJ, Hinman AR, Marks JS, Bart KJ, Sirotkin B (1985). "Field evaluation of vaccine efficacy". Bulletin of the World Health Organization. 63 (6): 1055-1068. PMC 2536484 $2. PMID 3879673.
- ^ Jan 11, Hub staff report / Published; 2017 (11 Ocak 2017). "The science is clear: Vaccines are safe, effective, and do not cause autism". The Hub. 28 Eylül 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Nisan 2019.
- ^ Ellenberg SS, Chen RT (1997). "The complicated task of monitoring vaccine safety". Public Health Reports. 112 (1): 10-20; discussion 21. PMC 1381831 $2. PMID 9018282.
- ^ "Vaccine Safety: The Facts". HealthyChildren.org. 16 Nisan 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Nisan 2019.
- ^ Mak, Tak W.; Saunders, Mary E.; Jett, Bradley D. (2014). "Chapter 1 - Introduction to the Immune Response". Primer to The immune response (İngilizce) (2. bas.). Burlington, MA: Academic Cell. ss. 3-20. ISBN 978-0-12-385245-8. Erişim tarihi: 18 Nisan 2022.
- ^ Clem, Angela S (2011). "Fundamentals of Vaccine Immunology". Journal of Global Infectious Diseases. 3 (1): 73-78. doi:10.4103/0974-777X.77299. ISSN 0974-777X. PMC 3068582 $2. PMID 21572612.
- ^ Grammatikos AP, Mantadakis E, Falagas ME (June 2009). "Meta-analyses on pediatric infections and vaccines". Infectious Disease Clinics of North America. 23 (2): 431-457. doi:10.1016/j.idc.2009.01.008. PMID 19393917.
- ^ a b c d Wiedermann, Ursula; Garner-Spitzer, Erika; Wagner, Angelika (2016). "Primary vaccine failure to routine vaccines: Why and what to do?". Human Vaccines & Immunotherapeutics. 12 (1): 239-243. doi:10.1080/21645515.2015.1093263. ISSN 2164-554X. PMC 4962729 $2. PMID 26836329.
- ^ Justiz Vaillant, AA; Ramphul, K (January 2022). Antibody Deficiency Disorder. Treasure Island, FL: StatPearls Publishing. PMID 29939682. Erişim tarihi: 18 Nisan 2022.
- ^ Reda, Shereen M.; Cant, Andrew J. (May 2015). "The importance of vaccination and immunoglobulin treatment for patients with primary immunodeficiency diseases (PIDs) - World PI Week April 22-29, 2015: FORUM". European Journal of Immunology (İngilizce). 45 (5): 1285-1286. doi:10.1002/eji.201570054. PMID 25952627. Erişim tarihi: 18 Nisan 2022.
- ^ Jo, Eun-Kyeong (December 2019). "Interplay between host and pathogen: immune defense and beyond". Experimental & Molecular Medicine (İngilizce). 51 (12): 1-3. doi:10.1038/s12276-019-0281-8. ISSN 2092-6413. PMC 6906370 $2. PMID 31827066.
- ^ a b Janeway, Charles A Jr.; Travers, Paul; Walport, Mark; Shlomchik, Mark J. (2001). "The Humoral Immune Response". Immunobiology: The Immune System in Health and Disease. 5th Edition (İngilizce). 2 Ocak 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2022.
- ^ Grubbs, Hailey; Kahwaji, Chadi I. (January 2022). Physiology, Active Immunity. Treasure Island, FL: StatPearls Publishing. PMID 29939682. 12 Kasım 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2022.
- ^ Gomes, M. Gabriela M.; White, Lisa J.; Medley, Graham F. (21 Haziran 2004). "Infection, reinfection, and vaccination under suboptimal immune protection: epidemiological perspectives". Journal of Theoretical Biology. 228 (4): 539-549. Bibcode:2004JThBi.228..539G. doi:10.1016/j.jtbi.2004.02.015. hdl:10400.7/53. ISSN 0022-5193. PMID 15178201. 19 Nisan 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Nisan 2022.
- ^ Bonanni, Paolo; Picazo, Juan José; Rémy, Vanessa (12 Ağustos 2015). "The intangible benefits of vaccination – what is the true economic value of vaccination?". Journal of Market Access & Health Policy. 3: 10.3402/jmahp.v3.26964. doi:10.3402/jmahp.v3.26964. ISSN 2001-6689. PMC 4802696 $2. PMID 27123182.
- ^ Stanciu, Stefan G. (24 Ağustos 2016). Micro and Nanotechnologies for Biotechnology (İngilizce). BoD – Books on Demand. ISBN 978-953-51-2530-3. 14 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Nisan 2022.
- ^ Frasca, Daniela; Diaz, Alain; Romero, Maria; Garcia, Denisse; Blomberg, Bonnie B. (6 Ekim 2020). "B Cell Immunosenescence". Annual Review of Cell and Developmental Biology. 36 (1): 551-574. doi:10.1146/annurev-cellbio-011620-034148. ISSN 1081-0706. PMC 8060858 $2. PMID 33021823. Erişim tarihi: 18 Nisan 2022.
- ^ Neighmond, Patti (7 Şubat 2010). "Adapting Vaccines For Our Aging Immune Systems". Morning Edition. NPR. 16 Aralık 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ocak 2014.
- ^ Schlegel M, Osterwalder JJ, Galeazzi RL, Vernazza PL (August 1999). "Comparative efficacy of three mumps vaccines during disease outbreak in Eastern Switzerland: cohort study". BMJ. 319 (7206): 352. doi:10.1136/bmj.319.7206.352. PMC 32261 $2. PMID 10435956.
- ^ Préziosi MP, Halloran ME (September 2003). "Effects of pertussis vaccination on disease: vaccine efficacy in reducing clinical severity". Clinical Infectious Diseases. 37 (6): 772-779. doi:10.1086/377270. PMID 12955637.
- ^ Miller, E.; Beverley, P. C. L.; Salisbury, D. M. (1 Temmuz 2002). "Vaccine programmes and policies". British Medical Bulletin. 62 (1): 201-211. doi:10.1093/bmb/62.1.201. ISSN 0007-1420. PMID 12176861.
- ^ Orenstein WA, Papania MJ, Wharton ME (May 2004). "Measles elimination in the United States". The Journal of Infectious Diseases. 189 Suppl 1 (Suppl 1): S1-3. doi:10.1086/377693. PMID 15106120.
- ^ a b c "Measles – United States, January 1 – April 25, 2008". MMWR. Morbidity and Mortality Weekly Report. 57 (18): 494-498. May 2008. PMID 18463608. 11 Ekim 2017 tarihinde kaynağından arşivlendi.
- ^ "WHO | Smallpox". WHO. World Health Organization. 22 Eylül 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Nisan 2019.
- ^ "WHO South-East Asia Region certified polio-free". WHO. 27 Mart 2014. 27 Mart 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Kasım 2014.
- ^ "Statement following the Twenty-Eighth IHR Emergency Committee for Polio". World Health Organization (İngilizce). 21 Mayıs 2021. 19 Nisan 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Nisan 2022.
- ^ Grassly, Nicholas C. (5 Ağustos 2013). "The final stages of the global eradication of poliomyelitis". Philosophical Transactions of the Royal Society B: Biological Sciences. 368 (1623): 20120140. doi:10.1098/rstb.2012.0140. ISSN 0962-8436. PMC 3720038 $2. PMID 23798688.
- ^ Ittefaq, Muhammad; Abwao, Mauryne; Rafique, Shanawer (3 Ağustos 2021). "Polio vaccine misinformation on social media: turning point in the fight against polio eradication in Pakistan". Human Vaccines & Immunotherapeutics. 17 (8): 2575-2577. doi:10.1080/21645515.2021.1894897. ISSN 2164-554X. PMC 8475597 $2. PMID 33705246.
- ^ "Disinformation disturbs anti-polio drives". The Express Tribune (İngilizce). 24 Ocak 2022. 10 Mayıs 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Nisan 2022.
- ^ "19 July 2017 Vaccines promoted as key to stamping out drug-resistant microbes "Immunization can stop resistant infections before they get started, say scientists from industry and academia."". 22 Temmuz 2017 tarihinde kaynağından arşivlendi.
- ^ Sullivan, Patricia (13 Nisan 2005). "Maurice R. Hilleman dies; created vaccines". Wash. Post. 20 Ekim 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ocak 2014.
- ^ Dudley, Matthew Z; Halsey, Neal A; Omer, Saad B; Orenstein, Walter A; O'Leary, Sean T; Limaye, Rupali J; Salmon, Daniel A (May 2020). "The state of vaccine safety science: systematic reviews of the evidence". The Lancet Infectious Diseases. 20 (5): e80-e89. doi:10.1016/s1473-3099(20)30130-4. ISSN 1473-3099. PMID 32278359. 22 Kasım 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ a b c d Maglione MA, Das L, Raaen L, Smith A, Chari R, Newberry S, Shanman R, Perry T, Goetz MB, Gidengil C (August 2014). "Safety of vaccines used for routine immunization of U.S. children: a systematic review". Pediatrics. 134 (2): 325-337. doi:10.1542/peds.2014-1079. PMID 25086160. 30 Ocak 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ a b c "Possible Side-effects from Vaccines". Centers for Disease Control and Prevention. 12 Temmuz 2018. 17 Mart 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Şubat 2014.
- ^ "Seasonal Flu Shot – Seasonal Influenza (Flu)". CDC. 2 Ekim 2018. 1 Ekim 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Eylül 2017.
- ^ Looker, Clare; Heath, Kelly (2011). "No-fault compensation following adverse events attributed to vaccination: a review of international programmes". Bulletin of the World Health Organization. Word Health Organisation. 89 (5): 371-378. doi:10.2471/BLT.10.081901. PMC 3089384 $2. PMID 21556305. 11 Ağustos 2013 tarihinde kaynağından arşivlendi.
- ^ "Vaccine Types". National Institute of Allergy and Infectious Diseases. 3 Nisan 2012. 5 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Ocak 2015.
- ^ Sinha JK, Bhattacharya S. A Text Book of Immunology (Google Books Preview). Academic Publishers. s. 318. ISBN 978-81-89781-09-5. Erişim tarihi: 9 Ocak 2014.
- ^ "Types of Vaccines". 29 Temmuz 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Ekim 2017.
- ^ Batah, Aly; Ahmad, Tarek (15 Haziran 2020). "The development of ghost vaccines trials". Expert Review of Vaccines (İngilizce). 19 (6): 549-562. doi:10.1080/14760584.2020.1777862. ISSN 1476-0584. PMID 32500816. 25 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ a b c "Different Types of Vaccines | History of Vaccines". www.historyofvaccines.org. 26 Ocak 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Haziran 2019.
- ^ "Different Types of Vaccines | History of Vaccines". www.historyofvaccines.org. 26 Ocak 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Mayıs 2019.
- ^ "Types of Vaccines". coastalcarolinaresearch.com. 3 Mayıs 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Mayıs 2019.
- ^ Philadelphia, The Children's Hospital of (18 Ağustos 2014). "A Look at Each Vaccine: Hepatitis B Vaccine". www.chop.edu. 31 Mayıs 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Haziran 2019.
- ^ "HPV Vaccine | Human Papillomavirus | CDC". www.cdc.gov. 13 Mayıs 2019. 18 Haziran 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Haziran 2019.
- ^ Williamson, E. D.; Eley, S. M.; Griffin, K. F.; Green, M.; Russell, P.; Leary, S. E.; Oyston, P. C.; Easterbrook, T.; Reddin, K. M. (December 1995). "A new improved sub-unit vaccine for plague: the basis of protection". FEMS Immunology and Medical Microbiology. 12 (3–4): 223-230. doi:10.1111/j.1574-695X.1995.tb00196.x. ISSN 0928-8244. PMID 8745007.
- ^ "Polysaccharide Protein Conjugate Vaccines". www.globalhealthprimer.emory.edu. 23 Haziran 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Haziran 2019.
- ^ a b c Pollard AJ, Bijker EM (22 Aralık 2020). "A guide to vaccinology: from basic principles to new developments". Nature Reviews Immunology. 21 (2): 83-100. doi:10.1038/s41577-020-00479-7. ISSN 1474-1741. PMC 7754704 $2. PMID 33353987.
- ^ Pol L, Stork M, Ley P (11 Kasım 2015). "Outer membrane vesicles as platform vaccine technology". Biotechnology Journal. 10 (11): 1689-1706. doi:10.1002/biot.201400395. ISSN 1860-7314. PMC 4768646 $2. PMID 26912077.
- ^ Scott (April 2004). "Classifying Vaccines" (PDF). BioProcesses International: 14-23. 12 Aralık 2013 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 9 Ocak 2014.
- ^ "Vaccine Types". Vaccines.org. Office of Infectious Disease of the United States Department of Health and Human Services. 23 Mayıs 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Mart 2021.
- ^ "Understanding and Explaining Viral Vector COVID-19 Vaccines". Centers for Disease Control and Prevention. 2 Şubat 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Mart 2021.
- ^ Garde, Damian; Feuerstein, Adam (1 Kasım 2020). "How nanotechnology helps mRNA Covid-19 vaccines work". STAT. 1 Aralık 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Aralık 2020.
- ^ CDC (11 Şubat 2020). "COVID-19 and Your Health". Centers for Disease Control and Prevention. 3 Mart 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Aralık 2020.
- ^ Banks, Marcus A. (16 Temmuz 2020). "What Are mRNA Vaccines, and Could They Work Against COVID-19?". Smithsonian Magazine. 21 Aralık 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Aralık 2020.
- ^ Branswell, Helen (19 Aralık 2020). "FDA grants authorization to Moderna's Covid-19 vaccine". STAT. 21 Aralık 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Aralık 2020.
- ^ Kim W, Liau LM (January 2010). "Dendritic cell vaccines for brain tumors". Neurosurgery Clinics of North America. 21 (1): 139-157. doi:10.1016/j.nec.2009.09.005. PMC 2810429 $2. PMID 19944973.
- ^ Anguille S, Smits EL, Lion E, van Tendeloo VF, Berneman ZN (June 2014). "Clinical use of dendritic cells for cancer therapy". The Lancet. Oncology. 15 (7): e257-267. doi:10.1016/S1470-2045(13)70585-0. PMID 24872109.
- ^ McKenzie, David (26 Mayıs 2018). "Fear and failure: How Ebola sparked a global health revolution". CNN. 26 Ağustos 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Mayıs 2018.
- ^ Meri S, Jördens M, Jarva H (December 2008). "Microbial complement inhibitors as vaccines". Vaccine. 26 Suppl 8: I113-117. doi:10.1016/j.vaccine.2008.11.058. PMID 19388175.
- ^ Lowe (2008). "Plasmid DNA as Prophylactic and Therapeutic vaccines for Cancer and Infectious Diseases". Plasmids: Current Research and Future Trends. Caister Academic Press. ISBN 978-1-904455-35-6.
- ^ Dorland's Medical Dictionary'de "Monovalent"
- ^ Polyvalent vaccine at Dorlands Medical Dictionary 7 Mart 2012 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ "Questions And Answers On Monovalent Oral Polio Vaccine Type 1 (mOPV1)'Issued Jointly By WHO and UNICEF'". Pediatric Oncall. 3. What advantages does mOPV1 have over trivalent oral polio vaccine (tOPV)?. 2 (8). 8 Ocak 2005. 29 Şubat 2012 tarihinde kaynağından arşivlendi.
- ^ Gizurarson, Sveinbj??rn (1998). "Clinically Relevant Vaccine-Vaccine Interactions: A Guide for Practitioners". BioDrugs. 9 (6): 443-453. doi:10.2165/00063030-199809060-00002.
- ^ Sutter RW, Cochi SL, Melnick JL (1999). "Live attenuated polio vaccines". Plotkin SA, Orenstein WA (Ed.). Vaccines. Philadelphia: W. B. Saunders. ss. 364-408.
- ^ Kanesa-thasan N, Sun W, Kim-Ahn G, Van Albert S, Putnak JR, King A, Raengsakulsrach B, Christ-Schmidt H, Gilson K, Zahradnik JM, Vaughn DW, Innis BL, Saluzzo JF, Hoke CH (April 2001). "Safety and immunogenicity of attenuated dengue virus vaccines (Aventis Pasteur) in human volunteers". Vaccine. 19 (23–24): 3179-3188. CiteSeerX 10.1.1.559.8311 $2. doi:10.1016/S0264-410X(01)00020-2. PMID 11312014.
- ^ Engler, Renata J. M.; Greenwood, John T.; Pittman, Phillip R.; Grabenstein, John D. (1 Ağustos 2006). "Immunization to Protect the US Armed Forces: Heritage, Current Practice, and Prospects". Epidemiologic Reviews. 28 (1): 3-26. doi:10.1093/epirev/mxj003. ISSN 0193-936X. PMID 16763072.
- ^ Sox, Harold C.; Liverman, Catharyn T.; Fulco, Carolyn E.; War, Institute of Medicine (US) Committee on Health Effects Associated with Exposures During the Gulf (2000). Vaccines. National Academies Press (US). 16 Kasım 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ "Institute for Vaccine Safety – Thimerosal Table". 10 Aralık 2005 tarihinde kaynağından arşivlendi.
- ^ Wharton, Melinda E.; National Vaccine Advisory committee "U.S.A. national vaccine plan" 4 Mayıs 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ "Measurements of Non-gaseous air pollutants > Metals". npl.co.uk. National Physics Laboratory. 29 Eylül 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Haziran 2020.
- ^ "Thimerosal in vaccines". Center for Biologics Evaluation and Research, U.S. Food and Drug Administration. 6 Eylül 2007. 6 Ocak 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Ekim 2007.
- ^ Bigham M, Copes R (2005). "Thiomersal in vaccines: balancing the risk of adverse effects with the risk of vaccine-preventable disease". Drug Safety. 28 (2): 89-101. doi:10.2165/00002018-200528020-00001. PMID 15691220.
- ^ Offit PA (September 2007). "Thimerosal and vaccines – a cautionary tale". The New England Journal of Medicine. 357 (13): 1278-1279. doi:10.1056/NEJMp078187. PMID 17898096.
- ^ March 5, Reuters Updated; 2019 (5 Mart 2019). "Another study, this one of 657k kids, finds MMR vaccine doesn't cause autism | Montreal Gazette". National Post. Erişim tarihi: 13 Mart 2019.
- ^ Hoffman, Jan (5 Mart 2019). "One More Time, With Big Data: Measles Vaccine Doesn't Cause Autism". The New York Times. ISSN 0362-4331. 12 Mart 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Mart 2019.
- ^ CDC (12 Temmuz 2018). "Ingredients of Vaccines – Fact Sheet". 17 Aralık 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Aralık 2009.
- ^ Nutrition, Center for Food Safety and Applied (25 Şubat 2022). "Mercury Levels in Commercial Fish and Shellfish (1990-2012)". FDA (İngilizce). 23 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ a b Centers for Disease Control and Prevention (12 Kasım 2020), U.S. Vaccine Names, 21 Ağustos 2021 tarihinde kaynağından arşivlendi, erişim tarihi: 21 Ağustos 2021.
- ^ a b Centers for Disease Control and Prevention (7 Ağustos 2018), Tetanus (Lockjaw) Vaccination, 16 Mayıs 2016 tarihinde kaynağından arşivlendi, erişim tarihi: 21 Mayıs 2016.
- ^ Centers for Disease Control and Prevention (2 Şubat 2018), Vaccine Acronyms and Abbreviations [Abbreviations used on U.S. immunization records], 2 Haziran 2017 tarihinde kaynağından arşivlendi, erişim tarihi: 22 Mayıs 2017.
- ^ a b c d e f g h i "Principles and considerations for adding a vaccine to a national immunization programme" (PDF). World Health Organization. 1 Nisan 2014. 29 Eylül 2020 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 17 Ağustos 2020.
- ^ Bok, Karin; Sitar, Sandra; Graham, Barney S.; Mascola, John R. (August 2021). "Accelerated COVID-19 vaccine development: milestones, lessons, and prospects". Immunity. 54 (8): 1636-1651. doi:10.1016/j.immuni.2021.07.017. PMC 8328682 $2. PMID 34348117.
- ^ a b c d Wijnans, Leonoor; Voordouw, Bettie (11 Aralık 2015). "A review of the changes to the licensing of influenza vaccines in Europe". Influenza and Other Respiratory Viruses. 10 (1): 2-8. doi:10.1111/irv.12351. ISSN 1750-2640. PMC 4687503 $2. PMID 26439108.
- ^ Offit, Paul A. (2020). "Making vaccines: Licensure, recommendations and requirements". Children's Hospital of Philadelphia. 8 Eylül 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Ağustos 2020.
- ^ a b Toner E, Barnill A, Krubiner C, Bernstein J, Privor-Dumm L, Watson M, Martin E, Potter C, Hosangadi D, Connell N, Watson C, Schoch-Spana M, Veenema TG, Meyer D, Biddison EL, Regenberg A, Inglesby T, Cicero A (2020). Interim Framework for COVID-19 Vaccine Allocation and Distribution in the United States (PDF). Baltimore, MD: Johns Hopkins Center for Health Security. 22 Ağustos 2020 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 24 Ağustos 2020.
- ^ Dooling, Kathleen; Marin, Mona; Wallace, Megan; McClung, Nancy; Chamberland, Mary; Lee, Grace M.; Talbot, H. Keipp; Romero, José R.; Bell, Beth P.; Oliver, Sara E. (December 2020). "The Advisory Committee on Immunization Practices' Updated Interim Recommendation for Allocation of COVID-19 Vaccine – United States, December 2020". MMWR. Morbidity and Mortality Weekly Report. 69 (5152): 1657-1660. doi:10.15585/mmwr.mm695152e2. PMC 9191902 $2. PMID 33382671.
- ^ a b c d e "Vaccine product approval process". U.S. Food and Drug Administration (FDA). 30 Ocak 2020. 27 Eylül 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Ağustos 2020.
- ^ "home". Cdsco.gov.in. 15 Nisan 2021. 4 Ocak 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Ocak 2022.
- ^ Steffen, Christoph A.; Henaff, Louise; Durupt, Antoine; El Omeiri, Nathalie; Ndiaye, Sidy; Batmunkh, Nyambat; Liyanage, Jayantha B. L.; Hasan, Quamrul; Mosina, Liudmila; Jones, Ian; O'Brien, Katherine; Hombach, Joachim (8 Nisan 2021). "Evidence-informed vaccination decision-making in countries: Progress, challenges and opportunities". Vaccine. Elsevier. 39 (15): 2146-2152. doi:10.1016/j.vaccine.2021.02.055. PMID 33712350.
- ^ "ACIP Vaccine Recommendations Home Page". CDC. 15 Kasım 2013. 31 Aralık 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Ocak 2014.
- ^ "Vaccine Status Table". Red Book Online. American Academy of Pediatrics. 26 Nisan 2011. 27 Aralık 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Ocak 2013.
- ^ "HPV Vaccine Safety". Centers for Disease Control and Prevention (CDC). 20 Aralık 2013. 10 Kasım 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Ocak 2014.
- ^ "HPV vaccine in the clear". NHS choices. 2 Ekim 2009. 10 Ocak 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Ocak 2014.
- ^ "Zostavax EPAR". European Medicines Agency (EMA). 29 Temmuz 2021. 5 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Eylül 2021.
- ^ Dooling, Kathleen (13 Ağustos 2021). "The Advisory Committee on Immunization Practices' Updated Interim Recommendation for Allocation of COVID-19 Vaccine – United States, December 2020" (PDF). CDC the Advisory Committee on Immunization Practices. 69 (5152): 1657-1660. PMC 9191902 $2. PMID 33382671. 19 Ağustos 2021 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 18 Nisan 2023.
- ^ Hunziker, Patrick (24 Temmuz 2021). "Personalized-dose Covid-19 vaccination in a wave of virus Variants of Concern: Trading individual efficacy for societal benefit". Precision Nanomedicine (İngilizce). 4 (3): 805-820. doi:10.33218/001c.26101. ISSN 2639-9431. 9 Ekim 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ Goodman, Jesse L. (4 Mayıs 2005). "Statement by Jesse L. Goodman, M.D., M.P.H. Director Center for Biologics, Evaluation and Research Food and Drug Administration U.S. Department of Health and Human Services on US Influenza Vaccine Supply and Preparations for the Upcoming Influenza Season before Subcommittee on Oversight and Investigations Committee on Energy and Commerce United States House of Representatives". 21 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Haziran 2008.
- ^ Olesen OF, Lonnroth A, Mulligan B (January 2009). "Human vaccine research in the European Union". Vaccine. 27 (5): 640-645. doi:10.1016/j.vaccine.2008.11.064. PMC 7115654 $2. PMID 19059446.
- ^ Jit M, Newall AT, Beutels P (April 2013). "Key issues for estimating the impact and cost-effectiveness of seasonal influenza vaccination strategies". Human Vaccines & Immunotherapeutics. 9 (4): 834-840. doi:10.4161/hv.23637. PMC 3903903 $2. PMID 23357859.
- ^ Newall AT, Reyes JF, Wood JG, McIntyre P, Menzies R, Beutels P (February 2014). "Economic evaluations of implemented vaccination programmes: key methodological challenges in retrospective analyses". Vaccine. 32 (7): 759-765. doi:10.1016/j.vaccine.2013.11.067. PMID 24295806.
- ^ Roser, Max; Vanderslott, Samantha (10 Mayıs 2013). "Vaccination". Our World in Data. 1 Eylül 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ "Increasing Access to Vaccines Through Technology Transfer and Local Production" (PDF). World Health Organization. 2011. 23 Kasım 2015 tarihinde kaynağından arşivlendi (PDF).
- ^ Christy Somos (7 Mayıs 2021). "Everything you need to know about the WTO's COVID-19 vaccine patent proposal". CTV News. 23 Mayıs 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Mayıs 2021.
- ^ a b Gomez, Phillip L.; Robinson, James M.; Rogalewicz, James (2008). "Chapter 4: Vaccine Manufacturing". Plotkin, Stanley A.; Orenstein, Walter A.; Offit, Paul A. (Ed.). Vaccines (5. bas.). New York: Saunders Elsevier. ss. 45-58. ISBN 9781437721584. Erişim tarihi: 26 Mart 2021.
- ^ a b c Plotkin, Stanley; Robinson, James M.; Cunningham, Gerard; Iqbal, Robyn; Larsen, Shannon (24 Temmuz 2017). "The complexity and cost of vaccine manufacturing – An overview". Vaccine. 35 (33): 4064-4071. doi:10.1016/j.vaccine.2017.06.003. PMC 5518734 $2. PMID 28647170.
- ^ "Three ways to make a vaccine" (infographic). 23 Aralık 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Ağustos 2015, in Stein, Rob (24 Kasım 2009). "Vaccine system remains antiquated". The Washington Post. 19 Ekim 2017 tarihinde kaynağından arşivlendi.
- ^ a b Muzumdar JM, Cline RR (2009). "Vaccine supply, demand, and policy: a primer". Journal of the American Pharmacists Association. 49 (4): e87-99. doi:10.1331/JAPhA.2009.09007. PMC 7185851 $2. PMID 19589753.
- ^ a b "Components of a vaccine". 13 Haziran 2017 tarihinde kaynağından arşivlendi.
- ^ a b Bae K, Choi J, Jang Y, Ahn S, Hur B (April 2009). "Innovative vaccine production technologies: the evolution and value of vaccine production technologies". Archives of Pharmacal Research. 32 (4): 465-480. doi:10.1007/s12272-009-1400-1. PMID 19407962.
- ^ "Vaccine Taskforce Aims" (PDF). assets.publishing.service.gov.uk. 6 Nisan 2020. 26 Temmuz 2020 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 26 Temmuz 2020.
- ^ Pagliusi, Sonia; Jarrett, Stephen; Hayman, Benoit; Kreysa, Ulrike; Prasad, Sai D.; Reers, Martin; Hong Thai, Pham; Wu, Ke; Zhang, Youn Tao; Baek, Yeong Ok; Kumar, Anand (July 2020). "Emerging manufacturers engagements in the COVID −19 vaccine research, development and supply". Vaccine (İngilizce). 38 (34): 5418-5423. doi:10.1016/j.vaccine.2020.06.022. PMC 7287474 $2. PMID 32600908.
- ^ Miller, Joe; Kuchler, Hannah (28 Nisan 2020). "Drugmakers race to scale up vaccine capacity". www.ft.com (İngilizce). 10 Aralık 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Temmuz 2020.
- ^ a b c d e f Plotkin, Stanley A.; Orenstein, Walter A.; Offit, Paul A.; Edwards, Kathryn M. (2017). Vaccines. Elsevier. ISBN 9780323393010.
- ^ Morein B, Hu KF, Abusugra I (June 2004). "Current status and potential application of ISCOMs in veterinary medicine". Advanced Drug Delivery Reviews. 56 (10): 1367-1382. doi:10.1016/j.addr.2004.02.004. PMID 15191787.
- ^ American Medicine. American-Medicine Publishing Company. 1926.
- ^ South African Institute for Medical Research (1929). Annual report [Jaarverslag]. South African Institute for Medical Research – Suid-Afrikaanse Instituut vir Mediese Navorsing.
- ^ Khan, Firdos Alam (20 Eylül 2011). Biotechnology Fundamentals. CRC Press. s. 270. ISBN 978-1-4398-2009-4.
- ^ Giudice EL, Campbell JD (April 2006). "Needle-free vaccine delivery". Advanced Drug Delivery Reviews. 58 (1): 68-89. doi:10.1016/j.addr.2005.12.003. PMID 16564111.
- ^ WHO to trial Nanopatch needle-free delivery system| ABC News, 16 Sep 2014| "Needle-free polio vaccine a 'game-changer'". ABC News. 16 Eylül 2014. 2 Nisan 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Eylül 2015.
- ^ "Australian scientists develop 'needle-free' vaccination". The Sydney Morning Herald. 18 Ağustos 2013. 25 Eylül 2015 tarihinde kaynağından arşivlendi.
- ^ "Vaxxas raises $25m to take Brisbane's Nanopatch global". Business Review Weekly. 10 Şubat 2015. 16 Mart 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Mart 2015.
- ^ "Australian scientists develop 'needle-free' vaccination". The Hindu. Chennai, India. 28 Eylül 2011. 1 Ocak 2014 tarihinde kaynağından arşivlendi.
- ^ "Needle-free nanopatch vaccine delivery system". News Medical. 3 Ağustos 2011. 11 Mayıs 2012 tarihinde kaynağından arşivlendi.
- ^ Patel JR, Heldens JG (March 2009). "Immunoprophylaxis against important virus disease of horses, farm animals and birds". Vaccine. 27 (12): 1797-1810. doi:10.1016/j.vaccine.2008.12.063. PMC 7130586 $2. PMID 19402200.
- ^ a b Berkelman RL (August 2003). "Human illness associated with use of veterinary vaccines". Clinical Infectious Diseases. 37 (3): 407-414. doi:10.1086/375595. PMID 12884166.
- ^ van Oirschot JT, Rziha HJ, Moonen PJ, Pol JM, van Zaane D (June 1986). "Differentiation of serum antibodies from pigs vaccinated or infected with Aujeszky's disease virus by a competitive enzyme immunoassay". The Journal of General Virology. 67 (Pt 6) (6): 1179-1182. doi:10.1099/0022-1317-67-6-1179. PMID 3011974.
- ^ a b van Oirschot JT (August 1999). "Diva vaccines that reduce virus transmission". Journal of Biotechnology. 73 (2–3): 195-205. doi:10.1016/S0168-1656(99)00121-2. PMID 10486928.
- ^ van Oirschot JT, Gielkens AL, Moormann RJ, Berns AJ (June 1990). "Marker vaccines, virus protein-specific antibody assays and the control of Aujeszky's disease". Veterinary Microbiology. 23 (1–4): 85-101. doi:10.1016/0378-1135(90)90139-M. PMID 2169682.
- ^ Kaashoek MJ, Moerman A, Madić J, Rijsewijk FA, Quak J, Gielkens AL, van Oirschot JT (April 1994). "A conventionally attenuated glycoprotein E-negative strain of bovine herpesvirus type 1 is an efficacious and safe vaccine". Vaccine. 12 (5): 439-444. doi:10.1016/0264-410X(94)90122-8. PMID 8023552.
- ^ Hulst MM, Westra DF, Wensvoort G, Moormann RJ (September 1993). "Glycoprotein E1 of hog cholera virus expressed in insect cells protects swine from hog cholera". Journal of Virology. 67 (9): 5435-5442. doi:10.1128/JVI.67.9.5435-5442.1993. PMC 237945 $2. PMID 8350404.
- ^ Capua I, Terregino C, Cattoli G, Mutinelli F, Rodriguez JF (February 2003). "Development of a DIVA (Differentiating Infected from Vaccinated Animals) strategy using a vaccine containing a heterologous neuraminidase for the control of avian influenza". Avian Pathology. 32 (1): 47-55. doi:10.1080/0307945021000070714. PMID 12745380.
- ^ Maas A, Meens J, Baltes N, Hennig-Pauka I, Gerlach GF (November 2006). "Development of a DIVA subunit vaccine against Actinobacillus pleuropneumoniae infection". Vaccine. 24 (49–50): 7226-7237. doi:10.1016/j.vaccine.2006.06.047. PMID 17027123.
- ^ Leyman B, Boyen F, Van Parys A, Verbrugghe E, Haesebrouck F, Pasmans F (May 2011). "Salmonella Typhimurium LPS mutations for use in vaccines allowing differentiation of infected and vaccinated pigs". Vaccine. 29 (20): 3679-3685. doi:10.1016/j.vaccine.2011.03.004. hdl:1854/LU-1201519. PMID 21419163. 28 Ekim 2017 tarihinde kaynağından arşivlendi.
- ^ Needham, Joseph (2000). Science and Civilisation in China: Volume 6, Biology and Biological Technology, Part 6, Medicine. Cambridge University Press. s. 154. ISBN 9780521632621.
- ^ a b Williams, Gareth (2010). Angel of Death. Basingstoke: Palgrave Macmillan. ISBN 978-0-230-27471-6.
- ^ Silverstein, Arthur M. (2009). A History of Immunology (2. bas.). Academic Press. s. 293. ISBN 9780080919461.
- ^ Voltaire (1742). "Letter XI". Letters on the English.
- ^ Fenner, F.; Henderson, D.A.; Arita, I.; Jezek, Z.; Ladnyi, I.D. (1988). Smallpox and its Eradication. Cenevre: World Health Organization. ISBN 92-4-156110-6.
- ^ a b Baxby, Derrick (1984). "A Death from Inoculated Smallpox in the English Royal Family". Med Hist. 28 (3): 303-307. doi:10.1017/s0025727300035961. PMC 1139449 $2. PMID 6390027.
- ^ a b c Stern AM, Markel H (2005). "The history of vaccines and immunization: familiar patterns, unew challenges". Health Affairs. 24 (3): 611-621. doi:10.1377/hlthaff.24.3.611. PMID 15886151.
- ^ Dunn PM (January 1996). "Dr Edward Jenner (1749-1823) of Berkeley, and vaccination against smallpox" (PDF). Archives of Disease in Childhood: Fetal and Neonatal Edition. 74 (1): F77-78. doi:10.1136/fn.74.1.F77. PMC 2528332 $2. PMID 8653442. 8 Temmuz 2011 tarihinde kaynağından (PDF) arşivlendi.
- ^ Burgen, Stephen (27 Temmuz 2021). "Exhibition tells story of Spanish children used as vaccine 'fridges' in 1803". The Guardian (İngilizce). ISSN 0261-3077. 30 Ağustos 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 17 Nisan 2023.
- ^ Van Sant JE (2008). "The Vaccinators: Smallpox, Medical Knowledge, and the 'Opening' of Japan". J Hist Med Allied Sci. 63 (2): 276-279. doi:10.1093/jhmas/jrn014.
- ^ Didgeon JA (May 1963). "Development of Smallpox Vaccine in England in the Eighteenth and Nineteenth Centuries". British Medical Journal. 1 (5342): 1367-1372. doi:10.1136/bmj.1.5342.1367. PMC 2124036 $2. PMID 20789814.
- ^ Louten, Jennifer (2016). Essential Human Virology. Academic Press. ss. 134-135. ISBN 9780128011713.
- ^ Baarda BI, Sikora AE (2015). "Proteomics of Neisseria gonorrhoeae: the treasure hunt for countermeasures against an old disease". Frontiers in Microbiology. 6: 1190. doi:10.3389/fmicb.2015.01190. PMC 4620152 $2. PMID 26579097; Access provided by the University of Pittsburgh.
- ^ a b c Alarcon JB, Waine GW, McManus DP (1999). "DNA Vaccines: Technology and Application as Anti-parasite and Anti-microbial Agents". Advances in Parasitology Volume 42. Advances in Parasitology. 42. ss. 343-410. doi:10.1016/S0065-308X(08)60152-9. ISBN 9780120317424. PMID 10050276.
- ^ Robinson HL, Pertmer TM (2000). DNA vaccines for viral infections: basic studies and applications. Advances in Virus Research. 55. ss. 1-74. doi:10.1016/S0065-3527(00)55001-5. ISBN 9780120398553. PMID 11050940.
- ^ Naftalis, Kramer Levin; Royzman, Frankel LLP-Irena; Pineda, ré (30 Kasım 2020). "Third-Generation Vaccines Take Center Stage in Battle Against COVID-19 | Lexology". www.lexology.com (İngilizce). 30 Ocak 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Ocak 2021.
- ^ Regalado, Antonio. "The U.S. government has begun testing its first Zika vaccine in humans". 21 Ağustos 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2016.
- ^ Chen Y, Wang S, Lu S (February 2014). "DNA Immunization for HIV Vaccine Development". Vaccines. 2 (1): 138-159. doi:10.3390/vaccines2010138. PMC 4494200 $2. PMID 26344472.
- ^ "Katalin Karikó and Drew Weissman Awarded Horwitz Prize for Pioneering Research on COVID-19 Vaccines". Columbia University Irving Medical Center (İngilizce). 12 Ağustos 2021. 16 Ağustos 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Eylül 2021.
- ^ Staff (28 Mart 2013). "Safer vaccine created without virus". The Japan Times. Agence France-Presse – Jiji Press. 30 Mart 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mart 2013.
- ^ Spohn G, Bachmann MF (February 2008). "Exploiting viral properties for the rational design of modern vaccines". Expert Review of Vaccines. 7 (1): 43-54. doi:10.1586/14760584.7.1.43. PMID 18251693.
- ^ Samuelsson O, Herlitz H (March 2008). "Vaccination against high blood pressure: a new strategy". Lancet. 371 (9615): 788-789. doi:10.1016/S0140-6736(08)60355-4. PMID 18328909.
- ^ Poland GA, Jacobson RM, Ovsyannikova IG (May 2009). "Trends affecting the future of vaccine development and delivery: the role of demographics, regulatory science, the anti-vaccine movement, and vaccinomics". Vaccine. 27 (25–26): 3240-3244. doi:10.1016/j.vaccine.2009.01.069. PMC 2693340 $2. PMID 19200833.
- ^ Sala F, Manuela Rigano M, Barbante A, Basso B, Walmsley AM, Castiglione S (January 2003). "Vaccine antigen production in transgenic plants: strategies, gene constructs and perspectives". Vaccine. 21 (7–8): 803-808. doi:10.1016/s0264-410x(02)00603-5. PMID 12531364.
- ^ Kumar GB, Ganapathi TR, Revathi CJ, Srinivas L, Bapat VA (October 2005). "Expression of hepatitis B surface antigen in transgenic banana plants". Planta. 222 (3): 484-493. doi:10.1007/s00425-005-1556-y. PMID 15918027.
- ^ The Lancet Child & Adolescent Health (2019). "Vaccine hesitancy: a generation at risk". The Lancet. 3 (5): 281. doi:10.1016/S2352-4642(19)30092-6. PMID 30981382.
- ^ Smith, MJ (November 2015). "Promoting Vaccine Confidence". Infectious Disease Clinics of North America (Review). 29 (4): 759-69. doi:10.1016/j.idc.2015.07.004. PMID 26337737.
- ^ Larson, HJ; Jarrett, C; Eckersberger, E; Smith, DM; Paterson, P (April 2014). "Understanding vaccine hesitancy around vaccines and vaccination from a global perspective: a systematic review of published literature, 2007–2012". Vaccine. 32 (19): 2150-59. doi:10.1016/j.vaccine.2014.01.081. PMID 24598724.
- ^ Cataldi, Jessica; O'Leary, Sean (2021). "Parental vaccine hesitancy: scope, causes, and potential responses". Current Opinion in Infectious Diseases. 34 (5): 519-526. doi:10.1097/QCO.0000000000000774. PMID 34524202. 27 Ekim 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ "Communicating science-based messages on vaccines". Bulletin of the World Health Organization. 95 (10): 670-71. October 2017. doi:10.2471/BLT.17.021017. PMC 5689193 $2. PMID 29147039.
- ^ "Why do some people oppose vaccination?". Vox. 21 Eylül 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Kasım 2018.
- ^ Ceccarelli, Leah. "Defending science: How the art of rhetoric can help". The Conversation (İngilizce). 5 Kasım 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Kasım 2018.
- ^ U.S. Department of Health and Human Services. "Vaccines.gov". Vaccines.gov (İngilizce). 13 Mart 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Ağustos 2018.
- ^ "Frequently Asked Questions (FAQ)". Boston Children's Hospital. 17 Ekim 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Şubat 2014.
- ^ Phadke VK, Bednarczyk RA, Salmon DA, Omer SB (March 2016). "Association Between Vaccine Refusal and Vaccine Preventable Diseases in the United States: A Review of Measles and Pertussis". JAMA. 315 (11): 1149-58. doi:10.1001/jama.2016.1353. PMC 5007135 $2. PMID 26978210.
- ^ Wolfe R, Sharp L (2002). "Anti-vaccinationists past and present". BMJ. 325 (7361): 430-2. doi:10.1136/bmj.325.7361.430. PMC 1123944 $2. PMID 12193361. 25 Ağustos 2006 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ Poland GA, Jacobson RM (January 2011). "The age-old struggle against the antivaccinationists". The New England Journal of Medicine. 364 (2): 97-99. doi:10.1056/NEJMp1010594. PMID 21226573. 5 Mart 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
- ^ Wallace A (19 Ekim 2009). "An epidemic of fear: how panicked parents skipping shots endangers us all". Wired. 25 Aralık 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Ekim 2009.
- ^ Poland GA, Jacobson RM (March 2001). "Understanding those who do not understand: a brief review of the anti-vaccine movement". Vaccine. 19 (17–19): 2440-45. doi:10.1016/S0264-410X(00)00469-2. PMID 11257375.
- ^ "Ten threats to global health in 2019". Who.int (İngilizce). 27 Haziran 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Aralık 2020.
- ^ PM, Aristos Georgiou (15 Ocak 2019). "The anti-vax movement has been listed by WHO as one of its top 10 health threats for 2019" (İngilizce). 22 Kasım 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Ocak 2019.
Konuyla ilgili yayınlar[değiştir | kaynağı değiştir]
- Hall E, Wodi AP, Hamborsky J, Morelli V, Schillie S, (Ed.) (2021). Epidemiology and Prevention of Vaccine-Preventable Diseases (14. bas.). Washington D.C.: U.S. Centers for Disease Control and Prevention (CDC). 30 Aralık 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Nisan 2023.
Dış bağlantılar[değiştir | kaynağı değiştir]
- Curlie'de Aşılar ve Antiserumlar (DMOZ tabanlı)
- DSÖ Aşıyla önlenebilir hastalıklar ve bağışıklama 27 Eylül 2013 tarihinde Wayback Machine sitesinde arşivlendi.
- Dünya Sağlık Örgütünün aşılara ilişkin pozisyon belgeleri
- Philadelphia Doktorlar Kolejinden Aşıların Tarihi 6 Aralık 2020 tarihinde Wayback Machine sitesinde arşivlendi.
