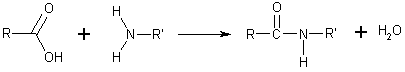Amid

Kimyada amit sözcüğü iki anlama sahiptir: - Birinci anlamıyla amit, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup, veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amit, bir azot anyonudur.
Birinci anlamıyla amit, bir amin türevidir, azota bağlı ornatıklardan biri bir asil grubudur. Genelde R1(CO)NR2R3 formülü ile gösterilir, burda R2 ve R3'ten biri veya ikisi birden hidrojen olabilir. Başka bir bakış açısıyla amitler bir karboksilik asit türevi olarak da sayılabilirler, hidroksil grubu bir amin veya amonyakla yer değiştirmiştir.
Amit sözcüğünün ikinci bir anlamı, amonyak (NH3) veya bir aminin protonsuz hali olan amit anyonudur. Genelde [R1NR2]- formülü ile gösterilir. Çok zayıf bir bazdır, çünkü amonyak ve türevleri, Brønsted asitleri olarak çok zayıftırlar.
Bir amin veya amonyaktaki azotun üzerindeki bir hidrojen atomunun bir metal katyonu ile değişmiş olduğu bileşikler de amit olarak bilinirler, bunlara azanid de denir.
Bu maddenin kalan kısmı amit sözcüğünün karbonil-azot anlamı hakkındadır. Anyonik amitlere örnek olarak Sodyum amit ve lityum diizopropilamit maddelerine bakınız.
Amit sentezi
- Amitler genel olarak karboksilik asidin bir aminle tepkimesi ile oluşurlar. Amino asitler arasında peptit bağlarını oluşturan bu tepkimedir. Bu amitler hidrojen bağı alıcısı ve vericisi olarak hidrojen bağları oluşturabilirler ama sulu çözeltilerde iyonlaşmazlar, oysa onları meydana getiren asit ve aminler nötral pH'de tamamen suda çözünürler. Amit oluşumu bazı yoğunlaşma polimerlerinin sentezinde rol oynar, örneğin naylon ve Aramid (Kevlar) gibi.
- Halkalı amitler Beckman düzenlenmesi ile oksimlerden sentezlenir.
- Amitler Willgerodt-Kindler reaksiyonunda aril alkil ketonlar, kükürt ve morfolinlerden hazırlanabilirler.
- Diğer amit oluşturan tepkimeler arasında Passerini tepkimesi ve Ugi tepkimesi bulunur.
Amit tepkimeleri
- Amitler amit hidrolizi yoluyla parçalanabilirler.
- Vilmeier-Haack tepkimesinde bir amit bir imine dönüşebilir.
- Hofmann düzenlenmesiyle birincil amitler birincil aminlere dönüşürler.
Amitler carbonil fonksiyonle gruplarının en kararlısıdır. Rezonans stabilizasyonu nedeniyle amitler fizyolojik şartlarda göreceli tepkisizdirler, benzer esterlerden dahi. Buna rağmen, amitler gene de tepkimeye girebilirler, genelde eğer karbonil atomuna bir elektronegatif atom saldırınca karbonil çift bağı kırılır ve tetrahedral bir ara bileşik oluşur. Amide saldıran fonksiyonel grup bir tiol, hidroksil veya amin olursa meydana gelen molekül bir siklol olarak, veya daha özel olarak, sırasıyla, tiasiklol, oksasiklol veya azasiklol olarak adlandırılır.
Normal şartlarda amidin protonu ayrışmaz: pKa'sı genelde 15'in üzerindedir. Ancak, aşırı asit şartlarda karbonik oksijen yaklaşık pKa= -1 ile protonlaşabilir.
Amitlerin özellikleri
Amit bağı kinetik olarak hidroliz olmaz. Ancak hem kaynayan alkalide, hem de kuvvetli asit şartlarda hidrolize olabilir. Biyokimyada amit bağlarına peptit bağı denir. Amit bağları proteinin tanımlayıcı özelliklerinden biridir, proteinlerin ikincil yapıları kısmen amitlerin hidrojen bağı kurma özelliğine bağlıdır.
Aminlere kıyasla amitler zayıf bazlardir. Bir aminin eşlenik asidinin pKa'sı 9.5 dolayındayken, bir amidin eşlenik asidinin pKa'sı -0.5'tir. Dolayısiyla amitlerin suda pek belirgin asit-baz özellikleri yoktur. Bu bazlık noksanlığı karbonil grubunun elektron çekici özelliği ile açıklanır. Azottaki yalnız elektron çifti rezonans sonucu karbonil grubuna delokalize olur, karbonille bir çift bağ oluşturarak oksijende bir eksi yük oluşmasına neden olur. Öte yandan amitler karboksilik asitlere, esterlere, aldehitlere ve ketonlara kıyasla çok daha güçlü bazlardır, (eşlenik asit pKa'sı -6 ile -10 arasındadır).
Çözünürlük
Amitler, elektronegatif oksijen ve azot atomları ile elektro-nötür karbon atomları arasında kovalent bağlanmadan meydana gelen karbonil (C=O) ve eter (N-C) dipollerine sahiptir. Birincil ve ikincil amitler de, sırasıyla, iki ve bir N-H dipole sahiptirler. Karbonilin pi-bağlanma düzeninden ve oksijenin daha yüksek olan elektronegatifliği nedeniyle, karbonil (C=O) dipolu N-C dipolundan daha güçlüdür. C=O dipolunun varlığı ve N-C dipolunun da daha düşük oranda katkısı, amitlerin H-bağı alıcısı olmalarını sağlar. Dolayısıyla amitler su ve diğer protik çözücülerle hidrojen bağı kurabilir. Oksijen ve azot atomları sudan hidrojen bağları alırlar, N-H hidrojen atomarı da H-bağları verirler. Bu etkileşimler sayesinde amitlerin suda çözünürlükleri benzer hidrokarbonlardan daha yüksektir.
Hidrojen bağları hidrokarbonlara kıyasla amitleri suda daha çok çözünür yapsa da, tipik olarak amitlerin suda çözünürlüğü az sayılır. Benzer alkol ve karboksilik asitlere kıyasla daha az çözünürler çünkü 1) iyonlaşmazlar, 2) polar olmayan hidrokarbon kısımları vardır, ve 3) üçüncül amitler suya hidrojen bağı veremezler (ancak hidrojen bağı alıcısı olabilirler). Bu yüzden amitlerin suda çözünürlükleri esterlerinkine benzer. Genelde amitler benzer amin ve karboksilik asitlerden daha az çözünürler, çünkü bu bileşikler hem hidrojen bağı verici hem de alıcısıdırlar, ve uygun pH'lerde iyonlaşarak çözünürlüklerini daha da artırablirler.
Türevler
Sülfonamitlerde oksijene çift bağ yapan atom kabon değil kükürttür.
Halkalı amitlere laktam denir.
Adlandırma konvansiyonları
- CH3CONH2 asetamit veya etanamit olarak adlandırılır.
- Başka örnekler: propan-1-amit, N,N-dimetilpropanamit, akrilamit
- Daha fazla ayrıntı için IUPAC organik kimya adlandırma sistemi - Aminler ve Amitler maddesine bakınız.