Kloröz asit
| |

| |
| Adlandırmalar | |
|---|---|
Kloröz asit | |
| Tanımlayıcılar | |
| ChEBI | |
| ChemSpider | |
PubChem CID
|
|
CompTox Bilgi Panosu (EPA)
|
|
| Özellikler | |
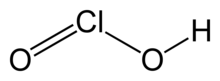
| Molekül formülü | HClO2 |
| Molekül kütlesi | 68.46 g/mol |
| Asitlik (pKa) | 1.96 |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Kloröz asit, HClO2 formülüne sahip bir inorganik bileşiktir. Zayıf bir asittir. Klor, bu asitte +3 oksidasyon durumuna sahiptir. Saf madde dengesiz, hipokloröz aside (Cl oksidasyon hali + 1) ve klorik aside (Cl oksidasyon hali + 5) orantısızdır:
2 HClO2 → HClO + HClO3
Asidin saf maddede elde edilmesi zor olsa da, bu asitten elde edilen konjugat baz kararlıdır. Bu anyonun bir tuzunun bir örneği iyi bilinen sodyum klorittir. Bu ve ilgili tuzlar bazen klor dioksit üretiminde kullanılır.
Hazırlama
HClO2, baryum veya kurşun klorit ve seyreltik sülfürik asidin tepkimesi yoluyla hazırlanabilir:
Ba(ClO2)2 + H2SO4 → BaSO4 + 2 HClO2
Pb(ClO2)2 + H2SO4 → PbSO4 + 2 HClO2
Kararlılık
Kloröz asit, güçlü bir oksitleyici etkenidir, ancak orantısızlık eğilimi, oksitleyici potansiyelini önler.
Klor, HXO2 formülünün izole edilebilir bir asidini oluşturan tek halojendir.[1] Ne bromöz asit ne de iyodöz asit hiç izole edilmemiştir. Birkaç tane bromöz asit tuzu, bromitler bilinmektedir, ancak iyodu yoktur.[1]
Kaynakça
- ^ a b Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier 0-12-352651-5
| İnorganik kimya ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. |
