Dietil eter: Revizyonlar arasındaki fark
| [kontrol edilmiş revizyon] | [kontrol edilmemiş revizyon] |
Khutuck Bot (mesaj | katkılar) k Tarih bağlantısı düzenleme |
Üretim. Etiketler: Mobil değişiklik Mobil ağ değişikliği Gelişmiş mobil değişikliği |
||
| 126. satır: | 126. satır: | ||
}} |
}} |
||
'''Dietil eter''' |
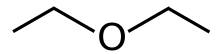
'''Dietil eter''' kısaca '''eter''' olarak da bilinen berrak, renksiz, uçucu, kolay yanan ve parlayabilen bir bileşiktir. [[Kaynama noktası]] düşük olup tatlı, karakteristik bir kokusu vardır. Toksisitesi çok düşüktür, zehirsiz sayılabilir. [[Eterler]] olarak bilinen kimyasal bileşik sınıfının en genel üyesidir. [[Bütanol]]ün izomeridir. Formülü CH<sub>3</sub>-CH<sub>2</sub>-O-CH<sub>2</sub>-CH<sub>3</sub> şeklindedir. Genelde anestetik madde olarak kullanıldığı gibi aynı zamanda genel bir [[çözücü]]dür. |
||
== Üretim == |
|||
Dietil eter genellikle [[etanol]] üretiminde [[etilen]]in hidrasyonunda yan ürün olarak ortaya çıkmaktadır. Bu işlemde katalizör olarak katı [[fosforik asit]] kullanılır ve daha fazla eter üretimi için ayarlanabilir. [[Alüminyum oksit]] üzerinde etanolün dehidratasyonu ile %95 oranına kadar dietil eter elde edilebilir.<ref>{{cite book |title=Ethyl Ether, Chem. Economics Handbook |year=1991 |publisher=SRI International |location=Menlo Park, Calif |isbn= }}</ref> |
|||
Hem laboratuvarda, hem de sanayi yüksek miktarlarda, asit eter sentezi yoluyla dietil eter üretilebilir.<ref>{{cite book|last=Cohen|first=Julius Berend|title=A Class-book of Organic Chemistry, Volume 1|year=1920|publisher=Macmillan and Co.|location=London|page=[https://archive.org/details/aclassbookorgan00cohegoog/page/n53 39]|url=https://archive.org/details/aclassbookorgan00cohegoog|quote=the structure of ethyl alcohol cohen julius diethyl ether.}}</ref> Etanol, [[sülfürik asit]] gibi güçlü bir [[asit]] ile karıştırılır, asit sulu ortamda proton vererek hidronyum (H<sub>3</sub>O<sup>+</sup>) iyonları oluşturur. Asidin hidrojeni, etanolün elektronegatif oksijenine proton verdiğinde etanol pozitif yüklenir: |
|||
:CH<sub>3</sub>CH<sub>2</sub>OH + H<sub>3</sub>O<sup>+</sup> → CH<sub>3</sub>CH<sub>2</sub>OH<sub>2</sub><sup>+</sup> + H<sub>2</sub>O |
|||
Protonlanmamış etanolün oksijen atomu ile protonlanmış diğer etanol molekülünden bir su molekülü çıkararak su, dietil eter ve hidrojen iyonu oluşturur. |
|||
: CH<sub>3</sub>CH<sub>2</sub>OH<sub>2</sub><sup>+</sup> + CH<sub>3</sub>CH<sub>2</sub>OH → H<sub>2</sub>O + H<sup>+</sup> + CH<sub>3</sub>CH<sub>2</sub>OCH<sub>2</sub>CH<sub>3</sub> |
|||
Bu tepkime etilen oluşmasını önlemek amacıyla 150 °C'den düşük ısılarda gerçekleştirilmelidir. Dietil eterin oluşma tepkimesi tersine dönebileceğinden ötürü oluşan dietil eter hemen damıtılmalıdır. |
|||
Dietil eter, Williamson eter sentezi yoluyla bir etil alkoksit ile etil halojenürden elde edilebilir. |
|||
Fabrikasyonu iki şekilde yapılmaktadır: |
|||
# [[Etil alkol]]ün [[sülfürik asit]] (H<sub>2</sub>SO<sub>4</sub>) ile [[dehidrasyon]]u |
|||
# [[Etilen]]den eter fabrikasyonu |
|||
{{Genel anestezikler}} |
{{Genel anestezikler}} |
||
Sayfanın 02.12, 12 Ağustos 2020 tarihindeki hâli
| |
| Adlandırmalar | |
|---|---|
Ethoxyethane | |
Etoksietan | |
Diğer adlar Etil eter, Etil oksit, Dietil oksit, 3-oksapentan | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| ECHA InfoCard | 100.000.425 |
CompTox Bilgi Panosu (EPA)
|
|
| |
| Özellikler | |
| Kimyasal formül | C4H10O |
| Molekül kütlesi | 74,12 g mol−1 |
| Görünüm | Renksiz sıvı |
| Yoğunluk | 0.7134 g/cm3 |
| Erime noktası | -116.3°C |
| Kaynama noktası | 34.6°C |
| Buhar basıncı | 440 mmHg |
| Termokimya | |
Isı sığası (C)
|
172.5 J/mol·K |
Standart molar entropi (S⦵298)
|
253.5 J/mol·K |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Aşırı derecede yanıcı, havada patlayıcı peroksitler oluşturabilir |
| NFPA 704 (yangın karosu) |
|
| Benzeyen bileşikler | |
Benzeyen
|
çözücü |
Benzeyen bileşikler
|
Kloroform, Dimetil Eter |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Dietil eter kısaca eter olarak da bilinen berrak, renksiz, uçucu, kolay yanan ve parlayabilen bir bileşiktir. Kaynama noktası düşük olup tatlı, karakteristik bir kokusu vardır. Toksisitesi çok düşüktür, zehirsiz sayılabilir. Eterler olarak bilinen kimyasal bileşik sınıfının en genel üyesidir. Bütanolün izomeridir. Formülü CH3-CH2-O-CH2-CH3 şeklindedir. Genelde anestetik madde olarak kullanıldığı gibi aynı zamanda genel bir çözücüdür.
Üretim
Dietil eter genellikle etanol üretiminde etilenin hidrasyonunda yan ürün olarak ortaya çıkmaktadır. Bu işlemde katalizör olarak katı fosforik asit kullanılır ve daha fazla eter üretimi için ayarlanabilir. Alüminyum oksit üzerinde etanolün dehidratasyonu ile %95 oranına kadar dietil eter elde edilebilir.[1] Hem laboratuvarda, hem de sanayi yüksek miktarlarda, asit eter sentezi yoluyla dietil eter üretilebilir.[2] Etanol, sülfürik asit gibi güçlü bir asit ile karıştırılır, asit sulu ortamda proton vererek hidronyum (H3O+) iyonları oluşturur. Asidin hidrojeni, etanolün elektronegatif oksijenine proton verdiğinde etanol pozitif yüklenir:
- CH3CH2OH + H3O+ → CH3CH2OH2+ + H2O
Protonlanmamış etanolün oksijen atomu ile protonlanmış diğer etanol molekülünden bir su molekülü çıkararak su, dietil eter ve hidrojen iyonu oluşturur.
- CH3CH2OH2+ + CH3CH2OH → H2O + H+ + CH3CH2OCH2CH3
Bu tepkime etilen oluşmasını önlemek amacıyla 150 °C'den düşük ısılarda gerçekleştirilmelidir. Dietil eterin oluşma tepkimesi tersine dönebileceğinden ötürü oluşan dietil eter hemen damıtılmalıdır.
Dietil eter, Williamson eter sentezi yoluyla bir etil alkoksit ile etil halojenürden elde edilebilir.
| Wikimedia Commons'ta Dietil eter ile ilgili ortam dosyaları bulunmaktadır. |
- ^ Ethyl Ether, Chem. Economics Handbook. Menlo Park, Calif: SRI International. 1991.
- ^ Cohen, Julius Berend (1920). A Class-book of Organic Chemistry, Volume 1. London: Macmillan and Co. s. 39.
the structure of ethyl alcohol cohen julius diethyl ether.

