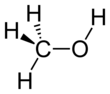
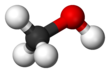
Metanol
| |||
| |||

| |||
| Adlandırmalar | |||
|---|---|---|---|
Methanol | |||
Metanol | |||
Diğer adlar Metil alkol, karbinol, metil hidroksit, metilol, hidroksimetan, odun ruhu, odun alkolü | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| Kısaltmalar | MeOH | ||
| 1098229 | |||
| ChEBI | |||
| ECHA InfoCard | 100.000.599 | ||
| EC Numarası |
| ||
| 449 | |||
| KEGG | |||
| MeSH | Methanol | ||
PubChem CID
|
|||
| UN numarası | 1230 | ||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Molekül formülü | CH3OH veya CH4O | ||
| Molekül kütlesi | 32,04 | ||
| Görünüm | renksiz sıvı | ||
| Koku | Zayıf ve etanole benzer | ||
| Yoğunluk | 0,792 g/cm3 | ||
| Erime noktası | -97,6 °C (-143,7 °F; 175,6 K) | ||
| Kaynama noktası | 64,7 °C (148,5 °F; 337,8 K) | ||
| Çözünürlük (su içinde) | karışabilir | ||
| log P | −0,69 | ||
| Buhar basıncı | 13,02 kPa (20 °C'de) | ||
| Asitlik (pKa) | 15,5[1] | ||
| Konjuge asit | Metiloksonyum[2] | ||
| Konjuge baz | Metanolat[3] | ||
| -21,40·10−6 cm3/mol | |||
| Kırınım dizimi (nD) | 1,33141[4] | ||
| Akmazlık | 0,545 mPa·s (25 °C'de)[5] | ||
| Dipol momenti | 1,69 D | ||
| Termokimya | |||
| 725,7 kJ/mol, 173,4 kcal/mol, 5,77 kcal/g | |||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | Metanol ve buharları yanıcıdır.
Küçük hayvanlar için orta derecede zehirlidir - Büyük hayvanlar ve insanlar için (yüksek konsantrasyonlarda) yüksek derecede zehirlidir - Yutulması halinde ölümcül/öldürücü olabilir veya körlüğe; karaciğer, böbrek ve kalp hasarına yol açabilir - Tekrarlayan aşırı maruziyetten kaynaklanan toksiklik etkileri, özellikle optik sinir olmak üzere merkezî sinir sistemi üzerinde birikici bir etkiye sahiptir - Belirtiler gecikebilir, 12 ila 18 saat sonra şiddetli hâle gelebilir ve maruziyetten sonra birkaç gün boyunca devam edebilir.[7] | ||
| GHS etiketleme sistemi: | |||
| Piktogramlar |    [6] [6]
| ||
| İşaret sözcüğü | Tehlike[6] | ||
| Tehlike ifadeleri | H225, H301, H302, H305, H311, H331, H370[6] | ||
| Önlem ifadeleri | P210, P233, P235, P240, P241, P242, P243, P260, P264, P270, P271, P280, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P307+P311, P310, P311, P312, P337+P313, P361, P363, P370+P378, P403+P233, P405, P501[6] | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | 11 ila 12 °C (52 ila 54 °F; 284 ila 285 K) | ||
| 470 °C (878 °F; 743 K)[12] 385 °C (725 °F; 658 K)[13] | |||
| Patlama sınırları | %6–36[8] | ||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LD50 (medyan doz)
|
5628 mg/kg (sıçan, oral) 7300 mg/kg (fare, oral) 12880 mg/kg (sıçan, oral) 14200 mg/kg (tavşan, oral)[9] | ||
LC50 (medyan konsantrasyon)
|
64.000 ppm (sıçan, 4 sa)[9] | ||
LCLo (yayınlanan en düşük)
|
33.082 ppm (kedi, 6 sa) 37.594 ppm (fare, 2 sa)[9] | ||
| NIOSH ABD maruz kalma limitleri: | |||
| PEL (izin verilen) | TWA 200 ppm (260 mg/m3)[8] | ||
| REL (tavsiye edilen) | TWA 200 ppm (260 mg/m3) ST 250 ppm (325 mg/m3) [deri][8] | ||
| IDLH (anında tehlike) | 6000 ppm[8] | ||
| Güvenlik bilgi formu (SDS) | [1] | ||
| Benzeyen bileşikler | |||
Benzeyen bileşikler
|
Metantiyol Silanol Etanol | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Metanol ya da metil alkol (CH3OH ya da kısaca MeOH), en basit yapılı alkoldür. Geçmişte odunun damıtılması ile elde edildiğinden odun alkolü ya da odun ruhu denir. Günümüzde metanol, karbonmonoksit ile hidrojenin yüksek basınç altında yüksek sıcaklıklara maruz bırakılması ile üretilir. Renksiz, uçucu, hafif alkol kokulu, suyla tamamen karışan bir sıvıdır. Metanol, sıklıkla kullanılan iyi bir çözücü ve yakıttır.
Metanol, polar bir hidroksil grubuna bağlı bir metil grubundan oluşur. Yılda 20 milyon tondan fazla üretilen Formaldehit, asetik asit, metil tert-bütil eter, metil benzoat, anisol, peroksiasitler ve daha özel kimyasallar dahil olmak üzere diğer ticari kimyasalların öncülü olarak kullanılır.
Özellikleri[değiştir | kaynağı değiştir]
Saf metanol 1 atm'de 64,7 derecede kaynayan renksiz, akışkan bir sıvı olup, parlak olmayan mavimsi bir alevle yanar. Alevleri günışığında görünmez. Etanolünkine benzer bir kokusu vardır. Bütün organik çözücülerde her oranda çözünür.

Molekülleri birbirine güçlü hidrojen bağları ile bağlı olduğundan aynı oksijen ve karbon sayılı bileşiklere nazaran metanolün kaynama noktası daha yüksektir. Etanolün aksine, metanol su ile azeotrop oluşturmaz ve su-metanol karışımları damıtılarak ayrıştırılabilir.
Tarihi[değiştir | kaynağı değiştir]
Eski Mısırlılar, mumyalama işleminde, ahşabın pirolizinden elde ettikleri metanol de dâhil olmak üzere bir madde karışımı kullandılar. Bununla birlikte, saf metanol ilk olarak 1661'de Robert Boyle tarafından şimşirin kuru kuruya damıtılması yoluyla ürettiğinde izole edildi.[14] Daha sonra "pyroxylic spirit" ("piroksilik alkol") olarak bilinmeye başlandı. 1834'te Fransız kimyagerler Jean-Baptiste Dumas ve Eugene Peligot elemental bileşimini belirlediler.[15]
Elde edilişi[değiştir | kaynağı değiştir]

Metanol ilk defa 1661'de Robert Boyle tarafından odunun kuru damıtılması (havasız ortamda yüksek ısı verilmesi) ile elde edildi. Damıtma ürününde %1,5-3 metanol, %10 asetik asit, %0,5 aseton ve başkaları bulunmaktadır.
Endüstride, karbonmonoksit ile hidrojenin reaksiyonundan elde edilir. Bu metodla saf metanol elde edilirse de sıcaklığın 30-40 derece yükselmesi hâlinde n-propanol ve izobütanol teşekkül edebilir.
Fraksiyonlu destilasyonla sulu çözeltisinden %99’luk bir saflıkta elde edilir. Susuz (mutlak) metanol elde etmek için Mg kullanılır:
- 2 CH3OH + Mg → (CH3O)2Mg + H2
- (CH3O)2Mg + H2O → 2 CH3OH + MgO
Güvenlik[değiştir | kaynağı değiştir]
Metanol çok yanıcıdır. Buharları havadan biraz daha ağırdır, seyahat edebilir ve tutuşabilir. Metanol yangınları kuru toz, karbondioksit, su spreyi veya alkole dayanıklı köpükle söndürülmelidir. Metanol alevleri günışığında görünmez.
Toksisite[değiştir | kaynağı değiştir]

Metanol insanlar için oldukça toksiktir. 10 ml kadar küçük bir miktardaki saf metanol içildiğinde, optik sinirleri hasarladığından kalıcı körlüğe sebep olur. 30 ml kadar bir miktarın içilmesi ise ölümcüldür[16] Ortalama ölümcül doz ise 100 ml'dir (vücut ağırlığının kg başına 1-2 ml saf metanol).[17] Koku ve görünüm açısından etanol (içkilerde bulunan alkol) ile benzerliklerinden ötürü, ayırımlarını yapmak zordur.
Metanol iki mekanizma ile toksik olabilir. İlkinde, metanol (ağız yoluyla, solunum, deriden absorbe ederek vücuda alındığında), etanol zehirlenmesi gibi merkezî sinir sistemi (MSS) baskılayıcısı olarak ölümcül olabilir. İkincisi ise, toksikasyon sürecidir ve metanol, formik asite metabolize olur. Metanol, alkol dehidrojenaz (ADH) aracılığıyla formaldehite ve sonrasında formaldehit, aldehit dehidrojenaz (ALDH) aracılığıyla formik asite (format) dönüşür. ALDH ile dönüşüm tamdır, yani geride tespit edilebilecek formaldehit kalmaz.[18] Format iyonları, mitokondriyal sitokrom c oksidazı engellediğinden ötürü toksiktir yani hücresel seviyede hipoksi söz konusudur. Ayrıca, metabolik asidoz gibi pek çok metabolik bozukluklara sebep olur.[19]
Metanol zehirlenmesi, panzehiri olan etanol veya fomepizol ile tedavi edilebilir. Her iki bileşik, alkol dehidrojenazın metanol üzerine olan etkisini yarışmalı inhibisyon ile indirger. Bu şekilde metanol, toksik metabolitlere dönüşüm yerine böbrekler ile vücuttan atılır. Akabindeki tedavi, metabolik asidoz için sodyum bikarbonatın verilmesi ve metanol ile formatın kandan uzaklaştırılması için hemodiyaliz olabilir. Folinik asit/folik asit de formatın metabolize edilmesini kuvvetlendirmek açısından uygulanmaktadır.
Metanol zehirlenmesinin başlıca semptomları; MSS baskılanması, baş ağrısı, baş dönmesi, bulantı, koordinasyon kaybı ve sersemlik hâlidir. Çok yüksek doların alınımı bilinç kaybı ve ölümle sonuçlanabilir. Bu belirtilerin 10-30 saat sonrasında görmede bulanıklık/kayıp ve asidoz gözlenir. Bu semptomlar, formatın toksik seviyede kanda birikiminden kaynaklanır ve solunum güçlüğüne neden olarak ölüm ile sonuçlanabilir.
Gıda metabolizması sonucundan üretilen ufak miktarlardaki metanol, zararsız olup hızlı ve tam bir şekilde metabolize edilir.
Kaynakça[değiştir | kaynağı değiştir]
- ^ Ballinger, P.; Long, F. A. (1960). "Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds". J. Am. Chem. Soc. 82 (4): 795-798. doi:10.1021/ja01489a008.
- ^ "Methyloxonium". pubchem.ncbi.nlm.nih.gov. 21 Aralık 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Aralık 2018.
- ^ "Methanolate". pubchem.ncbi.nlm.nih.gov. 21 Aralık 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Aralık 2018.
Methoxide is an organic anion that is the conjugate base of methanol. ... It is a conjugate base of a methanol.
- ^ "RefractiveIndex.INFO – Refractive index database". refractiveindex.info. 23 Şubat 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 14 Şubat 2012.
- ^ González, Begoña (2007). "Density, dynamic viscosity, and derived properties of binary mixtures of methanol or ethanol with water, ethyl acetate, and methyl acetate at T = (293.15, 298.15, and 303.15) K". The Journal of Chemical Thermodynamics. 39 (12): 1578-1588. doi:10.1016/j.jct.2007.05.004.
- ^ a b c d "Methanol" (PDF). Lab Chem. Valtech. 10 Mart 2016 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 10 Mart 2016.
- ^ Toxicity on PubChem 20 Ağustos 2018 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0397". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c "Methanol". Immediately Dangerous to Life or Health Concentrations (IDLH). Ulusal İş Sağlığı ve Güvenliği Enstitüsü (NIOSH).
- ^ Kaynak hatası: Geçersiz
<ref>etiketi;CDC_cardisimli refler için metin sağlanmadı (Bkz: Kaynak gösterme) - ^ "Methanol Safe Handling Manual" (PDF). Methanol Institute. 2017. s. 253. 20 Aralık 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 3 Ağustos 2018.
- ^ "Technical Information & Safe Handling Guide for Methanol". Methanex Corporation. 11 Mart 2012 tarihinde kaynağından arşivlendi.
- ^ "Methanol Safe Handling Manual" (PDF). Methanol Institute. 2017. s. 243. 20 Aralık 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 3 Ağustos 2018.
- ^ Robert Boyle, The Sceptical Chymist
- ^ Procès-verbaux des séances de l'Académie, 10 : 600–601. Available on: Gallica 25 Nisan 2015 tarihinde Wayback Machine sitesinde arşivlendi.. The complete report appears in: J. Dumas and E. Péligot (1835) [https://books.google.com/books?id=xSs8oDQV4uYC&&pg=PA44
- ^ Vale A (2007). "Methanol". Medicine. 35 (12): 633-4. doi:10.1016/j.mpmed.2007.09.014.
- ^ "Methanol Poisoning Overview". Antizol. 5 Ekim 2011 tarihinde kaynağından arşivlendi.
- ^ McMartin KE, Martin-Amat G, Noker PE, Tephly TR (1979). "Lack of a role for formaldehyde in methanol poisoning in the monkey". Biochem. Pharmacol. 28 (5): 645-9. doi:10.1016/0006-2952(79)90149-7. PMID 109089.
- ^ Liesivuori J, Savolainen H (Eylül 1991). "Methanol and formic acid toxicity: biochemical mechanisms". Pharmacol. Toxicol. 69 (3): 157-63. doi:10.1111/j.1600-0773.1991.tb01290.x. PMID 1665561.
Konuyla ilgili yayınlar[değiştir | kaynağı değiştir]
- Biochem. Pharmacol. 28 (5): 645–9. doi:10.1016/0006-2952(79)90149-7. PMID 109089.
- Casavant MJ (Jan 2001). "Fomepizole in the treatment of poisoning". Pediatrics 107 (1): 170. doi:10.1542/peds.107.1.170. PMID 11134450.
- Brent J (May 2009). "Fomepizole for ethylene glycol and methanol poisoning". N Engl J Med 360 (21): 2216–23. doi:10.1056/NEJMct0806112. PMID 19458366.
- Schep LJ, Slaughter RJ, Vale JA, Beasley DM (Sep 30 2009). "A seaman with blindness and confusion". BMJ 339: b3929. doi:10.1136/bmj.b3929. PMID 19793790.
Dış bağlantılar[değiştir | kaynağı değiştir]
- National Pollutant Inventory - Methanol bilgi sayfası
- The Methanol Institute20 Haziran 2014 tarihinde Wayback Machine sitesinde arşivlendi. Alternatif yakıt olarak Methanol
- Methanol ile çalışan laptoplar 2 Temmuz 2006 tarihinde Wayback Machine sitesinde arşivlendi.
- Molview from bluerhinos.co.uk 3 boyutlu Methanol
- Uzayda keşfedilen Methanol
- Methanol as an alternative fuel29 Temmuz 2014 tarihinde Wayback Machine sitesinde arşivlendi. Recording of a discussion with Nobel laureate George Olah broadcast on NPR.