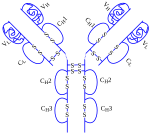
Adalimumab
Bu madde, Vikipedi biçem el kitabına uygun değildir. (Ekim 2017) |
| Adalimumab | |
|---|---|
| Kaynak | İnsan |
| Hedef | TNF |
| Molekül ağırlığı | 144190.3 g/mol |
| Kimyasal formül | C6428H9912N1694O1987S46 |
| CAS numarası | 331731-18-1 |
| ATC kodu | L04AA17 |
| DrugBank | BTD00049 |
| Biyoyararlanım | %64 |
| Eliminasyon yarı ömrü | 10-20 gün |
| Uygulama yolu | Subkutan enjeksiyon |
| Gebelik kategorisi | ABD'de B,Avustralya'da C |
| Yasal statü | Reçeteyle satılır. |
| Kaynakça ve sorumluluk reddi | |
Adalimumab (ticari adı HUMIRA), infliksimab ve etanercept'ten sonra FDA onayını almış olan üçüncü TNF inhibitörüdür.[1] Tıpkı onlar gibi, adalimumab da TNFα'ya bağlanarak, onun kendi almaçlarına bağlanmasını önelemektedir; adalimumab tamamen insan monoklonal antikoru kullanılarak üretilmiştir, oysa infliksimab bir fare-insan chimeric antikorudur ve etanercept ise TNF almaç-IgG füzyon proteinidir. TNFα'ya bağlanarak sitokini inhibe eder ve böylece makrojların ve bazı T lenfosit hücrelerinin down-regülasyonunu sağlar, böylece immün yanıt düzenlenmiş olur.[2] 2008 itibarıyla adalimumab FDA tarafından Romatoid Artrit, Psoriatik Artrit, Ankilozan spondilit, Crohn hastalığı,orta ve ileri derecede ciddi Sedef hastalığı ve Juvenil İdyopatik Artrit tedavisi için onaylanmıştır. Humira (müstahzar adı "Human Monoclonal Antibody in Rheumatoid Arthritis" yani "Romatoid Artritte İnsan Monoklonal Antikoru"nun kısaltmasıdır) 0,8ml şırınga ya da Otoenjektör olarak satılmaktadır, her ikisi de subkutan olarak enjekte edilirler, genellikle hasta evinde kendisi bu işlemi yapar. Oral yolla kullanımı uygun değildir, çünkü sindirim sisteminde parçalanmaktadır. Yarı ömürü 10-20 gündür.
Humira'nın üreticisi Abbott Laboratories adlı firmadır.
Molekül DSÖ'nün Temel İlaçlar Listesi'nde yer almaktadır.
Kullanım Alanları[değiştir | kaynağı değiştir]
Adalimumab, diğer TNF inhibitörü rakipleri, infliximab ve etanercept gibi, birçok farklı koşulda etkili terapötik özelliklere sahiptir.
Romatoid Artrit[değiştir | kaynağı değiştir]
Adalimumab yetişkinlerde orta ya da ileri derecede ciddi Romatoid Artrit durumunda kullanıldığında hastalığın semtomlarını belirgin biçimde azaltmaktadır. Ayrıca 4 yaş ve üstü çocuklarda JIA(Juvenil Idyopatik Artrit) tedavisinde kullanımı da onaylanmıştır. RA'da tek başına ya da metotreksat ile birlikte kullanılabilir.
Psoriatik Artrit[değiştir | kaynağı değiştir]
Adalimumab tek başına ya da diğer ilaçlarla birlikte kullanıldığında Psoriatik Artrit semtomlarının azalmasını sağlamaktadır.
Ankilozan spondilit[değiştir | kaynağı değiştir]
Adalimumab yetişkinlerde Ankilozan spondilit tedavisinde etkili bir ilaçtır.
Crohn hastalığı[değiştir | kaynağı değiştir]
Adalimumab Crohn hastalığı semtomlarının düzelmesini sağlamaktadır.[3] Diğer ilaçlarla hatta infliksimab ile tedaviye yanıt vermeyen orta ve ileri derecede ciddi Crohn hastalığı tedavisinde onaylanmıştır.
Plak psoriasisi[değiştir | kaynağı değiştir]
Adalimumab, vücudunun birçok bölgesinde lezyonları olan, sistemik hap tedavisi ya da fototerapi alan orta ya da ileri derecede ciddî plak psoriasisi vakalarında endikedir.
Behçet Hastalığı[değiştir | kaynağı değiştir]
FDA ya da başka bir kuruluş tarafından lisanlandırılmış olmasa da, bazı araştırmalarda adalimumabın Behçet hastalığına karşı etkili olduğunu sonucuna varılmıştır.[4]
Güvenilirlik[değiştir | kaynağı değiştir]
Adalimumab bir immünsüpresif sınıfı ilaçtır ve bu yüzden ciddi güvenilirlik tartışmaları vardır,potansiyel fatal ajan olabilir. İlaç onaylandıktan sonra yapılan çalışmalarda tüberkülozu da kapsayan birçok bakteriyel, viral, fungal enfeksiyonların,ciddi hematolojik bozuklukların, nadiren de lenfoma ve solid doku tümörlerinin riskini artırdığı, nadiren ciddi karaciğer hasarı yaptığı,yine ender de olsa kalp yetmezliğini ve demyelinizan hastalıkları tetiklediği gösterilmiştir. Bunun üzerine Amerikan Gıda ve İlaç Dairesi FDA, ilaca bir kara kutu uyarısı eklemiş ve onların adalimumab tedavisindeki hastaları sık sık ve ciddi bir biçimde gözlemlemeleri gerektiğini söylemiştir. FDA'nın koyduğu etiket: http://www.rxabbott.com/pdf/humira_medguide.pdf 13 Kasım 2008 tarihinde Wayback Machine sitesinde arşivlendi.
Gebelik kategorisi B'dir.[5]
Tarihçe[değiştir | kaynağı değiştir]
- 1 Nisan 1995: Cambridge Antibody Technology Limited Knoll Aktiengesellschaft[6] ile anlaşma imzalar
- 2 Mart 2001: Abbott Laboratories Knoll Pharmaceuticals 'ı BASF'den satın alır.
- Haziran, 2001: ARMADA, çift-kör, plasebo-kontrollü, metotreksat tedavisine yanıt vermemiş 271 romatoid artrit hastasını kapsayan klinik deneme sonuçları açıklandı. Hastaların %50'si ACR skoru bakımından %50 ilerleme sağlamıştı.
- 31 Aralık 2002: Humira FDA tarafından onaylanmıştır.
Benzer etkili ajanlar[değiştir | kaynağı değiştir]
Kaynakça[değiştir | kaynağı değiştir]
- Katzung, Bertram G. Basic & Clinical Pharmacology. McGraw-Hill, 2018, pp 653–654.
- ^ "Biyolojik Ajanlar" (PDF). 2014. 15 Temmuz 2019 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 22 Kasım 2020.
- ^ "Adalimumab" (PDF). TURKDERM. 2016. 21 Nisan 2018 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 22 Kasım 2020.
- ^ Podolsky, Daniel K. (Ağustos 2002). "Inflammatory bowel disease". New England Journal of Medicine. 346 (6). ss. 417-29. doi:10.1056/NEJMra020831. PMID 12167685. 5 Ocak 2010 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Temmuz 2006.
- ^ Ishigatsubo, Yoshiaki; Ueda, Atsuhisa; Takeno, Mitsuhiro (Nisan 2015). "Adalimumab in the management of Behçet's disease". Therapeutics and Clinical Risk Management (İngilizce): 611. doi:10.2147/TCRM.S56163. ISSN 1178-203X. PMC 4403514 $2. PMID 25926738. 30 Eylül 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Kasım 2020.
- ^ "Adalimumab (Humira)" (PDF). Türk Romatoloji Derneği. 14 Temmuz 2019 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 22 Kasım 2020.
- ^ [1] 21 Eylül 2013 tarihinde Archive.is sitesinde arşivlendi Cambridge Antibody Technology website
Dış bağlantılar[değiştir | kaynağı değiştir]
- HUMIRA Official site 2 Ocak 2021 tarihinde Wayback Machine sitesinde arşivlendi.
- myHUMIRA Official site 6 Şubat 2012 tarihinde Wayback Machine sitesinde arşivlendi.
- Google Timeline Search